美洲大蠊提取物CII-3体内外抗HSV-2实验研究
2014-03-23普小菲罗亦佳牛春丽
普小菲,罗亦佳,彭 丽,李 娇 ,曾 菁,牛春丽,彭 芳*
(1.大理学院药学与化学学院,云南大理 671000;2.云南省昆虫生物医药研发重点实验室,云南大理 671000;3.大理学院外国语学院,云南大理 671003;4.德宏州芒市人民医院,云南德宏 678400)
近年来,生殖器疱疹(genital herpes,GH)的发病率在许多国家不断上升,它已成为日益普遍的性传播疾病,据WHO估计每年GH的新发病例约2000万〔1〕。目前引起GH最常见的病因是HSV感染,其中90%的病原体是HSV-2(Ⅱ型单纯疱疹病毒,Herpes simplex virus-2)。目前,临床上抗HSV的首选药物为阿昔洛韦(acyclovir,ACV),它是核苷类药物,选择性高,对正常细胞毒性较小。然而,ACV口服吸收差,约15%~30%由胃肠道吸收,长期使用有一定副作用,可引起接触性皮炎及容易产生耐药性〔2〕。因此,研发高效、低毒、不易产生耐药性的抗HSV新药具有重要意义。昆虫是自然界中最大的生物类群,有着独特的免疫体系,它为天然药物的开发提供了一种新的资源。美洲大蠊(Periplaneta Americana)属昆虫纲蜚蠊目蜚蠊科,俗称“蟑螂”。自70年代以来,有研究人员对美洲大蠊进行了大量研究,先后开发出了美洲大蠊系列昆虫药品,如康复新液〔3〕、肝龙胶囊〔4〕、心脉隆注射液〔5〕等。但蟑螂药材中是否存在着抗病毒活性成分是不清楚的,因此本实验用美洲大蠊提取物CII-3进行了体内外抗HSV-2作用的研究,为美洲大蠊临床抗病毒应用提供参考依据。
1 实验材料
1.1 药物 美洲大蠊提取物CII-3为黄褐色冻干粉末,由大理学院药学与化学学院张成桂博士提供。制备方法:将美洲大蠊干燥虫体粉碎后,用15倍量95%乙醇冷浸提取3次,所得乙醇液合并、浓缩后得到浸膏。将浸膏上聚酰胺柱,依次用水和不同比例的含水甲醇洗脱,定量收集,分别浓缩。其中某一划段成分经冷冻干燥后即得到所需的样品。经过计算,所提取物占生药的比率为0.2%。注射用阿昔洛韦(湖北科益药业股份有限公司,批号:20120704-2)。
1.2 细胞与病毒 Vero细胞株(非洲绿猴肾细胞,中国科学院昆明细胞库馈赠);HSV-2(II型单纯疱疹病毒,江苏省南通市疾病预防控制中心馈赠)。
1.3 动物 昆明种雌性小鼠,SPF级,体重(18±2)g,许可证号:SCXK(滇)NO.0020922,购于昆明医学院动物实验中心。
1.4 试剂盒 小鼠α肿瘤坏死因子(TNF-α)酶联免疫检测试剂盒;小鼠γ干扰素(IFN-γ)酶联免疫检测试剂盒;小鼠白细胞介素-2(IL-2)酶联免疫检测试剂盒,均购于南京建成生物工程研究所。
1.5 仪器 电子分析天平(梅特勒-托利多仪器上海有限公司,METTLERAE240型);电动离心机(金坛市恒丰仪器厂,LXJ-A型);超低速离心机(SiG⁃mA 1-14型);CO2培养箱(德国Heraeus公司,BB16UV/BB5060UV型);酶标仪(美国BioTek公司,SN255939型);超级纯水机(成都康宁实验专用纯水设备厂,KL-UP-UV-20型);电热恒温水浴锅(上海-恒科技有限公司,HWS12型);旋涡混合器(上海精科实业有限公司,XW-80A型)。
2 实验方法
2.1 美洲大蠊提取物CII-3对HSV-2的体外药效学试验
细胞存活率(%)=给药组OD值/正常细胞对照组OD值×100%
细胞生长抑制率(%)=100%-细胞存活率
TC50=Antilog[B+(50-<50%抑制百分率)/(>50%抑制百分率-<50%抑制百分率)]×C
其中C=A-B,A=log(抑制率>50%的药物浓度),B=log(抑制率<50%的药物浓度)。
2.1.2 病毒滴度测定 待细胞长成单层后弃生长液,将稀释度为 10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9的病毒液分别加到板内,每孔100 μL,每个稀释度设4个复孔,同时设正常细胞对照组。于37℃、5%CO2培养箱内培养72~96 h后,在倒置显微镜下观察细胞病变效应(Cytopatic effect,CPE),并判断结果,按下列公式计算组织细胞培养半数感染量(Tissue culture half infection dosage ,TCID50)〔6-7〕。
TCID50=病变率大于50%组稀释度的对数+距离比×稀释系数的对数
距离比=(大于50%组的病变率-50%的病变率)/(大于50%组的病变率-小于50%组的病变率)
其中“病变率大于50%组”是指病变率超过50%的最低组;“病变率小于50%组”是指病变率小于50%的最高组。
协议书附图主要是对陕西省乡级行政区域界线与1∶50 000制图数据进行了整合,并对界线两侧核实修正后的重要地物、地貌及主要地名等信息进行修改,利用附图模板通过制图编辑而成。
2.1.3 药物抗病毒实验(CPE法) 待细胞长成单层后弃生长液,用维持液分别将样品CII-3以2倍稀释至 5个系列浓度(100 μg/mL、50 μg/mL、25 μg/mL、12.5 μg/mL 和 6.25 μg/mL),阳性对照药ACV稀释至5个系列浓度(2.5 μg/mL、1.25 μg/mL、0.625 μg/mL、0.3125 μg/mL和0.156 μg/mL)。分别将上述系列浓度药液各100 μL与病毒稀释液(100TCID50)等体积混合后直接加到板内,每个浓度设4个复孔,设病毒对照组、正常细胞对照组及阳性对照组。置于37℃、5%CO2培养箱内培养72~96 h,当病毒对照组的细胞病变达到“++++”,细胞对照组正常时,CPE观察系列浓度药液对HSV-2感染细胞的综合作用〔8-9〕。
CPE的记录方法为:无细胞病变为“-”;1%~25%细胞出现病变为“+”;26%~50%细胞病变为“++”;51%~75%细胞病变为“+++”;76%~100%的细胞病变为“++++”。判断结果,并计算药物的IC50(半数抑制浓度,50%Inhibitory concentration)和TI(治疗指数,Therapeatic index)。
2.2 美洲大蠊提取物CII-3对GH小鼠的治疗作用取体重为18~22 g健康昆明种雌性小鼠72只,随机分为6组,每组12只,分别为正常对照组,模型对照组,阳性药ACV对照组,CII-3高、中、低剂量组。用微量移液器吸取50 μL HSV-2病毒原液于小鼠阴道内,用3 mm×3 mm×3 mm大小的明胶海绵塞住小鼠阴道口,1次/d,连续7 d。肉眼可见红肿、疱疹、破损、糜烂及分泌物增多等症状时视为造模成功。造模成功后,开始分别灌胃给药治疗,1次/d,连续给药10 d。CII-3的低、中、高剂量分别为50 mg/kg、100 mg/kg、200 mg/kg。ACV为100 mg/kg,给药容量为0.02 L/kg·d,模型对照组和正常对照组给予0.5 mL等量的生理盐水。在给药治疗10 d后,各组小鼠眼球取血于塑料试管内,于冰浴中放置1~2 h后,以4℃、4000 r/min,离心10 min,取上清于Eppendorf离心管内,-20℃保存待检。分别用ELI⁃SA试剂盒检测小鼠血清中TNF-α、IFN-γ、IL-2的水平变化。各组小鼠眼球取血后,处死小鼠,取小鼠的胸腺和脾脏,用电子天平精密称其重量,并按如下公式计算脏器指数〔10-11〕。
脏器指数=相应脏器重量(mg)/小鼠体重(g)
3 实验结果
3.1 美洲大蠊提取物CII-3的细胞毒性测定 经MTT法所测得的系列浓度药液的细胞存活率(%)结果显示:随着药物浓度的增大,美洲大蠊提取物CII-3的细胞毒性增大。当浓度为250 μg/mL、500 μg/mL、1000 μg/mL时,可见明显的细胞毒性,表现为细胞变圆、缩小和溶解破碎的细胞形态学改变。CII-3的 TC50值为190.55 μg/mL,TC0为100 μg/mL;阳性对照药ACV对正常Vero细胞的细胞毒性很小,其 TC50和 TC0值均大于 100 μg/mL;溶剂对照组(0.5%DMSO)没有细胞毒性,Vero细胞形态与正常细胞对照组无明显差别。见表1。
表1 美洲大蠊提取物CⅡ-3对Vero细胞的细胞毒性(±s,n=3)

表1 美洲大蠊提取物CⅡ-3对Vero细胞的细胞毒性(±s,n=3)
注:①ACV的浓度为100 μg/mL;②与正常细胞对照组比较*P<0.05,▲P>0.05。
CII-3 ACV 0.5%DMSO细胞对照20.7±0.8*99.4±3.00▲100.8±2.05▲100.0±0.0017.9±1.51*26.2±2.09*94.2±9.42112.0±9.12*115.0±4.58*
3.2 病毒滴度测定 CPE观察结果所示,HSV-2的TCID50为 10-4.52,即接种滴度为 10-4.52的 HSV-2 病毒液每孔100 μL,可导致50%的培养细胞产生细胞病变,实验用的病毒滴度为100 TCID50。见表2。
3.3 美洲大蠊提取物CII-3对病毒所致CPE的作用 美洲大蠊提取物CII-3有抗HSV-2活性,从最低稀释浓度药液至最高稀释浓度药液,其细胞病变程度逐渐减轻。阳性对照药ACV表现出很好的抗HSV-2活性,当ACV在0.625 μg/mL时仍能较好的抑制病毒所致病变。见表3。

表2 HSV-2的病毒滴度测定
美洲大蠊提取物CII-3的IC50值为28.71 μg/mL;ACV能显著抑制HSV-2,其IC50值小于0.31 μg/mL。以TC50/IC50计算TI结果,美洲大蠊提取物CII-3和ACV对HSV-2的TI值分别为6.64 μg/mL和大于322.58 μg/mL。见表4。

表3 美洲大蠊提取物CII-3对HSV-2所致细胞病变的作用

表4 美洲大蠊提取物CII-3抗HSV-2活性结果
3.4 GH小鼠血清中TNF-α、IFN-γ、IL-2的水平变化
3.4.1 美洲大蠊提取物CII-3对TNF-α的影响给药组的TNF-α水平与正常组和模型组比较均有所升高;ACV组,CII-3高、中剂量组与正常组和模型组比较差异有统计学意义(P<0.05),说明CII-3能使小鼠血清中TNF-α的含量增加;CII-3高、中剂量组与ACV组比较差异没有统计学意义(P>0.05)。见表5。
表5 美洲大蠊提取物CII-3对TNF-α的影响(± s,n=12)

表5 美洲大蠊提取物CII-3对TNF-α的影响(± s,n=12)
注:与正常组比较*P<0.05,与模型组比较▲P<0.05,与ACV组比较★P<0.05。
89.09±22.71★86.63±10.90★138.73±28.06*▲125.84±21.48*▲133.59±21.57*▲108.73±25.23★正常组模型组ACV组CII-3(高)CII-3(中)CII-3(低)— —10020010050
3.4.2 美洲大蠊提取物CII-3对IFN-γ的影响 与正常组比较,感染病毒后模型组小鼠血清中IFN-γ的水平升高,差异有统计学意义(P<0.05);ACV组、CII-3组与正常组比较IFN-γ的水平亦显著升高,差异有统计学意义(P<0.05),说明CII-3能使小鼠血清中IFN-γ的含量增加;CII-3中剂量组与ACV组比较,差异没有统计学意义(P>0.05)。见表6。3.4.3 美洲大蠊提取物CII-3对IL-2的影响 与正常组比较,感染病毒后模型组小鼠血清中IL-2的水平降低,差异有统计学意义(P<0.05);CII-3中剂量组与正常组比较差异有统计学意义(P<0.05),说明CII-3中剂量组能够增加小鼠血清中IL-2的水平。模型组、CII-3低剂量组与ACV组比较,差异有统计学意义(P<0.05)。见表7。
表6 美洲大蠊提取物CII-3对IFN-γ的影响(± s,n=12)

表6 美洲大蠊提取物CII-3对IFN-γ的影响(± s,n=12)
注:与正常组比较*P<0.05,与模型组比较▲P<0.05,与ACV组比较★P<0.05。
44.31±11.07▲★99.91±19.62*★127.49±34.69*▲81.45±27.39*★109.16±37.17*81.40±21.90*★正常组模型组ACV组CII-3(高)CII-3(中)CII-3(低)— —10020010050
表7 美洲大蠊提取物CII-3对IL-2的影响(± s,n=12)

表7 美洲大蠊提取物CII-3对IL-2的影响(± s,n=12)
注:与正常组比*P<0.05,与模型组比较▲P<0.05,与ACV组比较★P<0.05。
33.37±4.82▲23.64±1.58*★36.82±2.39▲38.30±3.72▲41.6±8.59*▲27.87±1.42*★正常组模型组ACV组CII-3(高)CII-3(中)CII-3(低)— —10020010050
3.5 美洲大蠊提取物CII-3对GH小鼠免疫器官指数的影响 感染病毒后模型组小鼠的胸腺指数和脾脏指数与正常组和ACV组比较差异有统计学意义(P<0.05);CII-3高、中、低剂量组的胸腺指数与模型组比较差异有统计学意义(P<0.05);CII-3各剂量组的脾脏指数与模型组比较差异有统计学意义(P<0.05),CII-3高剂量组与正常组比较差异有统计学意义(P<0.05);说明CII-3能够增加小鼠的脏器指数。见表8。
表8 美洲大蠊提取物CII-3对小鼠胸脾指数的影响(±s,n=12)
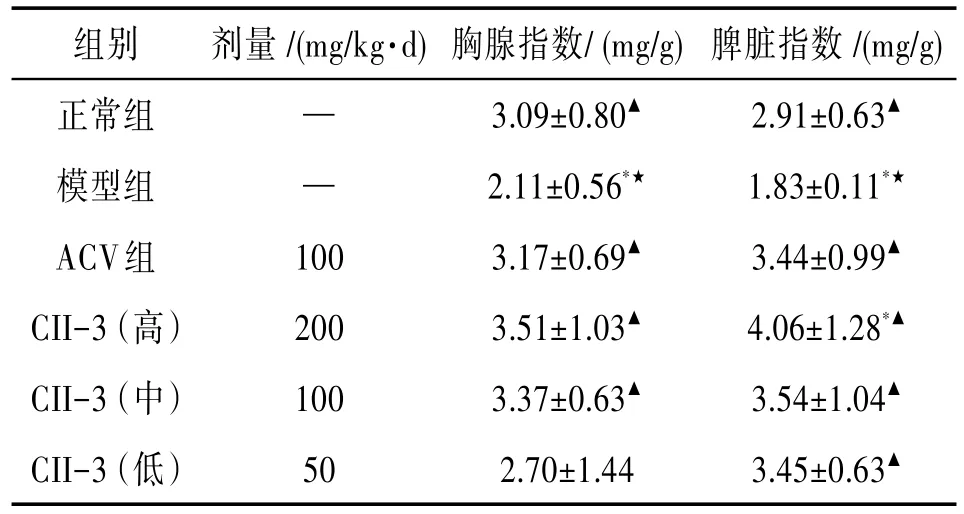
表8 美洲大蠊提取物CII-3对小鼠胸脾指数的影响(±s,n=12)
注:与正常组比较*P<0.05,与模型组比较▲P<0.05,与ACV组比较★P<0.05。
2.91±0.63▲1.83±0.11*★3.44±0.99▲4.06±1.28*▲3.54±1.04▲3.45±0.63▲正常组模型组ACV组CII-3(高)CII-3(中)CII-3(低)— —100200100503.09±0.80▲2.11±0.56*★3.17±0.69▲3.51±1.03▲3.37±0.63▲2.70±1.44
4 讨论
实验结果显示,美洲大蠊提取物CII-3随着给药浓度的增大,对正常Vero细胞的毒性逐渐增强,CII-3 的 TC50值 为 190.55 μg/mL。CII-3 有 抑 制HSV-2致细胞病变的作用,其IC50值为28.71 μg/mL,TI值为6.64 μg/mL。ACV对正常Vero细胞的细胞毒性很小,其TC50值>100 μg/mL。ACV具有很好的抗HSV-2活性,其IC50值< 0.31 μg/mL,TI值大于322.58 μg/mL。美洲大蠊提取物CII-3有一定的细胞毒性,与低毒的ACV比较,TI值相距甚远。有文献报道,在细胞培养中用浓度为0.5%的DMSO溶解药物〔12〕,对细胞生长没有显著影响,而本次实验也证明了这一点。病毒感染人体后,可引起免疫反应,机体在抗HSV-2感染中主要依赖于细胞免疫反应。Th1是CD4+T细胞中的一类亚群,主要分泌TNF-α、IFN-γ和IL-2等细胞因子,从而介导细胞免疫〔13〕。TNF-α在体内具有广泛的生物学活性,它是免疫应答中的一种中间介质,有着抗病毒作用。IFN-γ能激活T细胞、巨噬细胞、NK细胞活性及增加它们对病毒感染细胞的杀伤力。IL-2是一种比较重要的淋巴因子,其主要生物学活性是促进T淋巴细胞和NK细胞的增殖以及促进B细胞分化和增殖,并促进抗体的生成〔14-15〕。胸腺和脾脏是机体的免疫器官,其中胸腺是首要的中枢免疫器官,脾脏是最大的外周免疫器官,它们在免疫系统中均发挥着重要作用。实验结果显示,美洲大蠊提取物CII-3能够提高小鼠血清中TNF-α、IFN-γ、IL-2的水平,还能使小鼠的免疫器官重量增加。上述研究结果表明,美洲大蠊提取物CII-3有抗HSV-2作用,分析其可能是通过提高机体免疫功能而发挥抗病毒作用,具有良好的应用前景。
〔1〕袁静,钱芳.单纯疱疹病毒感染在妇产科疾病的研究现况〔J〕.疾病监测与控制杂志,2013,7(11):676-677.
〔2〕赵勤,冯宝平,胡锐,等.朱砂七抗Ⅱ型单纯疱疹病毒的体外研究〔J〕.中药药理与临床,2012,28(3):79-81.
〔3〕梁丽.康复新液治疗小儿疱疹性口腔炎的疗效分析〔J〕.实用医学杂志,2010,26(19):3618-3619.
〔4〕李武,段丽芳,何贵清,等.美洲大螊提取物对实验性肝纤维化的影响〔J〕.时珍国医国药,2010,21(5):1137-1138.
〔5〕黄锂新,吴星恒.心脉隆对窒息新生鼠心肌缺氧诱导因子-1α的影响〔J〕.中国当代儿科杂志,2009,11(8):683-686.
〔6〕左娅,朱慧娟,刘军.板蓝根多糖抗单纯疱疹病毒Ⅱ型的实验研究〔J〕.华西药学杂志,2013,28(3)∶267-269.
〔7〕王芳宇,张启锋,何丽芳,等.壳聚糖碘液体外抗人单纯疱疹病毒2型的作用〔J〕.中国皮肤性病学杂志,2011,25(2):101-103.
〔8〕瞿畅,赖志才,裴赢,等.余甘子提取物体外抗单纯疱疹病毒1型和2型的初步研究〔J〕.时珍国医国药,2010,21(4):784-786.
〔9〕张少华,孟红.翼果苔草提取物体外抗病毒的实验研究〔J〕.山东中医杂志,2010,29(4):262-263.
〔10〕周至品,梁华娟,万新祥,等.皱瘤海鞘体外抗单纯疱疹病毒2型感染及其作用机制〔J〕.中国医院药学杂志,2010,30(10):827-831.
〔11〕刘卉,程培华.生殖器疱疹的研究和治疗进展〔J〕.实用皮肤病学杂志,2010,3(1):21-27.
〔12〕张丽娟,王凤斌,梁静,等.二甲基亚砜对PC12细胞形态学影响〔J〕.潍坊医学院学报,2008,30(6):487-489.
〔13〕莫翔,韦又铭.复发性生殖器疱疹患者免疫细胞功能研究进展〔J〕.医学综述,2012,18(15):2385-2387.
〔14〕满洁,倪吉志,王雪宁,等.初发和复发生殖器疱疹患者NK、LAK细胞活性和T细胞亚群的比较〔J〕.中国实用医药,2010,5(16):128-129.
〔15〕赖迪辉,朱威,连石.单纯疱疹病毒实验室检测方法的研究进展〔J〕.中国计划生育学杂志,2010,6(177):380-381.
