松弛素对TGF-β诱导的内皮细胞间质化的抑制作用
2014-03-23陈潇周浩周希蔡洁洁陈灵芝郑高暑黄伟剑张怀勤
陈潇,周浩,周希,蔡洁洁,陈灵芝,郑高暑,黄伟剑,张怀勤
(1.温州医科大学附属第一医院 心内科,浙江 温州 325015;2.温州市中心医院 检验科,浙江温州 325000)
松弛素对TGF-β诱导的内皮细胞间质化的抑制作用
陈潇1,周浩1,周希1,蔡洁洁1,陈灵芝2,郑高暑1,黄伟剑1,张怀勤1
(1.温州医科大学附属第一医院 心内科,浙江 温州 325015;2.温州市中心医院 检验科,浙江温州 325000)
目的:探讨松弛素(RLX)对TGF-β诱导的内皮细胞间质化现象的影响。方法:采用体外分离的人脐静脉内皮细胞(HUVECs)作为体外细胞模型,通过TGF-β10 ng/mL诱导内皮细胞间质化,100 ng/mL和200 ng/mL RLX分别预处理,再与TGF-β联合培养48 h。光镜下观察细胞形态学改变,CCK-8实验和transwell实验检测细胞增殖和迁移能力,免疫荧光单双染技术观察vimentin和CD31的表达变化,蛋白免疫印迹技术观察各实验组vimentin、CD31、ve-cadherin和α-SMA的蛋白表达。结果:阴性对照组内皮细胞呈铺路石样生长,TGF-β诱导组细胞形态向梭形转化,呈扩散迁移趋势。与阴性对照组相比,TGF-β诱导组细胞增殖、迁移能力明显增强;而RLX可抑制TGF-β诱导的增殖和迁移。免疫荧光单染结果显示,与阴性对照组相比,TGF-β诱导组内皮细胞特异性蛋白CD31表达下调而间质细胞标志性蛋白vimentin明显上升;与TGF-β组相比,RLX联合TGF-β处理组CD31表达上调而vimentin表达下调。免疫荧光双染结果显示,阴性对照组以内皮性质的细胞为主,仅存在少量的CD31和vimentin双阳性细胞;TGF-β诱导组双阳性细胞明显增多;与TGF-β组相比,RLX联合TGF-β处理组间质效应的双阳性细胞下调,而内皮效应的双阳性细胞增多。蛋白免疫印迹结果显示,与阴性对照组相比,TGF-β诱导组内皮细胞特异性蛋白CD31(0.36± 0.076 vs 0.88±0.086)和ve-cadherin(0.54±0.046 vs 1.09±0.13)表达下调而间质细胞标志性蛋白vimentin(0.72±0.102 vs 0.21±0.081)和α-SMA(0.88±0.084 vs 0.24±0.046)明显上升(P<0.05);与TGF-β组相比,RLX联合TGF-β处理组CD31(0.67±0.09、0.59±0.12 vs 0.36±0.076)和ve-cadherin(0.85±0.09、0.72±0.064 vs 0.54±0.046)表达上调,而vimentin(0.56±0.011、0.48±0.06 vs 0.72±0.102)和α-SMA(0.65±0.081、0.54±0.032 vs 0.88±0.084)表达下降(P<0.05),且呈剂量依赖性。结论:RLX可抑制TGF-β诱导的内皮细胞向间质化细胞转化。
松弛素;内皮细胞间质化;TGF-β;心肌纤维化
心肌和大动脉壁纤维化是许多心脏疾病的基本表现,与疾病的发生发展及预后密切相关。抗纤维化已成为治疗心脑血管疾病的重要靶点,而内皮细胞间质化是组织器官纤维化中成纤维细胞的重要来源,阐明并阻断这一过程对防治纤维化有重要的临床意义[1]。松弛素(RLX)属胰岛素类肽类激素,在研究妊娠期骨盆变化时被首次发现[2],其可通过下调胶原生成和增加胶原降解发挥抗纤维化的作用。RLX可由心脏本身产生,主要通过与细胞表面的特异性受体LGR7或LGR8结合,介导Smad细胞间信号,激活特殊的基因,有心脏保护和细胞外基质调节作用[3]。本研究通过构建由TGF-β诱导的内皮细胞向间质化转化的模型,由不同剂量的RLX进行预处理,探讨RLX对TGF-β诱导的内皮细胞间质化现象的影响,以及对抗纤维化治疗的展望。
1 材料和方法
1.1 实验对象选用人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)。
1.2 实验试剂和药物Recombinant Human Relaxin-2(130-10)和TGF-β(100-21)购自peprotech公司;兔抗人ve-cadherin(D87F2)、兔抗人vimentin(D21H3)、鼠抗人CD31(89C2)购自Cell Signaling Technology公司;兔抗人Anti-Von Willebrand Factor antibody购自abcam公司;鼠抗人α-SMA购自武汉博士德生物工程有限公司;Alexa Fluor荧光二抗购自earthox公司;Hoechst 33342购自Sigma-Aldrich公司。
1.3 实验分组实验共分五组:①阴性对照组;②RLX对照组:RLX 100 ng/mL;③TGF-β诱导组:TGF-β10 ng/mL;④TGF-β+RLX 100 ng/mL处理组:先加入RLX 100 ng/mL培养24 h后加入TGF-β10 ng/ mL;⑤TGF-β+RLX 200 ng/mL处理组:先加入RLX 200 ng/mL 培养24 h后加入TGF-β10 ng/mL。以上每组均在37 ℃,5% CO2恒温无菌的细胞培养箱中培养48 h。
1.4 HUVECs原代培养与签定
1.4.1 HUVECs原代培养和分离:取新生儿脐带,无夹痕扭曲部分,夹闭两端后注入胰酶并置于37 ℃水浴箱中7~10 min。取脐带内消化液离心后,取沉淀重悬,移至细胞培养瓶内。3~4 d长至70%~80%汇合后传代,取4~6代细胞实验。所用标本经医院伦理委员会批准同意。
1.4.2 HUVECs细胞鉴定:制细胞爬片于24孔板上,固定封闭后加入兔抗人VWF相关抗原(1:160),4 ℃过夜后Hochest33342(1μ g/mL)染核20 min,荧光二抗(DyLight 488)孵育1 h。滴加抗荧光猝灭剂后在荧光显微镜下观察。
1.5 增殖与迁移实验
1.5.1 细胞增殖实验:细胞按1×104/m2孔接种到96孔板,培养12 h后饥饿24 h。随机分组,设4个复孔,按实验分组继续培养48 h后,每孔加入10μ L CCK-8试剂,37 ℃放置2.5 h。在酶标仪450 nm下读取吸光度OD值。
1.5.2 细胞迁移实验:细胞按5×104个/孔接种到24孔板,培养12 h后饥饿24 h。随机分组,设3个复孔,按上述实验分组继续培养48 h后胰酶消化成5×104/mL单细胞悬液。在transwell小室的下室加入600μL含10% FBS的培养基,上室加入单细胞悬液100 μL。37 ℃培育24 h后多聚甲醛固定,结晶紫染色,计数。
1.6 免疫荧光技术
1.6.1 免疫荧光单染技术:制细胞爬片到24孔板上,随机分组,设3个复孔,按上述实验分组继续培养48 h。固定封闭后加入各浓度一抗4 ℃过夜,VWF(1:150),vimentin(1:100),ve-cadherin(1: 100),CD31(1:1600),α-SMA(1:120)。次日Hochest33342(1μg/mL)染核20 min后加相应荧光二抗(DyLight 488/DyLight 594,1:300)室温孵育1 h。滴加抗荧光淬灭剂后在荧光显微镜下观察。
1.6.2 免疫荧光双染技术:步骤同单染。CD31和vimentin混合一抗,200μ L/孔,各一抗浓度不变。
1.7 蛋白免疫印迹技术检测蛋白含量提取细胞蛋白,测定蛋白浓度,恒质量上样蛋白400μ g,配制10%的分离胶和3%的浓缩胶(SDS-PAGE),电泳,转膜,封闭,加入一抗(1:1 000),4 ℃过夜(15 h),洗膜,加入辣根过氧化物酶标记二抗(1:5 000),室温下孵育1 h,洗膜,曝光。Gelpro32分析软件进行灰度值分析,以目的蛋白/内参蛋白表达的相对值进行统计学比较。
1.8 统计学处理方法采用SPSS19.0统计软件。数据以±s表示,对各组数据先进行正态检验和方差齐性检验,若符合正态分布、方差齐,则进行单因素方差分析(One-way ANOVA),组间比较采用LSD检验;若不符合方差齐性的要求,则进行秩和检验,组间比较采用Mann-Whiteney法。P<0.05为差异有统计学意义。
2 结果
2.1 光镜下HUVECs的形态学变化光镜下HUVECs呈多边形,边界清楚,呈现集落式生长,TGF-β诱导48 h后,部分细胞形态转变成梭形,细胞间隙增大,细胞向边界扩散迁移,RLX联合TGF-β则介于以上两种形态之间,RLX可抑制内皮细胞向间质细胞的表型转化,如图1。

图1 光镜下细胞形态变化(×200 )
2.2 原代HUVECs细胞鉴定第4代HUVECs细胞VWF相关抗原阳性率为(0.0957±0.03)%,见图2。

图2 第4代HUVECs细胞VWF相关抗原免疫荧光染色(×400)
2.3 增殖与迁移实验结果
2.3.1 细胞增殖实验:TGF-β诱导组较阴性对照组吸光度A值明显降低(P<0.05),表明TGF-β可促进HUVECs增殖;RLX联合TGF-β处理组与TGF-β诱导组相比,吸光度值明显升高(P<0.05),表明RLX可抑制TGF-β诱导的增殖效应,见表1。
2.3.2 细胞迁移实验:通过transwell法检测,与阴性对照组相比,TGF-β诱导组穿膜细胞数明显增多(P<0.05);与TGF-β诱导组相比,RLX联合TGF-β处理组穿膜细胞数减少(P<0.05),见表1。
表1 各组CCK-8实验吸光度A值和穿膜细胞数(±s)
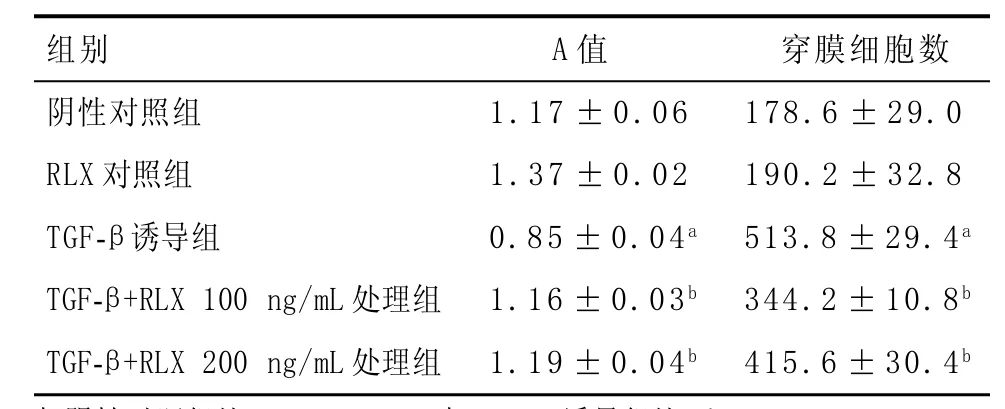
表1 各组CCK-8实验吸光度A值和穿膜细胞数(±s)
与阴性对照组比:aP<0.05;与TGF-β诱导组比:bP<0.05
穿膜细胞数178.6±29.0 190.2±32.8 513.8±29.4a344.2±10.8b415.6±30.4b组别阴性对照组RLX对照组TGF-β诱导组TGF-β+RLX 100 ng/mL处理组TGF-β+RLX 200 ng/mL处理组A值1.17±0.06 1.37±0.02 0.85±0.04a1.16±0.03b1.19±0.04b
2.4 免疫荧光实验结果
2.4.1 免疫荧光技术检测vimentin和CD31单染:按实验分组培养48 h后,与阴性对照组相比,TGF-β诱导组内皮细胞特异性蛋白CD31表达下降,而间质细胞特异性蛋白vimentin表达升高;与TGF-β诱导组相比,RLX联合TGF-β处理组CD31升高而vimentin下降,见图3-4。
2.4.2 免疫荧光双染技术:对照组含极少的内皮、间质标志物双阳性细胞,而TGF-β诱导组明显增多;与TGF-β诱导组相比,RLX联合TGF-β处理组间质效应的双阳性细胞下降,而内皮效应的双阳性细胞增多。见图5。
2.5 蛋白免疫印迹技术检测CD31、ve-cadherin、vimantin和α-SMA蛋白表达与阴性对照组相比,TGF-β诱导组内皮细胞特异性标志蛋白CD31(0.36 ±0.076 vs 0.88±0.086)和ve-cadherin(0.54 ±0.046 vs 1.09±0.13)表达下调而间质细胞标志性蛋白vimentin(0.72±0.102 vs 0.21±0.081)和α-SMA(0.88±0.084 vs 0.24±0.046)明显上升(P<0.05);与TGF-β诱导组相比,RLX联合TGF-β处理组CD31(0.67±0.09、0.59±0.12 vs 0.36±0.076)和ve-cadherin(0.85±0.09、0.72 ±0.064 vs 0.54±0.046)表达上调,而vimentin(0.56±0.011、0.48±0.06 vs 0.72±0.102)和α-SMA(0.65±0.081、0.54±0.032 vs 0.88 ±0.084)表达明显下降(P<0.05),且呈剂量依赖性。见图6。

图3 各组细胞免疫荧光显微镜下CD31表达(绿色荧光)(×400)

图4 各组细胞免疫荧光显微镜下vimentin(绿色荧光)表达(×200)

图5 各组细胞免疫荧光显微镜下vimentin(绿色荧光)和CD31(红色荧光)表达(×400)

图6 各实验组CD31、ve-cadherin、vimantin和α-SMA蛋白表达变化
3 讨论
成纤维细胞是心肌纤维化的主要效应细胞,其来源主要有损伤的组织内固有的成纤维细胞活化和血液中的骨髓间充质细胞[4]。但是,近年的研究发现,内皮细胞间质化是成纤维细胞的重要来源,是组织器官发生纤维化的重要机制,成人心血管系统在应激、创伤、炎症等情况下也存在血管内皮细胞间质化现象,与心肌纤维化密切相关[5]。TGF-β是目前认为与心肌纤维化关系最密切的细胞因子,体内外实验均报道TGF-β信号通路在内皮细胞间质化过程中起着重要作用[6]。本实验采用体外分离的HUVECs作为血管内皮细胞的体外细胞模型,通过TGF-β诱导后,细胞由铺路石样形态向梭形形态转化,细胞之间的连接减少,细胞间隙变大,细胞增殖和迁移能力明显增加,同时,间质细胞特异性蛋白表达明显增加,内皮细胞特异性蛋白和间质细胞特异性蛋白双阳性细胞较对照组明显增加。这些结果提示内皮细胞可向成纤维细胞转化,内皮细胞是成纤维细胞的来源之一,而TGF-β可诱导内皮向间质化转化的过程,因此通过阻断这一过程将可能延缓和抑制纤维化的发生。
RLX最初被认为是一种与妊娠相关的激素,妊娠期间引起子宫和产道松弛舒张,其机制与降解细胞间质的胶原纤维含量相关[7]。近来的研究发现,RLX在心血管组织,如心肌细胞、血管平滑肌细胞和血管内皮功能上均有表达,心血管系统亦是RLX作用靶器官之一[3],并且已证实其可阻断心肌纤维化过程。动物实验表明,RLX基因敲除小鼠心肌发生明显的纤维化[8],相反,外源性给予RLX干预可明显抑制心肌纤维化模型小鼠心脏纤维含量的升高[9]。新近的临床试验表明RLX治疗可以降低急性心力衰竭患者血压,减轻呼吸困难症状,并有降低心血管和肾脏不良事件的趋势[10]。综上研究,RLX有望被用于人类心脏纤维化性疾病的治疗。然而,目前RLX抗心脏纤维化作用的具体机制和信号通路尚不完全明确。本研究通过构建TGF-β诱导的内皮细胞间质化现象,应用RLX进行预处理,观察RLX对内皮细胞间质化的抑制作用。结果显示,RLX干预后,细胞由铺路石样形态向梭形形态转化明显减少,细胞间隙、细胞增殖和迁移较TGF-β诱导组明显减少,同时间质细胞特异性表达蛋白减少,内皮细胞特异性蛋白和间质细胞特异性蛋白双阳性细胞亦明显减少,表明RLX可阻断内皮细胞向间质细胞表型转化,有效地抑制内皮细胞间质化。2007年Zeisberg等[1]动物实验首次证明心肌纤维化与内皮细胞间质化现象的关系,冠状动脉血管内皮细胞是成纤维细胞的来源之一,因此,我们认为RLX有望通过抑制内皮细胞间质化现象从而减轻心肌纤维化。
总之,RLX对心肌纤维化的治疗前景已得到基础研究和临床试验的肯定,但其机制尚未完全阐明。近年来的研究证实内皮细胞间质化是纤维化疾病的重要机制[11],是成纤维细胞的重要来源。本实验通过构建TGF-β诱导的内皮细胞间质化模型,阐明RLX对内皮细胞间质化的影响,旨在为心肌纤维化机制研究和RLX的临床应用提供进一步的依据,但其具体的作用机制有待进一步探讨。
[1]Zeisberg EM, Tarnavski O, Zeisberg M, et al. Endothelial to mesenchymal transition contributes to cardiac fibrosis[J]. Nat Med, 2007, 13(8): 952-961.
[2]Sherwood OD. Relaxin’s physiological roles and other diverse actions[J]. Endocr Rev, 2004, 25(2): 205-234.
[3]Du XJ, Bathgate RA, Samuel CS, et al. Cardiovascular effects of relaxin: from basic science to clinical therapy[J]. Nat Rev Cardiol, 2010, 7(1): 48-58.
[4]Roxburgh SA, Murphy M, Pollock CA, et al. Recapitulation of embryological programmes in renal fibrosis-the importance of epithelial cell plasticity and developmental genes [J]. Nephron Physiol, 2006, 103(3): 139-148.
[5]Kovacic JC, Mercader N, Torres M, et al. Epithelial to mesenchymal and endothelial to mesenchymal transition: from cardiovascular development to disease[J]. Circulation, 2012, 125(14): 1795-1808.
[6]Xu J, Lamouille S, Derynck R. TGF-β induced epithelial to mesenchymal transition[J]. Cell Res, 2009, 19(5): 156-172.
[7]Zhao L, Samuel CS, Tregear GW. Collagen studies in late pregnant relaxin null mice[J]. Biol Reprod, 2000, 63(3): 697-703.
[8]Du XJ, Samuel CS, Gao XM, et al. Increased myocardial collagen and ventricular diastolic dysfunction in relaxin deficient mice: a gender-specific phenotype[J]. Cardiovasc Res, 2003, 57(2): 395-404.
[9]Bathgate RA, Lekgabe ED, McGuane JT, et al. Adenovirusmediated delivery of relaxin reverses cardiac fibrosis[J]. Mol Cell Endocrinol, 2008, 280(2): 30-38.
[10]Teerlink JR, Metra M, Felker GM, et al. Relaxin for the treatment of patients with acute heart failure (Pre-RELAXAHF): a multicentre, randomised, placebo controlled, parallel group, dose-finding phase IIb study[J]. Lancet, 2009, 373(9673): 1429-1439.
[11]简宇, 黄宏, 简华刚. 内皮细胞-间质细胞转化在纤维化疾病中作用的研究进展[J]. 感染、炎症、修复, 2010, 11(3): 179-181.
(本文编辑:吴健敏)
The inhibition effect of relaxin for TGF-β induced endothelial to mesenchymal transition in vitro
CHEN Xiao1, ZHOU Hao1, ZHOU Xi1, CAI Jiejie1, CHEN Lingzhi2, ZHENG Gaoshu1, HUANG Weijian1, ZHANG huaiqin1.1.Department of Cardiovascular, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Clinical laboratory, Wenzhou City Center Hospital, Wenzhou, 325000
Objective:To investgate the effect of relaxin which inducing endothelial to mesenchymal transition in vitro.Methods:Endothelial cells were isolated from human umbilical vein endothelial cells (HUVECs). TGF-β10 ng/mL was added to medium for inducing endothelial to mesenchymal transition. Pretreatment relaxin 100 ng/mL and 200 ng/mL was added to medium, then co-cultured with TGF-β10 ng/mL for 48 h. The changes of morphology were observed under an inverted phase contrast microscope. CCK-8 assay was used to evaluate the cell proliferation as well as Transwell tested cell migration. The expression of CD31, vimentin, ve-cadherin and α-SMA were determined by immunofluoresence staining and western blot analysis. The co-expression of CD31 with vimentin and VWF withα-SMA were also determined by immunofluoresence.Results:A paving stone-like growth was observed in control group while TGF-β induced more spreading and migrating cells which was called EMT. However, this transition could be prevented by relaxin. Compared with the control group, the proliferation and the mobility were increased by TGF-β(P<0.05), but declined when combining with relaxin compared toadding TGF-β only (P<0.05). Compared with the control group, the specific protein of endothelial CD31 (0.36 ±0.076 VS 0.88±0.086) and ve-cadherin (0.54±0.046 VS 1.09±0.13) were significantly decreased when adding TGF-β, but the specific protein of mesenchymal vimentin (0.72±0.102 VS 0.21±0.081) and α-SMA (0.88±0.084 VS 0.24±0.046) were significantly increased. However, relaxin could inhibit the phenotype switch. Compared with the TGF-β inducing group, CD31 (0.67±0.09, 0.59±0.12 VS 0.36±0.076) and ve-cadherin(0.85±0.09, 0.72±0.064 VS 0.54±0.046) were significantly increased, but vimentin (0.56±0.011, 0.48±0.06 VS 0.72±0.102) and α-SMA (0.65±0.081, 0.54±0.032 VS 0.88±0.084) were significantly decreased when combining with relaxin. Besides, it exhibited dose-dependent. Last but not least, the number of double positive cells was largely increased in TGF-β inducing group compared to the control group. And compared with the TGF-β group, double positive cells performing mesenchymal are declined while performing endothelial ones are increased in the combined group.Conclusion:Relaxin exhibits the inhibition effect for TGF-β induced endothelial to mesenchymal transition in vitro.
relaxin; endothelial to mesenchymal transition; TGF-β; myocardial fibrosis
R329.2;R541
A
1000-2138(2014)03-0161-05
2013-11-28
浙江省自然科学基金资助项目(LY12H02004)。
陈潇(1987-),女,浙江宁波人,硕士生。
张怀勤,主任医师,硕士生导师,Email:zhanghuaiqin@126.com。
