胃癌组织中CD44V6、p-Src、Ki67表达及其相关性
2014-03-23王永辉毛卫波楼建周月芬
王永辉,毛卫波,楼建,周月芬
(丽水市中心医院,浙江 丽水 323000,1.肿瘤科;2.病理科)
胃癌组织中CD44V6、p-Src、Ki67表达及其相关性
王永辉1,毛卫波2,楼建1,周月芬1
(丽水市中心医院,浙江 丽水 323000,1.肿瘤科;2.病理科)
目的:研究肿瘤干细胞标记物CD44V6、非受体酪氨酸激酶c-Src的激活形式p-Src及增殖指数Ki67在胃癌及癌旁组织中的表达及其与胃癌临床病理参数及预后的关系,并进一步探讨三者之间可能存在的联系。方法:应用免疫组织化学法分别检测CD44V6、c-Src的激活形式p-Src(Y419)癌基因蛋白及Ki67在85例胃癌组织及41例相应的癌旁组织中的表达差异,分析三者表达与胃癌患者临床病理学参数及预后之间关系,并进一步探讨三者之间存在的联系。结果:CD44V6、p-Src(Y419)、Ki67在胃癌中的表达显著高于癌旁组织(P<0.05)。CD44V6的表达和肿瘤直径的大小、浸润深度、肿瘤分期相关;Src在胃癌中的激活程度和肿瘤直径的大小、分化程度、浸润深度有关;Ki67高表达和肿瘤直径大小、Lauren分型有关。单因素分析提示CD44V6表达、p-Src和Ki67的高表达均是胃癌2年生存期的影响因素,多因素分析提示CD44V6表达及p-Src、Ki67高表达不是胃癌2年生存期的独立预后因素。CD44V6阳性病例p-Src及Ki67表达显著高于CD44V6阴性病例,CD44V6和p-Src(Y419)、Ki67互为正相关。结论:CD44V6、p-Src、Ki67表达是胃癌的不良预后因素。
胃肿瘤;CD44V6;Src;Ki67;预后
胃癌是世界范围内常见的恶性肿瘤,在发展中国家,男女发病率分别为各种恶性肿瘤的第2位和第4位,病死率分别占第3位和第4位,严重威胁着人们的生命健康[1]。ToGA试验证实化疗联合分子靶向药物赫赛汀治疗较单用化疗可延长进展期胃癌生存期,但中位生存期也仅有13.5个月[2]。胃癌干细胞可以促进细胞生长和自我更新,对放化疗高度抗拒[3],可能是胃癌治疗失败的主要原因之一。CD44是胃癌干细胞的分子标记物[3],同时作为透明质酸的主要的受体,传递肿瘤增殖及转移信号[4],CD44V6是CD44的亚型之一,是多种恶性肿瘤的预后因子。Src蛋白是细胞浆内非受体酪氨酸激酶,和多种信号分子相互作用[5]。Ki67作为增殖指数,可反映细胞的增殖状态[6]。已有研究表明在乳腺癌细胞中CD44促进Src激酶活化,进而促进了肿瘤细胞的增殖、转移[7]。目前尚少见CD44V6和Src在胃癌中相关性的临床报道。本研究探讨CD44V6、Src及Ki67表达与胃癌临床病理参数及其预后之间的关系,并进一步探讨三者之间存在的联系。
1 材料和方法
1.1 一般资料收集浙江省丽水市中心医院2009年1月-2011年12月行胃癌根治性切除的组织标本85例及其相应的癌旁组织标本41例。全部病例均经手术和病理证实,术前未行化疗或放疗,具有完整的病理资料。组织标本保存于病理科。所有标本均经4%甲醛固定,常规石蜡包埋,4 μm厚度连续切片。85例病例中男64例,女21例;年龄36~81岁,中位年龄60岁;肿瘤最大直径1~12 cm,中位直径4 cm;贲门癌22例,非贲门癌63例;分化良好病例包括中高分化腺癌36例,分化不良病例包括低分化腺癌、未分化癌及黏液腺癌、印戒细胞癌及混有黏液腺癌或印戒细胞癌成分者共49例;Lauren分型包括肠型33例,弥漫型31例,混合型21例;胃癌pTNM分期依据2010年出版的《AJCC癌症分期手册》,其中T113例,T216例,T321例,T435例;N035例,N112例,N224例,N314例;I期23例,I I期20例,I I I期42例,VI期0例。脉管癌栓为HE组织切片检查于血管或淋巴管内见癌细胞,有脉管癌栓16例。
1.2 试剂兔抗人p-Src(Y419)多克隆IgG抗体(产品编号AF2685)购自美国R&D公司。即用型免疫组织化学Envision染色试剂盒,即用型鼠抗人Ki67单克隆抗体(克隆号K-2),即用型鼠抗人CD44V6单克隆抗体(克隆号CB11)及一抗稀释液小牛血清(批号WP131521-1)均购自北京中杉金桥生物技术有限公司。
1.3 实验方法采用免疫组织化学Envision二步法,石蜡切片经脱蜡,梯度乙醇脱水后,抗原热修复,用3%双氧水室温孵育20 min,消除内源性过氧化物酶的活性,pH 7.2磷酸盐缓冲液冲洗,加入一抗[p-Src(Y419)1:20;CD44V6 1:100;Ki67 1: 75],37 ℃恒温水箱孵育1 h,PBS冲洗,滴加试剂EnvisionTM通用型二抗50μL,置于37 ℃恒温水箱孵育25~30 min。DAB显色,苏木素复染,封片,镜检。所有抗体阴性对照以PBS代替第一抗体。Ki67和CD44V6阳性对照选择已知阳性标本为对照。
1.4 结果判定CD44V6阳性定位于细胞膜,部分位于细胞浆,呈棕黄色细颗粒状,胞核不染色。每张切片随机取3个高倍镜视野,以阳性细胞比例的平均值定义为该肿瘤的阳性细胞百分比。细胞不着色为“-”;阳性细胞数<25%为“+”;阳性细胞数25%~75%为“++”;阳性细胞数>75%为“+++”。p-Src(Y419)阳性判断标准及阳性对照参照文献[6]报道的恶性间皮瘤:以细胞浆或细胞膜出现棕黄色或棕褐色颗粒为阳性,染色的强弱以0~3表示,染色范围以0~100表示,通过染色强度和染色范围相乘得到染色积分(0~300),以染色积分大于中位数为高表达。Ki67阳性以细胞核呈棕黄色为阳性,每张切片选取3个高倍视野,显微镜下每个视野计数1 000个细胞中的阳性细胞,其百分率的平均值为标记指数,用百分比表示,以大于中位数为高表达。免疫组织化学结果由两位病理医师采用双盲法读片评定。
1.5 随访全组随访至2013年1月31日,随访时间1~48个月,中位随访时间26个月,其中失访5例,随访80例,2年内死亡17例,死亡原因均为肿瘤复发转移。
1.6 统计学处理方法采用SPSS16.0统计软件。无序分类资料用x2检验,单向有序分类资料采用趋势x2检验,偏态资料采用秩检验,三者之间的关系采用Spearman等级相关。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织及癌旁组织中CD44V6、p-Src(Y419)、Ki67的表达CD44V6阳性细胞呈棕色或棕黄色,主要定位于细胞膜,其表达强度+、++、+++分别为21.2%,12.9%,9.4%,而癌旁组织仅表达+,阳性率为17.1%,差异有统计学意义(P<0.05);p-Src(Y419)癌基因蛋白在胃癌细胞中呈棕黄色颗粒,主要定位于细胞浆,并见部分肿瘤细胞膜染色,染色积分中值为80,癌旁组织染色积分中值为30,差异有统计学意义(P<0.05);Ki67蛋白表达呈棕黄色颗粒定位于细胞核,在胃癌组织中表达中值为70%,癌旁组织为4%,差异有统计学意义(P<0.05)。见表1、图1-6。

表1 CD44V6、p-Src(Y419)、Ki67在胃癌及癌旁组织中的表达

图1 CD44V6在胃癌组织中呈高表达(Envision法,×200)

图2 CD44V6在癌旁组织呈低表达(Envision法,×200)
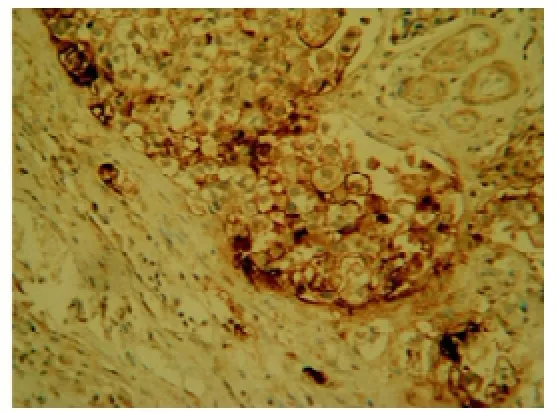
图3 p-Src(Y419)在胃癌组织中呈高表达(Envision法,×100)
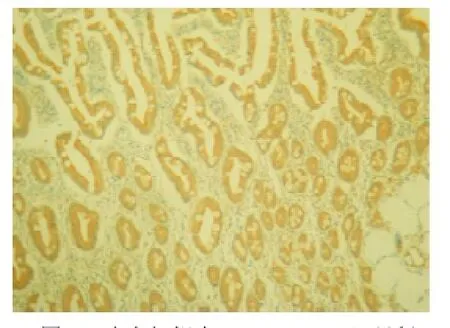
图4 癌旁组织中p-Src(Y419)呈低表达(Envision法,×100)

图5 胃癌组织中K i 6 7呈高表达(Envision法,×100)

图6 癌旁组织中Ki6 7表达呈阴性(Envision法,×100)
2.2 胃癌组织中CD44V6、p-Src(Y419)、Ki67表达和临床病理参数的关系胃癌组织中CD44V6表达和肿瘤直径的大小、浸润深度、pTNM分期相关;p-Src(Y419)蛋白表达和肿瘤直径大小、分化程度、浸润深度相关,和pTNM分期无关(P=0.081)。Ki67高表达和肿瘤大小、Lauren分型相关(见表2)。
2.3 CD44V6和p-Src(Y419)、Ki67的关系CD44V6阳性病例中p-Src及Ki67表达显著高于CD44V6阴性病例(P<0.05)(见表3)。CD44V6和p-Src(Y419)呈正相关,Spearman相关系数为0.349(P=0.001);CD44V6和Ki67呈正相关,Spearman相关系数为0.468(P<0.001)。p-Src(Y419)和Ki67呈正相关,Spearman相关系数为0.431(P<0.001)。见图7-9。
2.4 胃癌组织中CD44V6、p-Src(Y419)和Ki67表达和预后的关系胃癌单因素分析提示胃癌2年生存期和肿瘤大小、淋巴结转移、pTNM分期、脉管癌栓、p-Src(Y419)高表达、CD44V6阳性表达相关,和Ki67高表达无关(P=0.085)。双变量logistic分析,未得出p-Src(Y419)、CD44V6及Ki67是胃癌2年生存期的独立预后因素(见表4)。
3 讨论
我国是世界范围内胃癌发生率最高的国家之一[8],胃癌的治疗已经从单纯化疗进入到了分子靶向治疗时代[9]。因此,寻找胃癌新的靶点是胃癌治疗的研究方向之一。肿瘤干细胞具有自我更新能力并产生异质细胞,对放化疗抗拒,是胃癌治疗失败的原因之一。有研究[10]表明,CD44是胃癌的干细胞标记,因此,以CD44为靶点,可能是胃癌靶向治疗的研究方向。
CD44是1型跨膜糖蛋白,是透明质酸的主要受体。人类编码CD44的基因位于11号染色体短臂上,根据外显子的不同,分为标准型(CD44s)和变异型(CD44V),CD44V6是CD44V的主要亚型之一,在宫颈癌[11]、胃癌等多种肿瘤中表达均提示肿瘤侵袭。有研究[12-13]表明,CD44V6表达是胃正常黏膜向胃癌转化的标记,且和胃癌的预后有关。本研究表明,CD44V6在胃癌中的表达显著高于癌旁组织,同Gulmann等[12]得出的结论一致。本研究发现,CD44V6的表达和肿瘤直径的大小、浸润深度、肿瘤分期相关,且是2年生存期的不良预后因子,但不是独立的预后因素。Okayama等[14]研究135例胃癌,发现CD44V6和淋巴结转移状态相关。Chen等[15]研究62例胃癌,发现CD44V6表达和浸润深度、淋巴结转移、pTNM分期有关。Xin等[16]研究55例胃癌,发现CD44V6表达和肿瘤分期相关,且3年和5年预后差。本研究结论和既往研究部分一致,其差异可能和中国人群或选择病例数不同有关。

表2 胃癌组织中CD44V6、p-Src(Y419)、Ki67表达和临床病理参数的关系 n(%)

表3 CD44V6表达和p-Src(Y419)、Ki67表达的关系
Src蛋白是细胞浆内非受体酪氨酸激酶,其和多种信号分子共同传递细胞增殖、转移信号[5],其表达是包括胃癌在内的多种恶性肿瘤的不良预后因素[17-18]。本研究发现,胃癌组织中Src激活程度较癌旁组织明显增高,且肿瘤直径越大,分化程度越好,浸润深度越深,肿瘤分期越晚,Src的表达越强,且是胃癌2年生存期的影响因素,和既往研究[18]基本一致。

图7 胃癌组织中CD44V6和p-Src(Y419)表达的关系
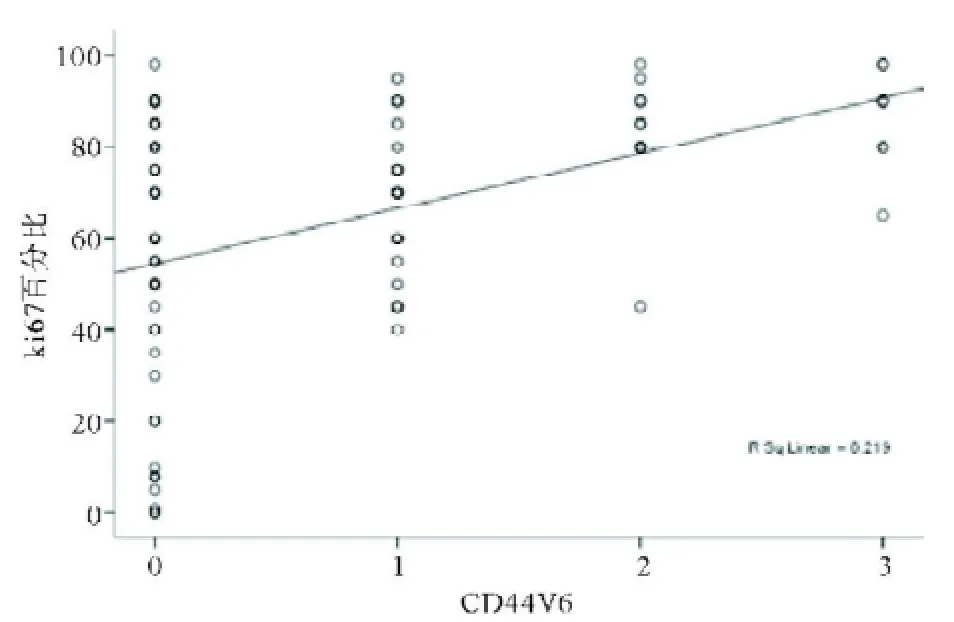
图8 胃癌组织中CD44V6和Ki67表达的关系
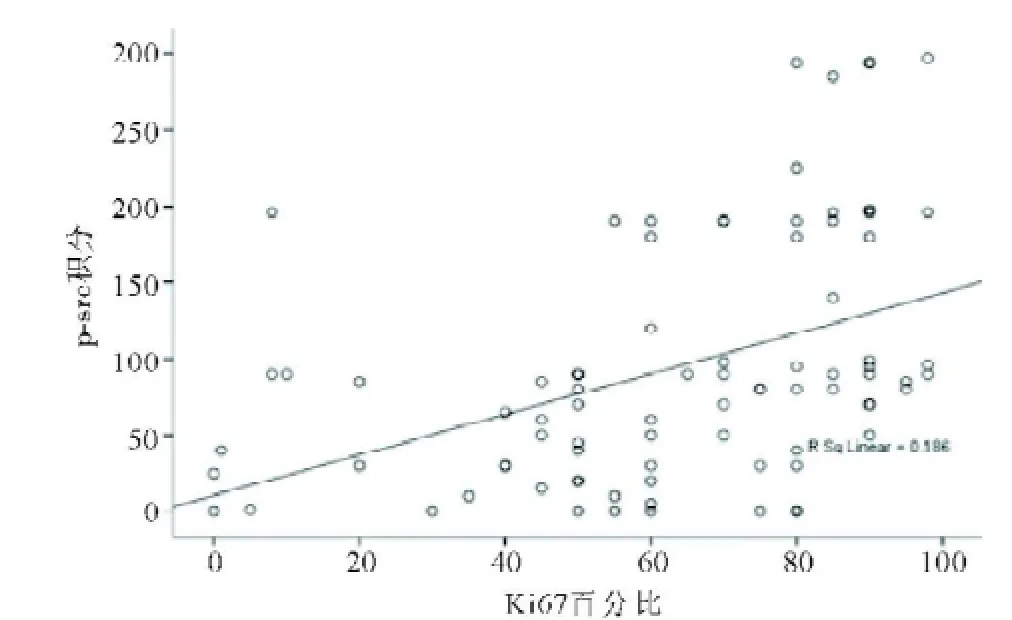
图9 胃癌组织中p-Src(Y419)表达和Ki67表达的关系
Ki67仅表达于分裂细胞,因此被视为细胞增殖指数[6]。既往研究中对Ki67表达阳性无明确定义。夏加增等[19]把Ki67表达10%定位为阳性,而不考虑染色强度,发现Ki67在胃癌中的表达和Lauren分型、淋巴结转移及pTNM分期相关,而Lazar等[20]以Ki67表达指数45%为界分为两组,发现Ki67表达和肿瘤分化程度相关。本研究中以ki67表达中位数70%分为两组,发现Ki67高表达和肿瘤直径大小、Lauren分型有关,和既往研究部分一致。其研究结论不同,可能主要和Ki67表达阳性定义及病例选择不同有关。

表4 胃癌2年生存期单因素分析
Bourguignon等[7]研究乳腺癌细胞发现,透明质酸和CD44结合,促进了Src的激活,进而导致转录因子Twist磷酸化并核转位而激活转录。Lee等[21]研究发现,CD44通过和Src、整联蛋白相互作用,促进了细胞的生存。本研究发现,CD44V6和Src、Ki67呈正相关,提示CD44V6可能通过Src信号通路促进了细胞的增殖,且有干细胞标记的胃癌细胞显示了更高的细胞增殖率。研究还发现CD44V6阳性病例p-Src及Ki67表达显著高于CD44V6阴性病例,提示CD44V6作为胃癌干细胞的分子标记物,其表达阳性的胃癌病例有更多的不良预后因子。
有研究[2]证实了以细胞膜受体酪氨酸激酶HER2为靶点治疗的有效性,以Src为靶点在部分胃癌中也显示了良好的效果[22]。CD44V6是恶性肿瘤潜在的治疗靶点[10],作为胃癌干细胞的分子标记物,以其为靶点的治疗,是否在表达阳性的胃癌病例中有治疗效果,尚需进一步研究。
[1]Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-2917.
[2]Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, openlabel, randomised controlled trial[J]. Lancet, 2010, 376 (9742): 687-697.
[3]Takaishi S, Okumura T, Tu S, et al. Identification of gastric cancer stem cells using the cell surface marker CD44[J]. Stem Cells, 2009, 27(5): 1006-1020.
[4]Ilangumaran S, Borisch B, Hoessli DC. Signal transduction via CD44: role of plasma membrane microdomains[J]. Leuk Lymphoma, 1999, 35(5-6): 455-469.
[5]Guarino M. Src signaling in cancer invasion[J]. J Cell Physiol, 2010, 223(1): 14-26.
[6]Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown[J]. J Cell Physiol, 2000, 182(3): 311-322.
[7]Bourguignon LY, Wong G, Earle C, et al. Hyaluronan-CD44 interaction promotes c-Src-mediated twist signaling, microRNA-10b expression, and RhoA/RhoC up-regulation, leading to Rho-kinase-associated cytoskeleton activation and breast tumor cell invasion[J]. J Biol Chem, 2010, 285 (47): 36721-36735.
[8]Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[9]Power DG, Kelsen DP, Shah MA. Advanced gastric cancer-Slow but steady progress[J]. Cancer treatment reviews, 2010, 36(5): 384-392.
[10]Orian-Rousseau V.CD44, a therapeutic target for metastasising tumours[J]. European Journal of Cancer, 2010, 46 (7): 1271-1277.
[11]吴雪清, 陈晓丽, 包影, 等. 基质金属蛋白酶及其组织抑制剂和CD44v6在子宫内膜癌中的表达及意义[J]. 温州医学院学报, 2011, 41(1): 48-52.
[12]Gulmann C, Grace A, Leader M, et al. CD44v6: a potential marker of malignant transformation in intestinal metaplasia of the stomach? An immunohistochemical study using tissue microarrays[J]. Eur J Gastroenterol Hepatol, 2003, 15(9): 981-986.
[13]Yamaguchi A, Goi T, Yu J, et al. Expression of CD44v6 in advanced gastric cancer and its relationship to hematogenous metastasis and long-term prognosis[J]. J Surg Oncol, 2002, 79(4): 230-235.
[14]Okayama H, Kumamoto K, Saitou K, et al. CD44v6, MMP-7 and nuclear Cdx2 are significant biomarkers for prediction of lymph node metastasis in primary gastric cancer[J]. Oncol Rep, 2009, 22(4): 745-755.
[15]Chen JQ, Zhan WH, He YL, et al. Expression of heparanase gene, CD44v6, MMP-7 and nm23 protein and their relationship with the invasion and metastasis of gastric carcinomas[J]. World J Gastroenterol, 2004, 10(6): 776-782.
[16]Xin Y, Grace A, Gallagher MM, et al. CD44V6 in gastric carcinoma: a marker of tumor progression[J]. Appl Immunohistochem Mol Morphol, 2001, 9(2): 138-142.
[17]Wiener JR, Windham TC, Estrella VC, et al. Activated Src protein tyrosine kinase is overexpressed in late-stage human ovarian cancers[J]. Gynecol Oncol, 2003, 88(1): 73-79.
[18]Masaki T, Shiratori Y, Okada H, et al. pp60c-src activation in gastric carcinoma: a preliminary study[J]. Am J Gastroenterol, 2000, 95(3): 837-838.
[19]夏加增, 李建平, 李承龙, 等.Survivin和PTEN及Ki67蛋白在胃癌中的表达及其相关性[J]. 中华实验外科杂志, 2008, 25(10): 1344.
[20]Lazar D, Taban S, Sporea I, et al. Ki-67 expression in gastric cancer. Results from a prospective study with long-term follow-up[J]. Rom J Morphol Embryol, 2010, 51(4): 655-661.
[21]Lee JL, Wang MJ, Sudhir PR, et al. CD44 engagement promotes matrix-derived survival through the CD44-SRC-integrin axis in lipid rafts[J]. Mol Cell Biol, 2008, 28(18): 5710-5723.
[22]Mackay HJ, Au HJ, McWhirter E, et al. A phase II trial of the Src kinase inhibitor saracatinib (AZD0530) in patients with metastatic or locally advanced gastric or gastro esophageal junction (GEJ) adenocarcinoma: a trial of the PMH phase II consortium[J]. Invest New Drugs, 2012, 30(3): 1158-1163.
(本文编辑:吴健敏)
Expression of CD44V6, p-Src and Ki67 and their correlation in gastric cancer
WANG Yonghui1, MAO Weibo2, LOU Jian1, ZHOU Yuefen1. 1.Department of Oncology, Lishui Central Hospital, Lishui, 323000; 2. Department of Pathology, Lishui Central Hospital, Lishui, 323000
Objective:To study the expression of the cancer stem cell marker CD44V6, non-receptor tyrosine kinase p-Src and Ki67 proliferation index in gastric cancer and paracancer tissues, analyze their relationship with clinicopathological parameters and prognosis of gastric cancer, and further explore the possible link between the three.Methods:Immunohistochemical staining (EnvisionTM) was used to detect CD44V6, p-Src (Y419) and Ki67 in 85 cases of gastric carcinoma and 41 cases of corresponding paracancer tissues. Differences in the expression of the three and the association with the clinicopathological parameters were analyzed. The possible links that exist between the three were explored.Results:The expression rate of CD44V6, p-Src (Y419) and Ki67 in the gastric cancer tissues was significant higher than that in the adjacent non-tumorous tissues. The expression of CD44V6 was significantly related with tumor size, depth of invasion and pTNM classification (P<0.05); The high expression of p-Src (Y419) was significantly related with tumor size, tumor differentiation and depth of invasion (P<0.05). The high expression of Ki67 was significantly related with tumor size, Lauren classification (P <0.05). Univariate survival analysis revealed a significant association between lower 2-years survival time and CD44V6 expression, p-Src (Y419) and Ki67 high expression. Multivariate analysis revealed that CD44V6 expression and elevated p-Src (Y419) and Ki67 expression were not an independent poorly prognostic parameter for 2-years survival time. The expression of p-Src and Ki67 was higher in the CD44V6 positive expression gastric cancer tissues than that in CD44V6 negative expression gastric cancer tissues. There was positive correlation among CD44V6, p-Src and Ki-67 expression (P<0.05). Conclusion: The expression of CD44V6, p-Src and Ki67 maybe a biological marker for poor prognosis for gastric cancer.
gastric neoplasm; CD44V6; Src; Ki67; prognosis
R735.2
A
1000-2138(2014)04-0272-06
2013-06-24
王永辉(1978-),男,河北安国人,主治医师,硕士。
周月芬,主任医师,Email:lszhouyf2012@qq. com。
