建立脑双位点微透析结合高效液相色谱-柱后固定化酶反应器-电化学方法同步监测大鼠腹内侧前额叶皮质和海马中乙酰胆碱和胆碱含量
2014-03-23张美玉蔡铁全孙丹丹王丹巧
张美玉,蔡铁全,孙丹丹,刘 洋,崔 悦,王丹巧
(1.中国中医科学院医学实验中心,北京 100700;2.国家食品药品监督管理总局保健食品审评中心,北京100070)
建立脑双位点微透析结合高效液相色谱-柱后固定化酶反应器-电化学方法同步监测大鼠腹内侧前额叶皮质和海马中乙酰胆碱和胆碱含量
张美玉1,蔡铁全2,孙丹丹1,刘 洋1,崔 悦1,王丹巧1
(1.中国中医科学院医学实验中心,北京 100700;2.国家食品药品监督管理总局保健食品审评中心,北京100070)
目的建立同步动态监测清醒自由活动状态下大鼠腹内侧前额叶皮质(m PFC)和海马细胞外液中乙酰胆碱(ACh)和胆碱(Ch)方法,用于药物干预下不同脑区胆碱类神经递质变化研究。方法建立m PFC和海马双位点双通道同步微透析采样技术和高效液相色谱-柱后固定化酶反应器-电化学(HPLCIMER-ECD)方法。通过对清醒自由活动大鼠m PFC和海马同步灌流透析取样,HPLC-IMER-ECD分析药物作用下大鼠mPFC和海马细胞外液中ACh和Ch的动态变化,验证该技术方法的可行性和适用性。结果大鼠m PFC和海马双套管植入术及透析采样后状态表现良好,表明脑双位点双通道同步微透析采样技术可行。HPLC-IMER-ECD法测定ACh和Ch,两者浓度在0.02~2.00μm o l·L-1范围内线性关系良好,ACh最低检测限为10 nm o l·L-1,Ch最低检测限为5 nm o l·L-1(信噪比为3∶1)。ACh 0.1,0.4和2.0μm o l·L-1日内精密度相对标准偏差为0.87%~1.83%,日间精密度为5.38%~6.80%;Ch日内精密度相对标准偏差为1.60%~2.91%,日间精密度相对标准偏差为5.56%~7.38%;ACh相对回收率为96.0%~113.0%,Ch为102.3%~109.2%。叠氮钠能明显降低m PFC和海马细胞外液中ACh(P<0.05),但能显著升高两脑区内Ch含量(P<0.05)。人参皂苷Rg1可逆转叠氮钠导致的海马区ACh降低(P<0.05)及m PFC和海马区Ch含量的升高(P<0.05)。m PFC细胞外液中ACh和Ch较高,受到叠氮钠影响较海马区更敏感。结论脑双位点微透析结合HPLC-IMER-ECD方法能同步监测大鼠m PFC和海马中ACh和Ch含量变化。人参皂苷Rg1可通过调节脑内ACh和Ch动态平衡,增强中枢胆碱能系统的功能。
脑双位点微透析;高效液相色谱法;固定化酶反应器;电化学;乙酰胆碱;胆碱
DO l:10.3867/j.issn.1000-3002.2014.01.015
脑内微透析(brain microdialysis,BMD)技术是一种对麻醉或清醒自由活动动物脑内取样的新手段,它的出现为脑内细胞外环境进行在体采样和动态监测提供了方便。以往报道显示,脑内神经递质变化的研究方法多采用单位点单通道BMD采样,而多位点多通道BMD的开发和应用却很少涉及[1]。因此,本研究室近期开展了脑双位点双通道同步微透析采样技术,结合高效液相色谱-柱后固定化酶反应器-电化学(high performance liquid chromatography with post column immobilized enzyme reactor electrochemical detection,HPLC-IMERECD)分析方法,对大鼠脑内胆碱能神经主要投射区域腹内侧前额叶皮质(medial prefrontal cortex,m PFC)和海马细胞外液中乙酰胆碱(acetylcholine,ACh)和胆碱(choline,Ch)进行动态监测和对比分析,比较不同神经核团内胆碱类神经递质的含量。同时采用特异性呼吸链复合体Ⅳ抑制剂叠氮钠(NaN3)对大鼠m PFC和海马同步灌流,造成胆碱能神经投射区域线粒体损伤和胆碱类递质代谢异常,建立一种相对简单、快速并适宜微透析动态监测的急性阿尔茨海默症大鼠模型,观察人参皂苷Rg1对该模型的m PFC和海马细胞外液中胆碱类递质的影响,为筛选中药脑保护剂提供方法学参考和药理学实验依据。
1 材料与方法
1.1 实验动物
SD大鼠18只,雄性,体质量250~300 g,购于北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2012-0001。每一塑料笼(长35 cm,宽47 cm,高20 cm)饲养大鼠3~5只,自由进食饮水。实验室环境温度(16~20)℃,相对湿度为40%~55%,12 h光照周期(7:00~19:00照明)。
1.2 药品和试剂
人参皂苷Rg1,批号为MUST-11041201,四川成都生物制品检定所生产;氯化ACh、氯化Ch、甲硫酸新斯的明(neostigmine methylsulfate)、氯化钾和HPLC级防腐剂ProC lin95均购自Sigm a公司。NaN3,Merck公司产品。乙腈和甲醇为Fisher Chem ica ls公司产品。水合三氯乙醛、氯化钠、氯化钙、氯化镁、磷酸氢二钠、磷酸二氢钾、碳酸氢钠、氢氧化钠、磷酸二氢钠和EDTA-Na2均为分析纯级,国药集团化学试剂有限公司。
1.3 仪器设备
液相检测系统包括高效液相色谱、Antec DecadeⅡSDC电化学检测器、铂金工作电极、银/氯化银参比电极和Clarity Lite色谱工作站,荷兰Antecleyden公司出产。微柱ACh/Ch分析柱(165G-007A,530 mm×1 mm)和AChE/ChOX×IMER(191-H03,50 mm×1 mm),均由美国BASi公司提供。SHB-ⅢA循环水式多用真空泵,郑州长城科工贸有限公司;KQ-1000超声波清洗器,昆山超声波仪器有限公司;德国Sartorius arium 61316反渗透纯水系统;天津津腾水相和有机相微孔滤膜。
立体定位仪STRONG8003、动物体温维持仪-69001和手持式颅钻/90-102,购自深圳瑞沃德公司。玻璃离子体水泥(水门汀),上海医疗器械股份有限公司齿科材料厂。微透析系统包括CMA/12 MD Elite探针(膜长:4 mm,膜直径:0.5 mm,截留量:20 kU/膜长:2 mm,膜直径0.5 mm,截留量:20 kU)及探针套管、CMA/402微量注射泵和CMA/470低温样品自动收集器,均购自瑞典CMA Microd AB公司;五通转环清醒活动装置,美国InsteCh公司。
1.4 动物分组和给药
大鼠自由进食和饮水,适应性饲养3 d,随机分为正常对照组、模型组和人参皂苷Rg1组,每组6只。人参皂苷Rg1组大鼠脑套管植入术前7 d连续ip给药20 m g·kg-1,每天1次,给药体积为4 m L·kg-1。
1.5 大鼠脑双位点同步微透析采样
1.5.1 大鼠m PFC和海马双位点套管植入术
大鼠ip给予水合氯醛350 m g·kg-1麻醉。头部剃毛并清理干净,固定于立体定位仪,颅脑处于水平位,再用眼眶固定杆固定大鼠的框下缘。颅骨表面暴露大小约20 mm×20 mm。参照Paxinos等[2]编写的大鼠立体定位图谱,以前囟(bregma)为坐标原点,在脑m PFC(前:3.2 mm,右:1.5 mm,深:2.0 mm,与矢状面成10°的夹角)和海马(后:5.6 mm,左:4.6 mm,深:3.4 mm)处用手持式颅钻打孔。在与此定位点成三角形、距离4~7 mm的恰当位置再选取2个位点,作为固定小螺钉的打孔和植入点。之后用弯镊和螺丝刀相互配合,把2个小螺钉分别拧紧并固定于颅骨表面。接着在套管植入点处暴露硬脑膜,用注射针头轻轻挑起硬脑膜,暴露脑表面。调整定位仪的立体臂,从套管尖端接触脑表面开始计数,并缓慢旋转插入至设定深度。调好玻璃离子体水泥的黏稠度,先固定大脑左半球后方海马套管,然后再固定右半球右上方m PFC处的套管。用配套的堵头将套管封口。术后ip给予庆大霉素(40 mg·kg-1)一次,在室温条件下恢复1 d,观察大鼠是否有死亡,行动与饮食异常,是否有无萎靡不振等现象。
1.5.2 配置改良的林格氏液
对灌流液的组成及配比[3]进行了调整,故命名为改良的林格(Ringer)液(N-Ringer),其组成为(mmo l·L-1):NaCl 125.0,KCl 2.7,CaCl21.2,MgC l21.0,NaHCO323.0,Na2HPO44.3和KH2PO41.5。用18.2Ω去离子水溶解,混匀,用HC l调节pH值为7.4,0.22μm微孔滤膜过滤,4℃保存在冰箱中待用。
1.5.3 大鼠脑双位点双通道同步透析采样
术后次日从8:00~20:00进行透析实验。大鼠在清醒状态下插入探针,其中将膜长2 mm探针插入m PFC位点套管中,将4 mm探针插入于海马套管中。用胶布固定好两个探针,将大鼠放在清醒活动装置(33 cm×40 cm×36 cm)内让其自由活动。两条通路均用改良的N-Ringer(含新斯的明2μmol·L-1)同步灌流透析,每个通道流速均为1.5μL·m in-1。平衡1 h后,开始收集透析液,每20 m in收集1管(样品体积为30μL)。其中正常对照组用N-Ringer灌流,共收集540 m in。模型组和Rg1组用N-Ringer灌流平衡后,先收集透析液4管,作为基础水平值。再用含NaN3的N-Ringer(含NaN350μm ol·L-1和新斯的明2μmo l·L-1,NaN3-N-Ringer)灌流120 m in造成脑线粒体损伤的急性AD模型,然后再换为N-Ringer灌流340 m in。Rg1组大鼠在NaN3-N-Ringer灌流结束同时,ip给予Rg1 20 mg·kg-11次,之后连续收集340 m in(图1)。透析结束后大鼠给予麻醉剂量的水合氯醛350 m g·kg-1,处死大鼠,剥离大脑半球,置于10%甲醛固定液中,HE染色固定切片,镜下观察探针植入位置、深度及脑组织损伤情况。
1.5.4 体外回收率测定
不同膜长探针在使用前分别放置于ACh/Ch混标液(1.00μmol·L-1)中,室温为37℃,用N-Ringer以1.5μL·m in-1灌流,平衡30 m in后,开始收集透析液,每20 m in为1管,共4管。ACh(或Ch)探针体外回收率(%)=(透析液的浓度均值/标准放置液中的浓度均值)×100%,用来折算脑微透析液中ACh和Ch的浓度。
1.6 HPLC-lMER-ECD分析ACh和Ch的方法1.6.1 色谱条件
等梯度洗脱的流动相组成为:50 mmol·L-1的NaH2PO4·2H2O,0.5 mmol·L-1的Na2·EDTA·2H2O,2 mmol·L-1的KCl,ProClin防腐剂1 m L·L-1,用NaOH调节pH值为8.3,用0.22μm膜过滤。流速为0.13 mL·m in-1。参考电极的电位设置为+310 mV。柱温和电极工作室温为37℃,进样量为20μL。
1.6.2 配置ACh和Ch标准原液和ACh/Ch混标应用液
精确称取氯化ACh 18.15 mg,氯化Ch 13.95 mg,分别溶于50.00 m L乙酸标准稀释液中,配制ACh和Ch标准原液(2.00 mm ol·L-1)。再分别吸取1.00 m L的ACh和Ch标准原液稀释到100.00 m L,制成各自的标准储备液(20.00μmol·L-1)。ACh和Ch标准储备液各取10.00 m L进行混合,制成ACh/Ch混标应用液(10.00μm ol·L-1)。
1.6.3 方法专属性考察
精确加入乙酸标准稀释液,将ACh/Ch混标应用液(10.00μmol·L-1)逐级稀释为1.00μmol·L-1,也将ACh和Ch的单标储备液稀释成浓度为1.00μm o l·L-1。以乙酸标准稀释液为对照进样,然后再分别将ACh和Ch的单标、混标应用液连续5次进样测定。
1.6.4 线性关系
精确加入乙酸标准稀释液,将ACh/Ch混标应用液(10.00μm ol·L-1)逐级稀释成以下浓度:2.00,1.00,0.40,0.20,0.10,0.04和0.02μmol·L-1,每个浓度连续进样5次,进行7个浓度分析,其中标准曲线以样品浓度(X)和峰面积(Y)做线性回归,得到ACh和Ch标准曲线。
1.6.5 精密度
ACh/Ch混标稀释液0.10,0.40和2.00μmol·L-1,每个浓度标准溶液于1 d内重复测定5次,按照样品浓度的相应峰面积计算日内精密度;同法连续测定5 d,计算日间精密度。
1.6.6 相对回收率
ACh/Ch混标稀释液0.10,0.40和2.00μmol·L-1分别连续进样5次,以实测的浓度(由标准曲线求出各样品的浓度)与ACh(或Ch)标准溶液浓度之比来计算相对回收率。
1.6.7 稳定性
标准溶液4℃冷藏放置稳定性考察:ACh/Ch混标稀释液0.04,0.20和1.00μmol·L-1分别在4℃冷藏放置6,12和24 h,以即刻(0 h)作为对照,每个浓度连续进样3次。测定各浓度ACh和Ch的峰面积,将测定的结果进行比较。
标准溶液25℃室温放置稳定性考察:上述3个浓度ACh/Ch混标稀释液置于25℃室温放置3,6和12 h后进行测定,与即刻(0h)的样品检测结果进行对照,测定各浓度ACh和Ch的峰面积,并用面积衰减百分率(AD%)来表示ACh和Ch的稳定性。
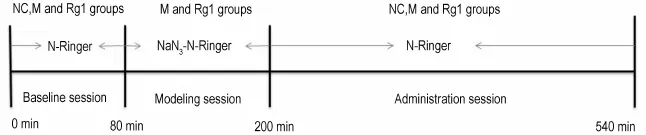
Fig.1 Sampling procedures of brain microdialysis.After a stabilization period of1 h,dual dialysis probes were perfused synchronously at a rate of 1.5μL·m in-1with Ringer′s solution containing neostigmine methylsulfate 2μmol·L-1(N-Ringer).Baseline dialysate samples were collected for 80 m in.Rats in model group(M)or Rg1 group were perfused with modified Ringer's solution(containing NaN350μmol·L-1in N-Ringer,NaN3-N-Ringer)for 120 m in in the course of modeling and then switched back to N-Ringer to get perfused.Dialysate samples were taken continuously 340 m in during administration.Rats of Rg1 group were ip given Rg1 20 m g·kg-1while perfusion with NaN3-N-Ringer ended.NC:normal control group.
1.7 HPLC-lMER-ECD检测透析液中ACh和Ch含量
分别对两脑区收集结束时间点为20,60,100,140,180,220,260,300,340,380,420,460,500和540 m in的透析液进行测定。通过探针体外回收率折算两脑区内不同时间点含量。
1.8 统计学分析
2 结果
2.1 成功建立大鼠脑双位点同步微透析采样技术
为了验证探针进入位置,对脑组织进行HE染色和切片。所有探针确定放置在m PFC和海马的边缘。探针植入mPFC的前额叶皮质和扣带回皮质,植入海马区探针占用CA1,CA2和CA3区域(图2)。脑切片镜下观察到探针植入点见大量炎症细胞聚集,也存在少量红细胞(图3)。把握定位的技术关键,能够准确地进行大鼠脑双位点的套管植入术和同步透析取样(图4)。术中及术后未见大鼠死亡和异常行为,术后24 h状态良好。控制大鼠头颈部并对其安抚,清醒状态下快速插入探针大鼠反应不强烈。双通道同步低流速灌流12 h及灌流后未见大鼠异常,采样顺利完成。
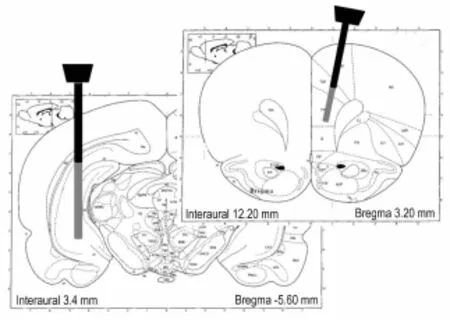
Fig.2 lllustration of microdialysis p robe targets in medial prefrontal cortex(m PFC)and hippocampus(Hip).Probes(grey area indicates probe m embrane,black area indicates probe shaft)in m PFC occupied prelimbic and cingulate cortex,and those in Hip occupied the CA1,CA2,and CA3 sub-regions of the hippocampal formation.
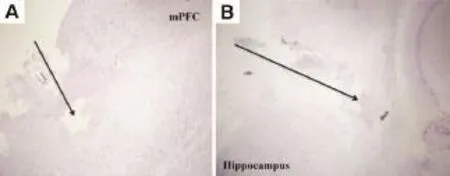
Fig.3 lmplantation position of probes in to m PFC(A)and Hip(B)(HE×400).The black arrows are the positions of implantation of the probe.There are a large number of lymphocytes in the area implanted into by probes,and a small amount of red cells in m PFC.

Fig.4 Dual-probe synchronous microdialysis in mPFC and Hip of rats.
2.2 HPLC-lMER-ECD分析ACh和Ch方法
2.2.1 方法的专属性
乙酸标准稀释液的色谱图上未见有峰(图5),而ACh/Ch混标稀释液色谱图上出现2个峰(图6),结合单标测定结果,ACh和Ch峰的保留时间分别是8.03和9.88 m in,说明本方法具有较好的专属性。并且采用此方法对正常对照组m PFC和海马透析液也进行了检测(图7)。
2.2.2 线性关系和最低检测限
ACh的回归方程为Y=244.24X+27.58(R2=0.9943);Ch的回归方程为Y=268.04X+50.303(R2=0.9950)。结果表明,ACh和Ch浓度在0.02~2.00μm o l·L-1范围内线性关系良好(图8)。以信噪比为3∶1计,ACh最低检测限为10 nm o l·L-1,Ch最低检测限为5 nmo l·L-1。通过多次反复进样,结果具有一致性。
2.2.3 精密度
ACh日内精密度良好,相对标准偏差(relative standard deviation,RSD)均在0.87%~1.83%,日间精密度在5.38%~6.80%。3个浓度Ch日内精密度RSD为1.60%~2.91%,日间精密度RSD在5.56%~7.38%(表1)。
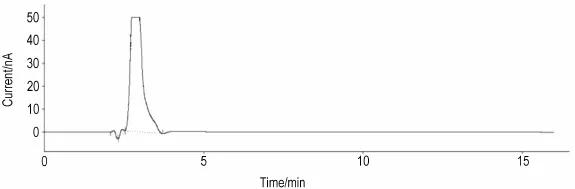
Fig.5 Chromatogram of acetic acid standard diluent by high performance liquid chromatography with post column immobilized enzyme reactor electrochemical detection(HPLC-lMER-ECD).
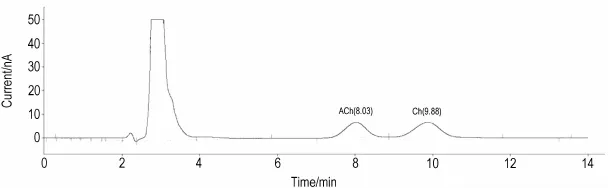
Fig.6 Ch rom atog ram of acety lcho line(ACh)and cho line(Ch)by HPLC-lMER-ECD.

Fig.7 Chromatograms of ACh and Ch in microdialysates from mPFC and Hip of normal rats by HPLC-lMER-ECD.
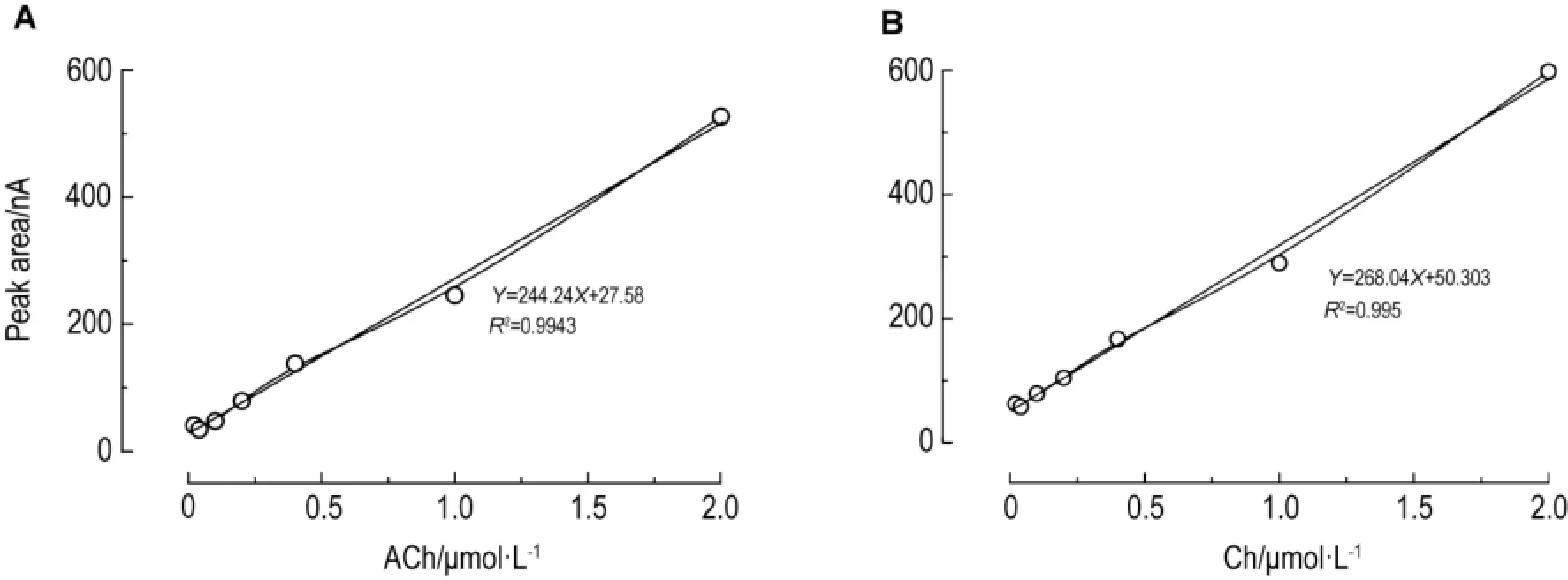
Fig.8 Linear curves of ACh(A)and Ch(B)detected by HPLC-lMER-ECD.
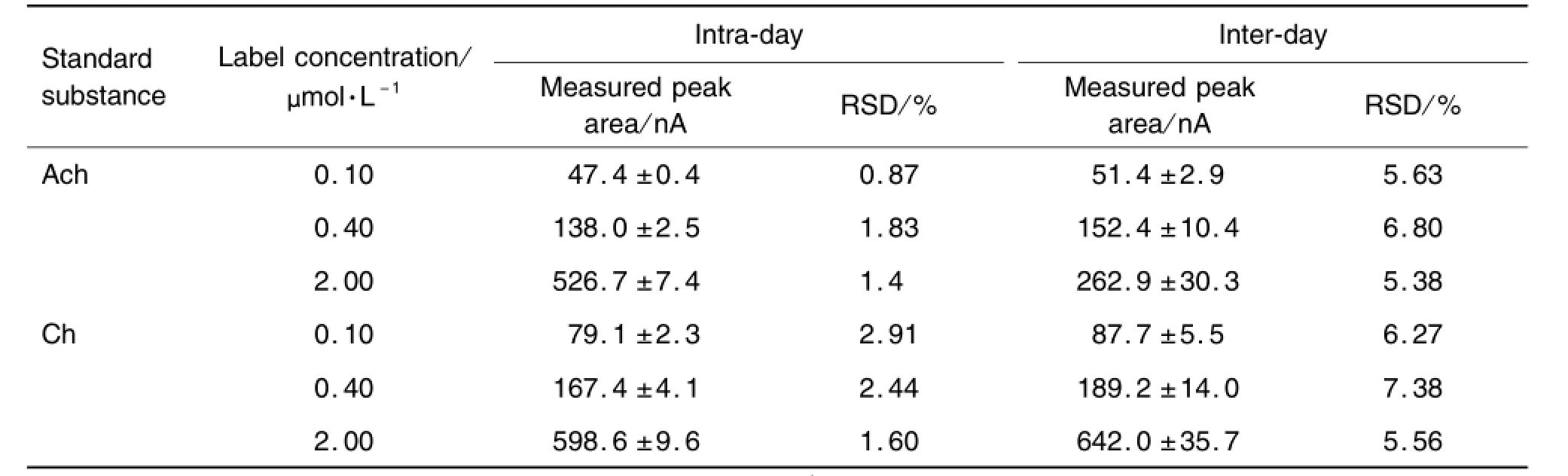
Tab.1 lntra-day and in ter-day precision for ACh and Ch peak areas for assay by HPLC-lMER-ECD
2.2.4 相对回收率
ACh 0.1,0.4和2.0μmol·L-13个浓度的相对回收率分别为(96.0±1.1)%,(113.0±2.6)%和(102.2±1.5)%;Ch 0.1,0.4和2.0μmol·L-13个浓度的相对回收率分别为(107.3±8.6)%,(109.2± 3.8)%和(102.3±1.8)%(表2)。
2.2.5 稳定性
ACh/Ch混标稀释液0.04,0.20和1.00μm o l·L-1在4℃冷藏放置6 h,其衰减量最大,但放置时间延长至24 h,其衰减基本保持不变。同样,在25℃室温条件下放置6~12 h,Ach和Ch衰减量达到原浓度的30%(表3和表4)。The standard solutions of ACh and Ch 0.04,0.20 and 1.00μmol·L-1were placed at4℃for different time points.Area degradation percentage(%)=(peak area of p laced specific tim e-peak area of0 h)(nA)/peak area of0 h(nA)×100%,which represented the stability of ACh and Ch.,n=3.
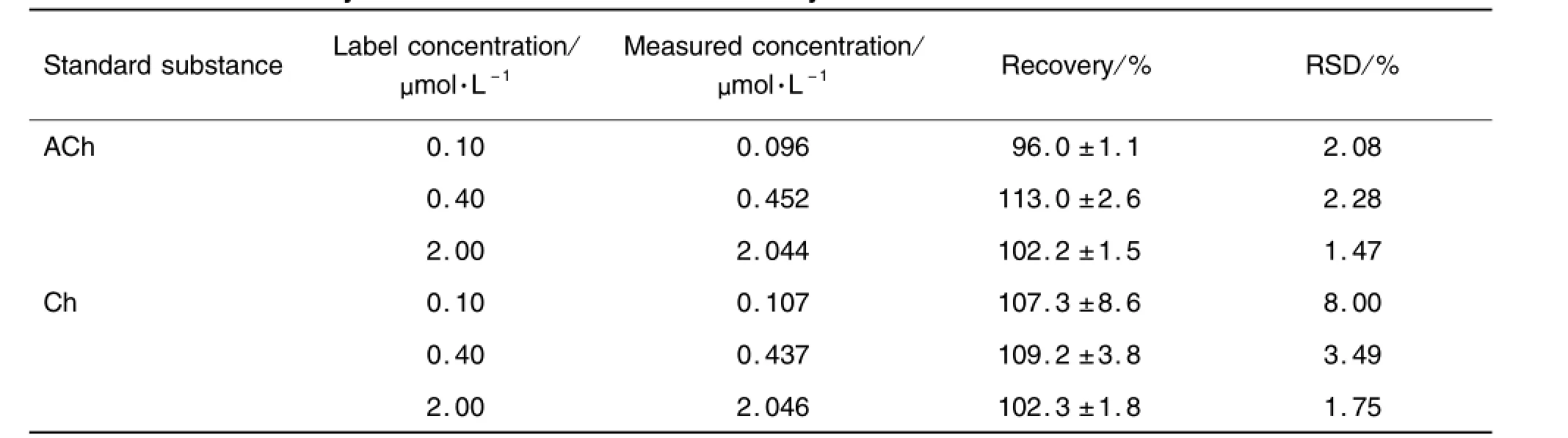
Tab.2 Relative recovery of concentration of ACh and Ch by HPLC-lMER-ECD
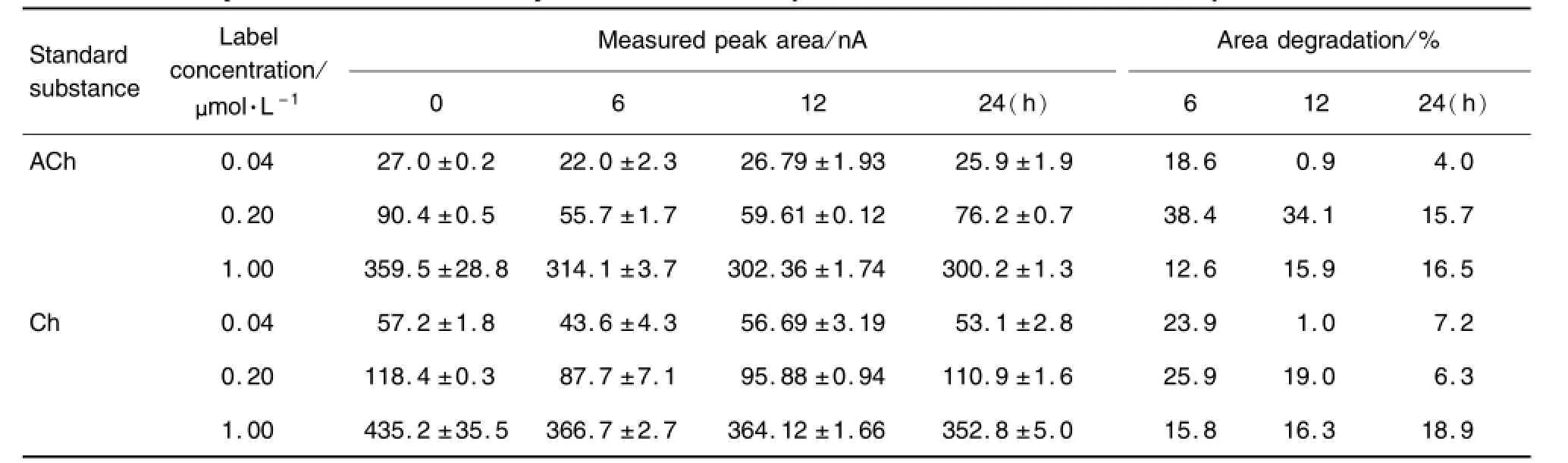
Tab.3 Stability test of ACh and Ch by HPLC-lMER-ECD placed at 4℃for different time points
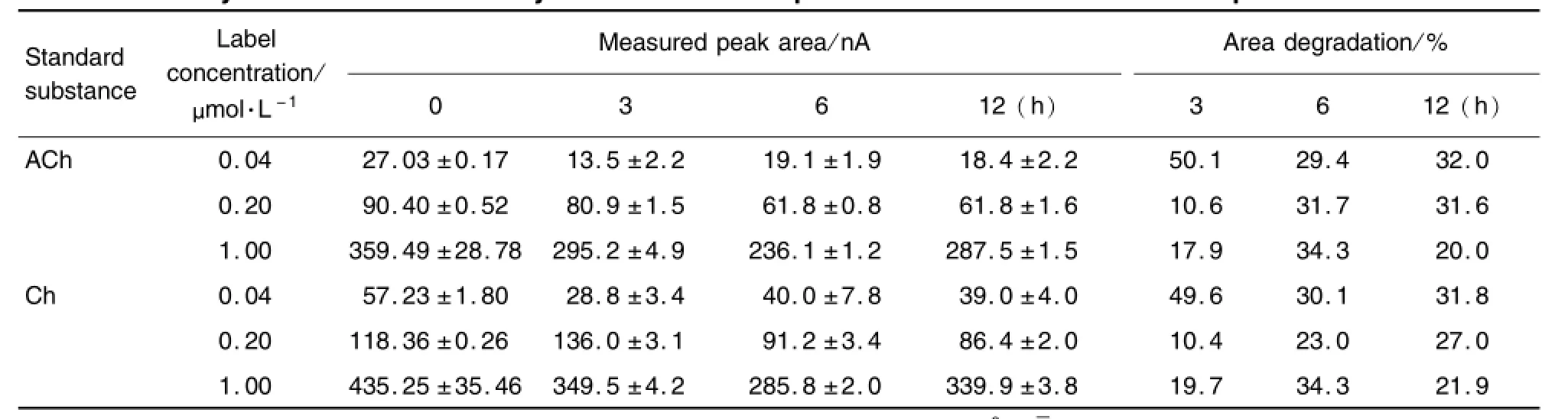
Tab.4 Stability test of ACh and Ch by HPLC-lMER-ECD placed at 25℃for different time points
2.3 人参皂苷Rg1对大鼠m PFC和海马透析液中ACh和Ch含量的影响
2.3.1 正常组m PFC和海马细胞外液中ACh的含量
大鼠m PFC细胞外液中ACh含量在100~140 m in明显高于海马(P<0.05)。m PFC细胞外液中ACh含量在260 m in和420~500 m in明显低于20 m in(P<0.05)。同样,海马细胞外液中ACh含量在180~540 m in也显著低于20 m in(P<0.01)(图9)。
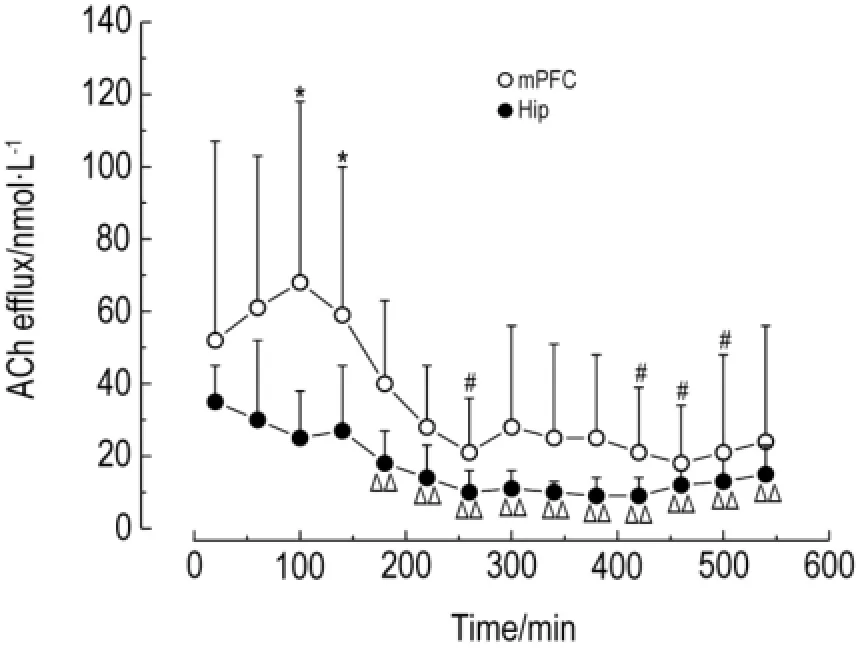
Fig.9 Comparison of ACh efflux from m PFC and Hip of normal rats.The rats of normal control group were perfused(1.5μl·m in-1)with Ringer′s solution containing neostigmine methylsulfate 2μmol·L-1by double-probe synchronous brain microdialysis in m PFC and Hip and collected for540 m in.,n=6.*P<0.05,compared with Hip group at the same time;#P<0.05,compared with 20 m in in m PFC;△△P<0.01,compared with 20 m in.
2.3.2 正常大鼠m PFC和海马细胞外液中Ch含量
大鼠m PFC细胞外液中Ch含量在60,100和300~380 m in明显高于海马(P<0.05),说明正常大鼠m PFC中Ch含量高于海马区。m PFC细胞外液中Ch含量随着采样时间延长,在180~540 m in显著低于20 m in(P<0.01)。同样,海马细胞外液中Ch也显著降低(P<0.01)。这说明不同时间点m PFC和海马细胞外液中Ch含量变化幅度很大(图10)。
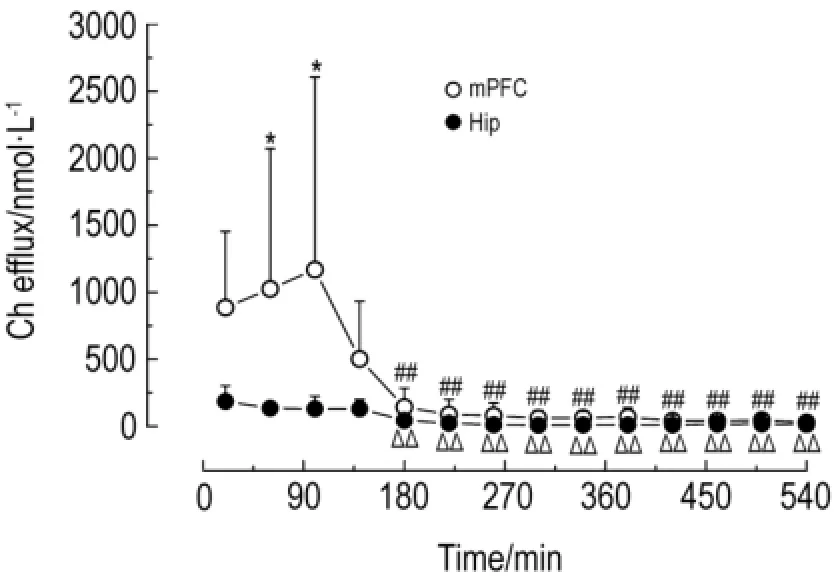
Fig.10 Level of Ch of extracellular fluid in m PFC and Hip of normal rats.See Fig.9 for the rat treatment.,n=6.*P<0.05,compared with Hip group at the same time;##P<0.01,com pared with 20 min in mPFC group;△△P<0.01,compared with 20 m in in Hip group.
2.3.3 人参皂苷Rg1对m PFC和海马细胞外液中ACh的影响
与正常对照组相比,模型组大鼠m PFC细胞外液中ACh含量在140~180 m in时明显降低(P<0.05),而Rg1组在相应的时间点未见明显变化(图11A)。
与正常对照组相比,模型组大鼠海马细胞外液中ACh在140 m in时明显降低(P<0.05)。与模型组相比,Rg1组在180~260 m in ip给药后ACh明显升高(P<0.05)(图11B)。
2.3.4 人参皂苷Rg1对m PFC和海马细胞外液中Ch含量的影响
与正常对照组相比,模型组大鼠在140~260 m in时细胞外液中Ch含量明显升高(P<0.05,P<0.01),在380 m in后明显降低(P<0.05)。Rg1组在100~260 m in也明显高于正常对照组(P<0.05),在180,260,460和540 m in Ch明显高于模型组(P<0.05)(图12A)。
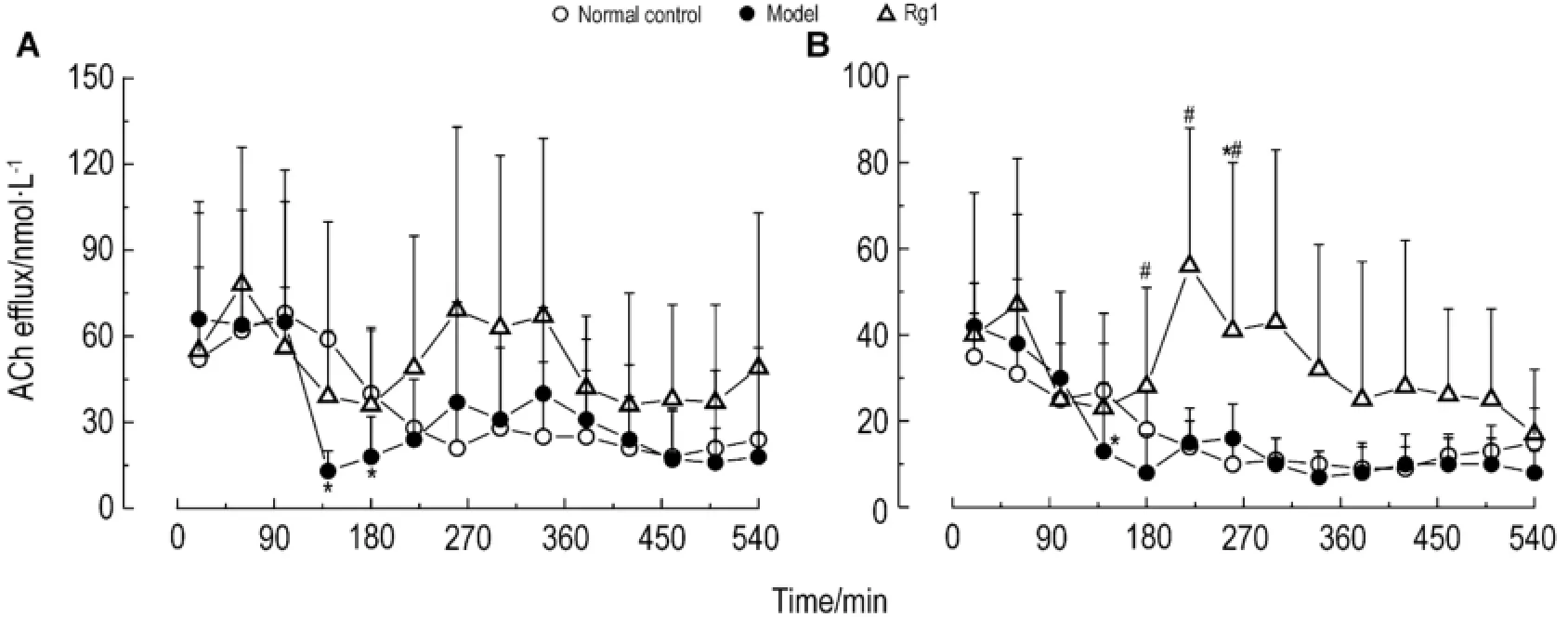
Fig.11 Effect of Rg1 on ACh efflux in m PFC(A)and Hip(B)of rats.After perfusion at baseline session,the rats in model group or Rg1 group were perfused with modified Ringer′s solution(containing NaN350μmol·L-1in N-Ringer,NaN3-N-Ringer)for120 m in in the course of modeling,and then sw itched back to N-Ringer to get perfused.Dialysate samples were taken continuously 340 m in during administration.The rats of Rg1 group were ip given Rg1 20 mg·kg-1while the perfusion with NaN3-N-Ringer ended.,n=6.*P<0.05,compared with normal control group;#P<0.05,compared with model group.
与正常对照组相比,模型组大鼠m PFC细胞外液中Ch在180~300 m in显著升高(P<0.01),而Rg1组在140~220 m in也显著升高(P<0.01)。与模型组相比,Rg1组Ch在140~260 m in明显降低,而在340,460和540 m in明显升高(P<0.05)(图12B)。
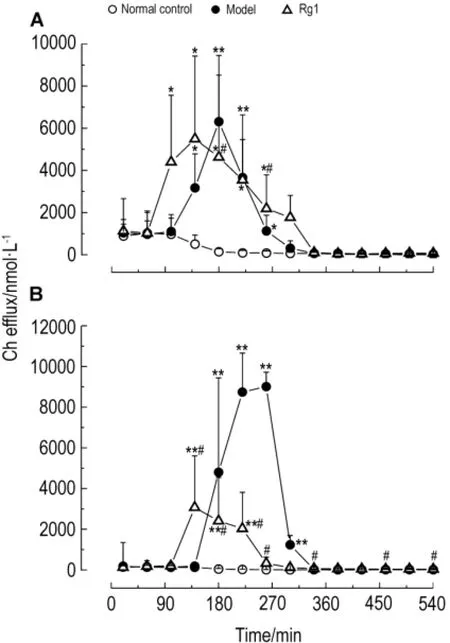
Fig.12 Effect of Rg1 on Ch efflux in m PFC(A)and Hip(B)o f rats.See Fig.11 for the rat treatment.,n=6.*P<0.05,**P<0.01,com pared with normal control group;#P<0.05,com pared with model group.
3 讨论
建立大鼠m PFC和海马双通道同步透析技术关键的两部分是脑双位点套管植入术和双通道同步透析采样。前者关键是明确颅骨表面2个位点之间距离要适合打孔和植入套管,便于螺钉和水泥固定。另外,钻孔角度和植入套管的顺序也很重要。根据前囟位置应先定位海马位点并垂直钻孔,然后调整定位仪臂倾斜10°,确定m PFC的位点并以倾斜度打孔。植入套管按照由前向后顺序,先植入m PFC位点并固定套管,然后再植入海马位点的套管,2个套管用牙科水泥环绕固定并连接成一体,防止在插探针和透析中从颅骨上脱离。同样,大鼠在清醒活动状态下进行双通道透析取样,前提是固定好插入脑组织中2个探针,防止其在透析过程中脱落,损坏探针透析膜。而且重复插入探针对植入位点的脑组织损伤较严重,大鼠的应激反应增大,平衡时间会延长,透析液测定结果就不能客观真实地反映药物效用。双位点同步透析取样要求2个探针都能同时正常采样,有一个探针不能顺利采样,就会影响整个透析取样的过程。这也是双位点BMD不容易操作和把握的技术环节。
BMD技术毕竟是一种创伤性取样方法,对实验动物的脑组织有一定损伤,应采取一些方法尽量减少受试动物脑组织的损伤程度。植入套管操作中应避免损伤颅骨下硬脑膜和血管,减少大量出血。出血量过多会影响动物状态恢复,套管底部会有血凝块存在,影响探针顺利插入或是黏在透析膜外减少透析液量。另外套管植入术后给予动物抗生素,防止伤口处感染,便于受试动物恢复。也可通过延长术后动物恢复期(3~7 d)来减轻这种损伤。选取双位点的空间距离要允许在颅骨表面操作,最好定位在2个大脑半球上。相邻2个神经核团由于探针的体积占位和操作不便不能采用该方法。本研究前期完成了4组双位点套管植入术,分别为丘脑/中脑水管、前皮质/海马、m PFC/丘脑和m PFC/海马。另外,双通道同步透析时每个通道灌流速度应控制在2.0μL·m in-1以下,流速过大对脑组织有一定损伤,也会影响透析液中神经递质的含量。
双位点BMD技术操作繁琐,应用上存在局限性,但只要把握上述技术关键,能够准确顺利完成手术过程。该方法在使用较少量实验动物的情况下获得2个神经核团内多个神经递质和药物的动态变化,减少反复多次实验造成的动物成本,降低实验过程中存在的误差,更能真实可靠地判断疾病的发生发展过程和药物干预后疾病转归情况,为开展在体研究中药脑内作用机制提供了新的技术方法和研究思路。
ACh在脑细胞外液中浓度很低(0.1~6 nm ol·L-1),Ch浓度较高(1~5μm o l·L-1)。ACh释放后很快在突触间隙被乙酰胆碱酯酶(acetylcholinesterase,AChE)快速分解,所以采用微透析技术采样测定相当困难[4-5]。局部AChE抑制剂(新斯的明或毒扁豆碱)的存在可以剂量依赖性地增加细胞外液中ACh,延长消除时间。为了便于检测,国内外微透析研究均在灌流液中加入AChE抑制剂。国内同类研究中采用新斯的明浓度为10μmol·L-1[6],国外新斯的明用量为(0.02~2)μmol·L-1[7-9]。同样,本研究采用Ringer液中加入新斯的明2μmol·L-1同步灌流10 h,考察大鼠m PFC和海马中ACh和Ch含量变化。结果显示,健康大鼠m PFC细胞外液中ACh和Ch含量明显高于海马,这与核磁-共振波谱和微电极敏感器测定结果一致[10]。另外研究表明,NaN3能明显降低m PFC和海马细胞外液中ACh,但相反升高m PFC和海马细胞外液中Ch。而人参皂苷Rg1具有逆转NaN3导致的m PFC和海马细胞外液中ACh降低和Ch升高的趋势,能持续增加m PFC和海马中ACh和Ch。m PFC细胞外液中ACh和Ch含量较高,受到NaN3的影响较海马区更敏感。这说明m PFC和海马中ACh和Ch浓度变化具有同步性和可比性。
本研究结果表明,大鼠m PFC和海马中ACh和Ch在10 h内波动范围较大,m PFC和海马细胞外液中ACh和Ch透析的前3 h均显著高于后7 h,透析第3小时后逐渐降低,透析中后期ACh和Ch水平基本稳定。这可能由于大鼠清醒状态下2个探针插入并进行双通道同步灌流,探针平衡时间较短暂(1 h),刺激尚未缓解,这使得透析前期ACh和Ch水平较高。因此,探针植入后至少要平衡2 h再开始收集透析液。另外,ACh和Ch的稳定性不好,放置期间很容易衰减,一般取样后即刻检测。本研究每天进行2只大鼠的双通道同步取样,在透析3 h后样品数量较多,而HPLC-IMER-ECD检测1管样品需要16 m in,所以透析中后期收集的样品在检测前放置时间会延长。这些具体情况都可能是导致ACh和Ch水平前后差异较大的因素。
[1] Day JC,Kornecook TJ,Quirion R.Application of in vivo microdialysis to the study of cholinergic systems[J].Methods,2001,23(1):21-39.
[2] George P,Charles W.The Rat Brain in Stereotaxic Coo rdinates(大鼠脑立体定位图谱)[M]∥Zhuge QX,translation.Beijing:Peop le′s Medical Publishing House,2005:Fig.8,Fig.40.
[3] Fadel J,Sarter M,Bruno JP.Age-related attenuation of stimulated cortical acetylcholine release in basal forebrain-lesioned rats[J].Neuroscience,1999,90(3):793-802.
[4] TsaiTH.Separation methods used in the determination of choline and acetylcholine[J].J Chromatogr B Biomed Sci Appl,2000,747(1-2):111-122.
[5] Uu tela P,ReiniläR,Piepponen P,Ketola RA,Kostiainen R.Analysis of acetylcholine and choline in microdialysis samples by liquid chroma tography/tandem mass spectrometry[J].Rap id Commun Mass Spectrom,2005,19(20):2950-2956.
[6] Sun XF,Wang W,Zhao DZ,Wang DQ.The method of continuous measuring extracellular acetylcholine and choline levels in striatum of freely m oving awake rats[J].Chin Pharmacol Bull(中国药理学通报),2004,20(2):232-234.
[7] Potter PE,Meek JL,Neff NH.Acetylcholine and choline in neuronal tissue measured by HPLC with electrochemical detection[J].J Neurochem,1983,41(1):188-194.
[8] Girelli AM,Mattei E.Application of immobilized enzyme reactor in on-line high performance liquid chromatography:a review[J].J Chromatogr B Analyt Technol Biomed Life Sci,2005,819(1):3-16.
[9] Parikh V,Sarter M.Cortical choline transporter function measured in vivo using choline-sensitivemicroelectrodes:clearance of endogenous and exogenous choline and effects of removal of cholinergic terminals[J].J Neurochem,2006,97(2):488-503.
[10] Wang XC,Du XX,Tian Q,Wang JZ.Correlation between choline signal intensity and acetylcholine level in different brain regions of rat[J].Neurochem Res,2008,33(5):814-819.
To establish method of determination of acetylcholine and choline in medial prefrontal cortex and hippocampus of rats by doublep robe brain synchronous micro-dialysis combined with high performance liquid chromatography with post column immobilized enzyme reactor electrochemical detection
ZHANG Mei-yu1,CAI Tie-quan2,SUN Dan-dan1,LIU Yang1,CUI Yue1,WANG Dan-qiao1
(1.Experimental Research Center,China Academy of Traditional Chinese Medicine,Beijing 100700,China;2.Center for Health Food Evaluation,the State Food and Drug Administration,Beijing 100070,China)
OBJECTlVETo establish a method of synchronous dynamic monitoring of extracellular acetylcholine(ACh)and choline(Ch)in the medial prefrontal cortex(m PFC)and hippocampus of freely moving rats,which is used to analyze the changes of ACh and Ch in different brain regions through medicine intervention.METHODSThe double-probe synchronous brain microdialysis and high performance liquid chromatography with post column immobilized enzyme reactor electrochemical detection(HPLC-IMER-ECD)were established and used to monitor dynamically ACh and Ch of extracellular fluid in the m PFC and hippocampus of freely moving rats.RESULTSAfter the double-cannula implantation and dialysis sampling in the mPFC and hippocampus,the rat performance was normal.The dual-probe brain microdialysis was feasible and practical.Determination of ACh and Ch by HPLC-IMER-ECD had good linear relationship within the range of 0.02 to 2.00μmo l·L-1.The detection limit was 10 nmo l·L-1for ACh and 5 nmo l·L-1for Ch.Intra-day precision of ACh at three concntrations(0.1,0.4 and 2.0μm o l·L-1)was 0.87%-1.83%,inter-day precision of ACh was 5.38%-6.80%;Intra-day precision of Ch was 1.60%-2.91%,inter-day precision of Ch was 5.56%-7.38%.Relative recovery of ACh was 96.0%-113.0%,and that of Ch was 102.3%-110.2%.NaN3could result in the decrease of ACh(P<0.05)and the increase of Ch(P<0.05,P<0.01)in both the m PFC and hippocampus.Ginsenoside Rg1 reversed the effect induced by NaN3,increased significantly ACh(P<0.05)in the hippocampus,and decreased Ch of the mPFC and hippocampus(P<0.05).ACh and Ch in the m PFC were higher than in the hippocampus,and the impact of NaN3was more sensitive to changes in m PFC.CONCLUSlONDouble-probe and dual-channe l brain microdialysis technique combined with HPLCIMER-ECD can monitor synchronously the dynamic changes of ACh and Ch in the m PFC and hippocampus of conscious rats.Ginsenoside Rg1 can up-regulate the dynamic balance of ACh and Ch in the m PFC and hippocampus while enhancing central cholinergic system functions.
double-p robe brain microdialysis;high performance liquid chromatography;immobilized enzyme reactor;electrochemistry;acetylcholine;choline
WANG Dan-qiao,Tel:(010)64014411-2232,E-mail:dq_wang96@sohu.com;ZHANG Mei-yu,E-mail:meiyu96@126.com,Tel:(010)64014411-2232
R965.2
A
1000-3002(2014)01-0097-10
Foundation item:The project supported by China Academy of Chinese Medicine Sciences(ZZ2010010);China Academy of Chinese Medicine Sciences(ZZ2013007)
2013-10-10 接受日期:2013-12-26)
(本文编辑:齐春会)
中国中医科学院自主选题研究项目(ZZ2010010);中国中医科学院自主选题研究项目(ZZ2013007)
张美玉(1976-),女,博士,副研究员,主要从事中药药理学研究;王丹巧(1959-),女,博士,研究员,博士生导师,主要从事中西医结合老年医学基础研究。
王丹巧,E-mail:dq_wang96@sohu.com,Tel:(010)64014411-2232;张美玉,Tel:(010)64014411-2232,E-mail:meiyu96@126.com
