不同粒径的介孔纳米硅材料皮下给予小鼠的急性毒性
2014-03-23王周华付新录黄芝瑛
席 晨,王周华,付新录,黄芝瑛,
(中山大学药学院1.药物安全评价中心,2.药剂实验室,3.实验动物中心,广东广州 510006)
不同粒径的介孔纳米硅材料皮下给予小鼠的急性毒性
席 晨1,王周华2,付新录3,黄芝瑛1,3
(中山大学药学院1.药物安全评价中心,2.药剂实验室,3.实验动物中心,广东广州 510006)
目的研究介孔纳米硅材料(MSN)经皮下注射对小鼠的急性毒性,分析异常反应与材料粒径的关系,探讨诱发局部刺激及全身毒性的相关机制。方法昆明小鼠一次性sc给予MSN 1000 mg·kg-1的3种不同颗粒(80,200,1000 nm)和粒径约20 nm的二氧化硅纳米粉末(NP)。14 d后取血进行血液学检测,称重并计算心、肝、脾、肺和肾脏器系数,制片并进行病理组织学检查。结果80 nm和1000 nm的MSN和NP会导致小鼠皮下出现肉眼可见的肿块,出现肿块的时间顺序和严重程度为20 nm NP>1000 nm>80 nm。此外,其均会不同程度地诱发小鼠皮下注射部位纤维组织增生和炎症细胞浸润,并引起肝细胞水肿和脾生发中心变大等,血液中白细胞和血小板量均显著性地增加(P<0.05)。200 nm的MSN未导致动物出现皮损,且病理观察和血液学指标的异常程度均低于其他给药组。结论皮下注射不同粒径的MSN会导致小鼠产生刺激性毒性,并且这种毒性与颗粒粒径相关,皮下刺激毒性的严重程度为20 nm NP>1000 nm>80 nm>200 nm。
纳米粒子;硅;粒径;急性毒性实验
DO l:10.3867/j.issn.1000-3002.2014.01.011
近年来,癌症的诊断和治疗的纳米生物技术和纳米医学,已成为最热门的研究领域之一[1-2]。与此同时,纳米材料的安全性及生物相容性信息,特别是其小尺寸效应、表面效应等引起的特殊理化性质和生物活性,也引起人们的关注[3]。新型介孔纳米硅材料(mesoporous silica nanoparticles,MSN),以其独有的介孔结构,与传统纳米材料相比,更具有成为药物传输材料的潜力,用以对抗包括癌症[4]、炎症[5]和糖尿病[6]等在内的多种疾病。MSN应用于药物传输系统时,不但可作为难吸收药物的载体,增加其在体内的利用度和缓、控释的作用[4,7]。氧化硅是一种广泛存在,并被美国FDA视为“公认安全”的物质,可作为食品添加剂使用[8-9]。然而由于其不同的给药方式、剂量、粒径和表面修饰等因素,使其在细胞、小鼠实验上表现出了一定的毒性现象。Hudson等[10]制备了MCM,SBA-15和MCF 3种纳米微粒:①在大鼠皮下注射2~3个月后,体内几乎无介孔纳米硅材料残留,周围组织未见严重损伤。②小鼠ip给予MSN 1.2 g·kg-1,24 h内小鼠均死亡或者极度痛苦需处死,组织学检查仅见炎症反应但未发现腹腔内坏死证据。③MCM-41(240 m g·kg-1)尾静脉注射15 m in内小鼠死亡。Shi等[11]发现在小鼠尾静脉注射不同粒径的MSN后,MSN主要分布在肝和脾中,且对脏器有轻微的影响。鉴于其在不同的粒径范围和给药途径下的生物安全性不同,故需重新评估其生物相容性。本文通过向小鼠皮下注射4种不同粒径的MSN,研究此途径下的急性毒性,以及其与粒径间的关系。
1 材料与方法
1.1 动物
SPF级昆明种小鼠,♀,6周龄,购入时体质量(18.0±2.0)g,由中山大学实验动物中心提供,动物合格证号SCXK(粤)2011-0029。小鼠饲养于中山大学实验动物中心 SPF级动物房,温度为20~25℃,湿度为40%~70%,光照明暗各12 h,换气次数为10~20 h-1。饲料为SPF级鼠灭菌饲料,购自广东省医学实验动物中心,符合GB-14924.3-2010标准。饮水为经121℃(1.0 kg·cm-2),30 m in灭菌自来水,由小鼠经饮水瓶自由吮取。
1.2 受试物与试剂
粒径分别为80,200,1000 nm的MSN,由中山大学药学院药剂实验室提供;NP,平均粒径约为20 nm(德国Wacker公司);羧甲纤维素钠(CMC-Na),生产批号:030716(广州器化医疗设备有限公司);磷酸盐缓冲液(PBS),批号:07B16B30(武汉博士德生物公司)。在无菌环境下配制受试物分散液。受试物称重后,分次加入分散剂中,每次加入后充分涡旋,使其均匀分散,直至完全加入,再次充分涡旋。用封口膜封闭管口,fu ll-power超声2 h,结束后涡旋10 m in,此时分散液呈均匀半透明状,室温放置12 h内稳定。分散液配制前,将受试物置于紫外灯下照射过夜;受试物分散液临用临配。
1.3 仪器
CQF-I-6型超声波清洗器,中国上海音波声电公司;ACT.5diff型血细胞分析仪,美国Beckm an公司;CM1900型冰冻切片机、RM2155型电动轮转切片机、ST5020型全自动染色封片工作站、TP1020型全自动组织脱水机、EG1160型石蜡包埋机、HI1220型烘片机、HI1210型摊片机,德国Leica公司;5804R型台式高速低温离心机,德国Eppendorf公司。
1.4 动物分组处理
依照体质量将小鼠随机分为溶剂对照组、20 nm NP组、MSN 80,200和1000 nm组,每组5只。依照20 m L·kg-1计算每只小鼠所需接受的注射体积;受试物浓度为50 g·L-1,此浓度能够保证4种纳米颗粒的分散液在室温下放置12 h内稳定;溶剂对照组小鼠注射等体积的0.2%CMC-Na的PBS溶液。各组小鼠1次性皮下注射相应分散液,剂量均为1000 m g·kg-1。给药顺序为溶剂对照组、20 nm NP组、MSN 80、200和1000 nm组,给药总时间为25 m in。
1.5 一般情况观察
注射后立即观察动物的反应情况,并持续观察4 h,以后每天上午、下午各观察1次,连续观察14 d。观察内容包括动物体质量变化、饮食、外观、行为、分泌物、排泄物等。记录所有动物的死亡情况、中毒症状及中毒反应的起始时间、严重程度、持续时间、是否可逆等。
1.6 血液学指标检测
实验结束时,对动物进行取血。25%乌拉坦腹腔注射,麻醉剂量为7 m L·kg-1。麻醉后,摘眼球取血,盛放容器中预先放入10μL EDTA-Na 21.5 g·L-1溶液。血液稀释并充分混合均匀后,根据Beckm an公司ACT.5diff型血细胞分析仪及配套试剂测定各组动物的血液生理指标15项,分别为白细胞、中性粒细胞、淋巴细胞、单核细胞、嗜酸性粒细胞、嗜碱性粒细胞、红细胞、血红蛋白、红细胞压积、红细胞平均体积、红细胞平均血红蛋白含量、红细胞平均血红蛋白浓度、血小板计数分布宽度、血小板和血小板平均容积。
1.7 大体解剖与病理检查
观察期结束后,摘眼球取血并对小鼠进行大体解剖,肉眼观察器官有无异常,摘取注射部位的皮下组织、心、肝、脾、肺和肾,对脏器分别称重,计算相应的脏器系数。脏器系数的计算公式为:脏器系数=脏器质量/体质量×100。取实验小鼠的皮下增生组织、以及相同部位的肝、脾和肾组织,以个体小鼠为单位,分别用10%甲醛溶液固定、石蜡包埋、切片、使用苏木精-伊红(HE)对切片染色,光镜下观察各组织的病理现象。
1.8 统计学分析
2 结果
2.1 不同粒径的介孔纳米硅材料对小鼠一般状态的影响
14 d的观察期间发现,20 nm NP和1000 nm组小鼠注射部位均出现了严重的刺激性反应,且20 nm NP组早于1000 nm组。给药后第6天,20 nm NP组小鼠全部出现注射部位红肿、背毛稀疏症状(1000 nm组小鼠于给药后第7~8天出现上述症状);给药后第7天,20 nm NP组小鼠注射部位开始脱毛,进针处溃烂,创面直径约0.7 cm,皮肤内侧有凝胶状物质(1000 nm组小鼠于给药后第9~11天出现上述症状);给药后第9天,20 nm NP组小鼠背部创面开始愈合结痂(1000 nm组小鼠于给药后第12天出现上述症状);给药后第11天,20 nm NP组小鼠背部红肿消失,创面成瘘管状(1000 nm组于给药后14 d出现上述症状);给药后第12天,20 nm NP组小鼠恢复正常,体质量增加(1000 nm组尚未恢复)。
200 nm组中未出现上述症状,80 nm组仅有1只小鼠出现了类似于20 nm NP组的症状。该结果说明不同粒径的纳米材料对皮肤刺激作用并不相同,根据异常现象出现的时间及强度可知,在1000 m g·kg-1注射量下,皮肤刺激作用强弱为20 nm NP>1000 nm>80 nm>200 nm。
同时,每隔1 d给小鼠称重,统计数据后发现,处理组和对照组小鼠间的体质量增长没有统计学差异(数据未显示)。
2.2 不同粒径的介孔纳米材料对小鼠血液学指标的影响
表1和表2结果显示,与溶剂组相比,NP 20 nm NP组PLT明显升高(P<0.01),WBC明显升高(P<0.05);MSN 80,200和1000 nm组PLT明显升高(P<0.05),WBC明显升高(P<0.05,P<0.01),LY降低(P<0.05,P<0.01),MO计数升高(P<0.05,P<0.01)。其他指标与溶剂对照组比较无明显变化。
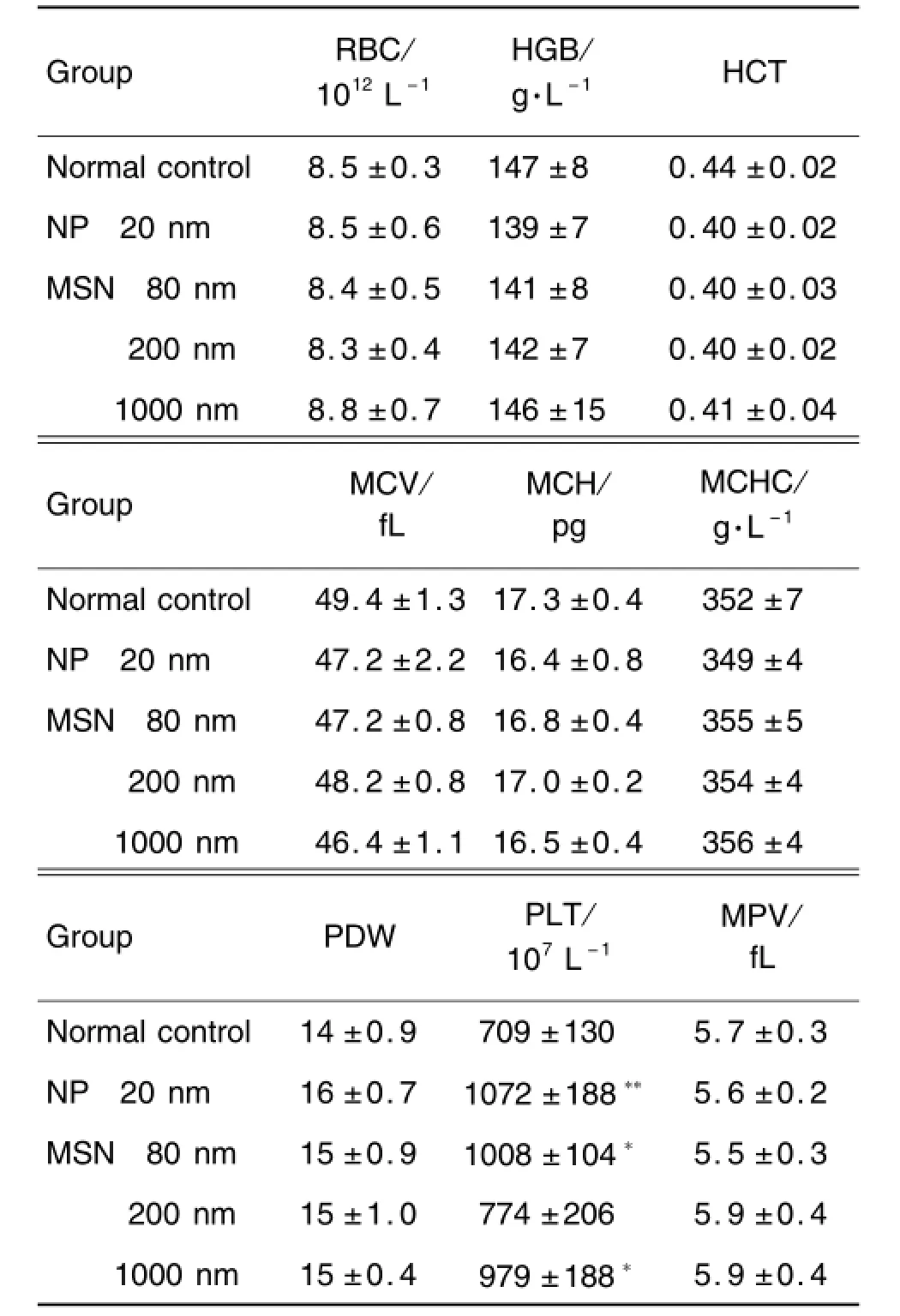
Tab.1 Effect of mesoporous silica nanoparticles(MSN)of different size on red blood cell count and platelet count of mice
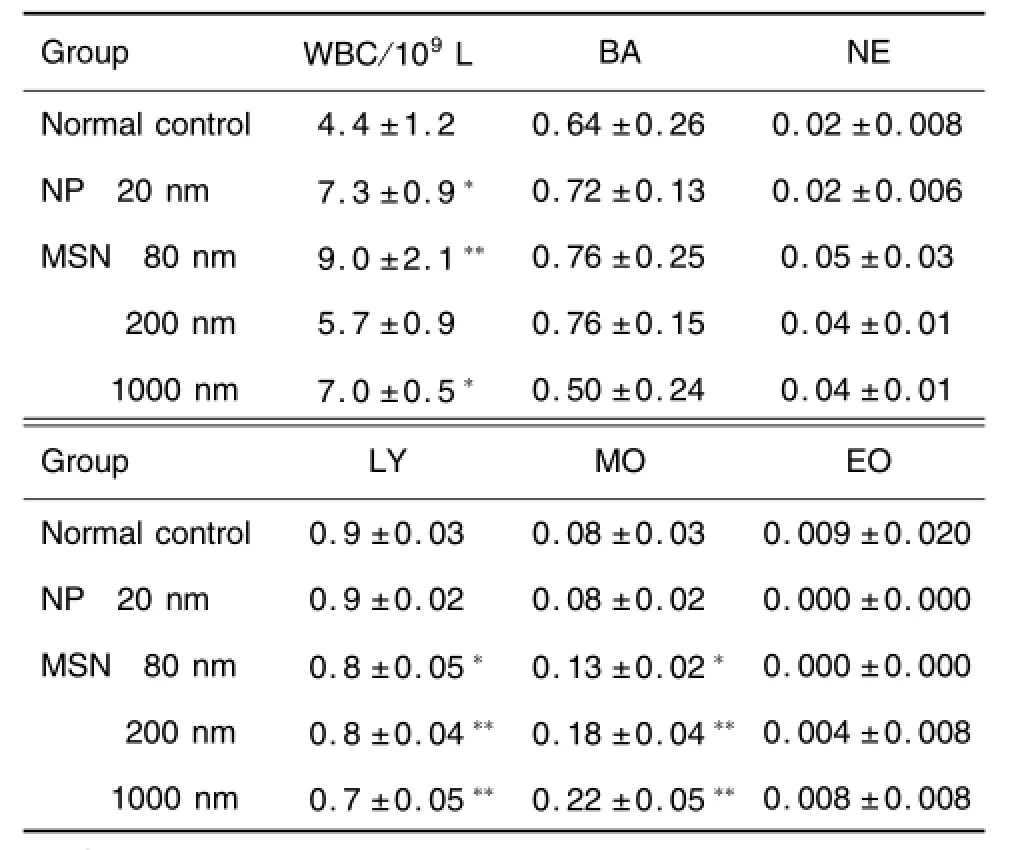
Tab.2 Effect of MSN of different size on white blood cell count and differentiation of mice
2.3 不同粒径的介孔纳米材料对小鼠脏器的影响
小鼠大体解剖发现,背部注射位点出现过隆起(图1A)、溃烂的小鼠,其皮下纤维组织增生严重,呈白色网状物(图1B),个别小鼠的增生组织边缘有出血点;解剖时背部仍有隆肿的小鼠,时可发现其皮下有纤维组织增生,其中包裹大量的颗粒状的白色脓性物质,可能为未吸收的纳米药物与组织分泌的脓液混合;溶剂对照组的小鼠皮下无增生组织。肉眼观察各组小鼠的腹腔和胸腔内脏器时,未发现异常现象。
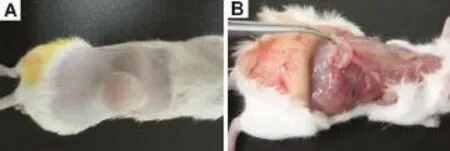
Fig.1 Abnormal gross observation after treatment with MSN.A:the appearance changes after treatment with 1000 nm MSN for about10 d,and the diameter of the tenting part was about 2.5 cm;B:the gross pathology after treatment with 1000 nm MSN,with proliferation of fibrotic tissue and some bleeding spots in the skin.
表3结果显示,20 nm NP组和MSN 1000 nm组的肝、脾系数与正常对照组相比,明显升高具有统计学差异;MSN 80 nm组和200 nm组的脾系数显著升高,具有统计学差异(P<0.05)。
在光镜下观察发现(图2),各组小鼠均出现不同程度的肝细胞水肿,轻者20%~30%;严重者80%~90%(图2A);20 nm NP和1000 nm组的大部分小鼠以及80 nm组的一些小鼠脾生发中心变大,多核巨细胞增生(10%~40%)(图2B);所有受试物处理组小鼠皮下出现脓肿的部位显示有大量炎症细胞浸润,纤维组织增生,局部可见出血灶,腔内有坏死的组织碎片(图2C)。正常对照组的小鼠皮下无增生,镜检的组织切片未发现器质性病变。
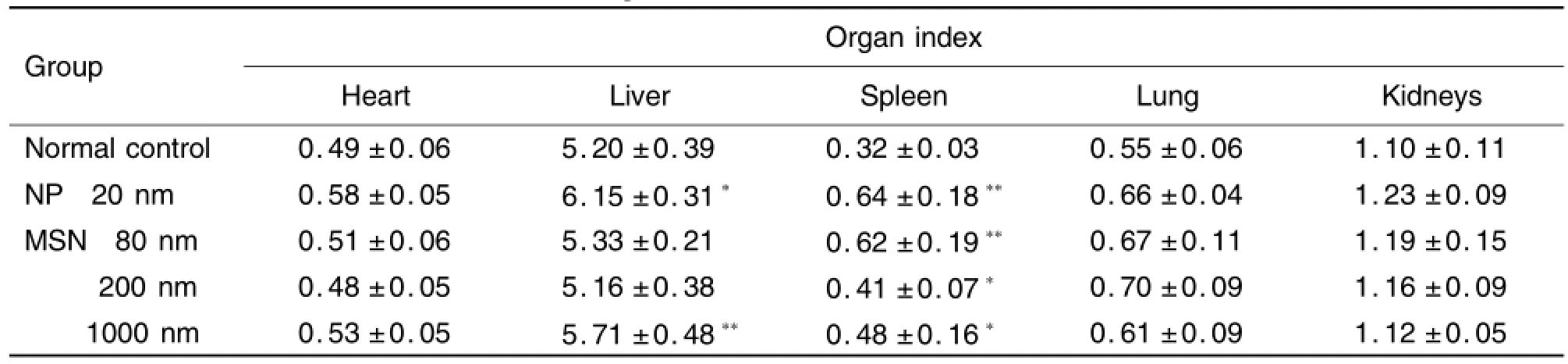
Tab.3 Effect of MSN of different size on organ indexes of mice
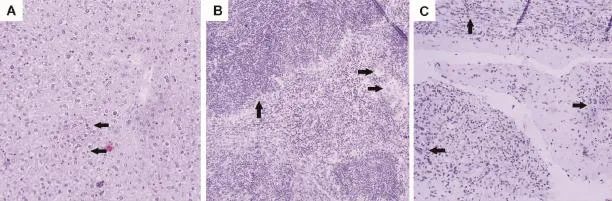
Fig.2 Effect of MSN of different size on liver histopathological changes(HE×100).A:the hepatocyte edema was moderate to severe(arrow-head);B:the germinal center became larger and multinucleated giant cells proliferation(arrow-head);C:the subcutaneous fibrous tissue proliferation was clear,accompanied by neutrophil and lymphocyte infiltration(arrow-head).Besides,there were some deciduous tissue fragments and cell debris in the abscess cavity.
3 讨论
本研究对不同粒径的MSN经皮下注射的毒性进行研究,发现MSN会诱发皮下局部刺激和全身急性毒性,并且其与MSN的粒径相关。
本实验结果显示,尽管不同粒径的MSN经皮下注射所引发的毒性反应类似,但是毒性的强弱与粒径有直接关系:当粒径<80 nm或≥1000 nm时,对皮下组织的刺激性更强,会更迅速地引起皮下肿块的产生,引起的肝水肿和脾生发中心增大的病理情况更加严重;而80和200 nm组在为期2周的观察期内,鲜有表现出肉眼可见的异常反应。结合血液学指标检测和病理检查的结果,做出以下分析:当粒径过小(<80 nm)时,由于其分散性高,侵入性强,产生的刺激性更明显,会导致细胞裂解,诱发巨噬细胞清理细胞碎片,进而诱发更强的炎症反应,从而引起血液学指标异常和肝脾的病变;而当粒径过大(≥1000 nm)时,巨噬细胞无法将其吞噬并清除,其对于注射部位的刺激更直接和持久,也易引起皮下损伤,以及全身性的继发反应。这两种情况下,MSN易蓄积在体内,作为异物反复刺激机体,从而导致小鼠全身产生强烈的炎症反应。然而当纳米颗粒的粒径介于80~200 nm之间时,其不但能够表现出良好的分散性,同时,在引发机体免疫应答时,能够及时被巨噬细胞吞噬并清除,从而未见皮下损伤的现象出现。
本实验过程中未见动物死亡,但各组别出现毒性反应的个体均具有以下症状:注射部位产生严重的炎症反应,肝和脾产生继发性的病理异常,大量肝细胞水肿和脾生发中心变大等。同时血液学检测结果显示,白细胞和中性粒细胞计数明显增加,说明MSN经皮下注射所引发的毒性、及其作用靶器官是类似的,但强弱程度与粒径相关。Lee等[12]通过局部淋巴结实验,检测纳米材料对刺激性皮炎敏化剂二硝基氟苯诱发的免疫应答的作用,结果显示,纳米材料会增强二硝基氟苯诱发的耳厚度增加以及淋巴结细胞增殖的程度。结合本实验所得结果,表明MSN能够通过反复刺激皮肤,引起炎症反应,并继发性地诱发实质器官(肝、脾)变化。
综上所述,MSN经皮下注射产生的急性毒性主要与其疏水性和纳米级粒径的生物活性相关,毒性的主要机制是局部刺激诱发炎症,进而产生全身反应。因此,在实际应用中,可根据需要选择毒性较小的粒径范围,或对MSN进行表面修饰,以达到更好更安全的效果。
[1] Peer D,Karp JM,Hong S,Farokhzad OC,Margalit R,Langer R.Nanocarriers as an emerging platform for cancer therapy[J].Nat Nanotechnol,2007,2(12):751-760.
[2] Wagner V,Dullaart A,Bock AK,Zweck A.The emerging nanomedicine landscape[J].Nat Biotechnol,2006,24(10):1211-1217.
[3] Wang LJ,Ding WJ.Research progress in nanotoxicology[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2007,21(1):77-80.
[4] Lu J,Liong M,LiZ,Zink JI,TamanoiF.Biocompatibility,biodistribution,and drug-delivery efficiency of mesoporous silica nanoparticles for cancer therapy in animals[J].Small,2010,6(16):1794-1805.
[5] Moulari B,Pertuit D,Pellequer Y,Lamprecht A.The targeting of surface modified silica nanoparticles to inflamed tissue in experimental colitis[J].Biomaterials,2008,29(34):4554-4560.
[6] Kim HJ,Matsuda H,Zhou H,Honma I.Ultrasound-triggered smart drug release from a poly(dimethylsiloxane)-mesoporous silica composite[J].Adv Mater,2006,18(23):3083-3088.
[7] Li L,Tang F,Liu H,Liu T,Hao N,Chen D,et al.In vivo delivery of silica nanorattle encapsulated docetaxel for liver cancer therapy with low toxicity and high efficacy[J].ACS Nano,2010,4(11):6874-6882.
[8] Halas NJ.Nanoscience under glass:the versatile chemistry of silica nanostructures[J].ACS Nano,2008,2(2):179-183.
[9] Garcia-Bennett AE.Synthesis,toxicology and potential of ordered mesoporous materials in nanomedicine[J].Nanomedicine(Lond),2011,6(5):867-877.
[10] Hudson SP,Padera RF,Langer R,Kohane DS.The biocompatibility of mesoporous silicates[J].Biomaterials,2008,29(30):4045-4055.
[11] He QJ,Shi JL.Mescoporous silica nanoparticles based mano drug delivery system:syn thesis,drug controlled release and delivery,pharmacokinetics and biocomatibility[J].J Mater Chem,2011,21(16):5845-5855.
[12] Lee S,Yun HS,Kim SH.The comparative effects of mesoporous silica nanoparticles and colloidal silica on inflammation and apoptosis[J].Biomaterials,2011,32(35):9434-9443.
(本文编辑:付良青)
喜 讯
热烈祝贺《中国药理学与毒理学杂志》被中国生物医学文献服务系统(Sinomed)的《中国生物医学文献数据库》(CBM)收录。至此,《中国药理学与毒理学杂志》已被国内所有权威期刊数据库收录。
Acute toxicities of mesoporous silica nanoparticles of different size in mice
XI Chen1,WANG Zhou-hua2,FU Xin-lu3,HUANG Zhi-ying1,3
(1.Center of Preclinical Screening and Evaluation on New Drug,2.Department of Pharmaceutics,3.Laboratory Animal Center,School of Pharmaceutical Sciences,Sun Yat-sen University,Guangzhou 510006,China)
OBJECTlVETo investigate the acute toxicity of mesoporous silica nanoparticles(MSN)by subcutaneous injection in m ice,and to analyze the relationship between abnormal reactions and particle sizes.METHODSA single dose 1000 mg·kg-1of MSN 80,200 and 1000 nm and silica nanoparticles(NP)was injected via sc to Kunming mice.A 14-day observation period was set with the general reactions recorded.At the end of the observation period,the m ice were sacrificed after their blood sample was taken and their heart,liver,spleen,lung,and kidneys were removed.The wet mass and relative m ass of the above organs were calculated before the hemalogical and pathological examination was perform ed.RESULTSNanoparticles of 20 nm NP and MSN of 80 nm and 1000 nm induced visible swelling in mice.Swelling occurred first and was most severe in 20 nm NP group,followed by 1000 nm and 80 nm groups.NP and MSN mentioned above also led to tosubcutaneous fibrous tissue proliferation and inflammatory cell infiltration,and liver cell edema and splenic germinal center became larger.In thehematological examination,the white blood cell and platelet count were significantly increased(P<0.05).In contrast,during the observation period,MSN with 200 nm didn′t cause any skin lesions and pathological observations.The abnomality of hematological indexes were less than in other treated groups.CONCLUSlONMSN of different sizes can induce irritation and inflammation in m ice,and the injury depends on the particle size.The skin acute toxicity is most severe in 20 nm NP groups,followed by 1000,80 and 200 nm groups.
nanoparticles;silica;particle size;acute toxicity tests
HUANG Zhi-ying,E-mail:hzhiying@mail.sysu.edu.cn,Tel:(020)39943092

R99
A
1000-3002(2014)01-0068-06
Foundation item:The project supported by National Key Technology R&D Program in the 11th Five Year Plan of China(2008BAI55B03)
2013-03-22 接受日期:2013-09-10)
“十一五”国家科技支撑计划重点项目(2008BAI55B03)
席 晨(1988-),女,硕士,主要从事药理毒理学研究,E-mail:xichen@mail2.sysu.edu.cn;黄芝瑛(1965-),男,教授,博士生导师,主要从事药物毒理学研究。
黄芝瑛,E-mail:hzhiying@m ail.sysu.edu.cn,Te l:(020)39943092
