逍遥散对慢性应激下拟阿尔茨海默病小鼠行为学和自由基代谢的影响
2014-03-23吴磊彬陈国华李俐娟张忠文吴家顺梅俊华余泽婷
邱 昕 吴磊彬 陈国华 魏 丹 李俐娟 张忠文 吴家顺 梅俊华 杨 洁 姜 静 余泽婷
阿尔茨海默病(Alzheimer's disease,AD)又称 老年性痴呆,是一种病因未明的中枢神经系统退行性病变。该病以记忆力减退、认知功能障碍为特征。长期使用D-gal可使动物同时出现衰老表现和智力低下状态[1,2],本实验以D-gal复制拟AD小鼠模型,并给予慢性束缚应激刺激,观察小鼠行为学的变化以及自由基SOD、MDA含量的变化,分析逍遥散逆转慢性应激刺激下拟AD小鼠代谢障碍的机制,为临床使用该方防治AD提供实验依据。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级6周龄的BALB/c小鼠,40只,雄性,体重(20±3)g,由武汉大学实验动物中心提供,许可证号:SCXK(鄂)2008-0004。动物饲养地由华中科技大学同济医学院动物实验中心提供,所有小鼠在温度(20±2)℃,湿度50%~60%,白昼/黑夜周期为12 h/12 h条件下适应环境5 d后开始实验。实验中除应激期间外均自由饮水及摄食。
1.1.2 药物 逍遥散组成按照《方剂学》所载:柴胡9 g,当归9 g,白芍9 g,白术9 g,茯苓9 g,甘草4.5 g,薄荷少许,生姜一块。将上述中药各水中浸泡2 h,然后用8倍体积的水先武火加热煮沸,再用文火煎煮,待到药液剩1倍体积时将药液装入容器,同法再用4倍体积的水煎煮至1倍体积,倒出药液,再用2倍体积的水煎煮至1倍体积,倒出药液,将三次煎煮的药液合在一起,并过滤,最后用文火将逍遥散浓缩至0.81 g/ml的药液,装瓶后高压灭菌,灭菌后在超净工作台上将药液分装于无菌离心管中,4℃冰箱保存备用,灌胃时每天取1支,避免污染。
1.1.3 试剂及仪器 SOD与MDA测试盒由南京建成生物研究所提供;D-半乳糖由武汉梓杉生物技术有限公司提供;电热恒温水箱购于上海一恒科技有限公司;MK3型酶标仪购于热电(上海)仪器有限公司;紫外可见分光光度计(752-p)购于上海现科仪器有限公司;台式低温高速离心机(MR23i)购于德国HERAUS;电热鼓风干燥箱购于北京永光明医疗仪器厂。
1.2 方法
1.2.1 分组与给药 小鼠适应性饲养5 d后根据体重随机将小鼠分为4组,即空白对照组﹑D-半乳糖组﹑复合模型组﹑逍遥散组,每组各10只,并用苦味酸标记分笼,每笼3~4只。空白对照组按10 ml·kg-1·d-1给予0.9%生理盐水颈背部皮下注射,D-半乳糖组﹑复合模型组﹑逍遥散组均按120 mg/kg颈背部皮下注射D-半乳糖溶液,连续42 d。造模第29 d各组皮下注射完毕后空白对照组、D-半乳糖组和复合模型组按16 ml·kg-1·d-1给予0.9%生理盐水灌胃,逍遥散组给予逍遥散13 g·kg-1·d-1灌胃,连续14 d;每日灌胃以后复合模型组﹑逍遥散组均给予慢性束缚应激刺激,每天6 h,连续14 d。
1.2.2 慢性束缚应激刺激 慢性束缚装置按文献[3]所述,将50 ml离心管管壁不同部位钻出直径3 cm左右的小孔,以防止小鼠窒息。将小鼠头朝向管底放入离心管内后封闭管口,头端稍高于尾端放置,每天6 h,束缚期间禁食﹑禁水,6 h后将小鼠恢复自由。
1.2.3 避暗试验 避暗试验是反映小鼠记忆能力的较好的行为学试验之一,根据记忆形成的特点,当小鼠被反复置于相同环境和接受多次电刺激时,无疑会加强记忆的巩固。采用2个单独反射箱,每个箱为36 cm×12 cm×12 cm。测试开始时使暗室铜栅通电,将小鼠头向明处放入反射箱中,系统记录其5 min内被电击次数,记录潜伏期(小鼠从明室第1次进入暗室的时间)和错误次数(小鼠从明室进入暗室的次数)。参照文献[4],试验分为2 d,第1 d为小鼠适应期,以第2 d的潜伏期和错误次数共同作为记忆成绩。
1.2.4 矿 场 试 验 旷 场 试 验(open-field test,OFT)反映的是小鼠总体的活动性和探知行为,用于评价小鼠的自发活动及情绪行为,用黑色塑料板自制旷场箱,箱底为50 cm×50 cm的底面,高40 cm,测试系统默认将底部分割成3×3相同大小的9区域;在旷场上方置一60 W的台灯,使旷场底部光线均匀;测试开始时将小鼠置于旷场的正中央,同时用软件观测其自发活动5 min,每只小鼠测试结束后用75%酒精清洁旷场,并用软件记录5 min内小鼠在旷场试验中的总路程和中央区域路程。
1.2.5 SOD和MDA含量测定 行为学测试完毕后对各组小鼠进行摘眼球取血,然后按照试剂盒说明书测定SOD和MDA的含量。
1.3 统计学处理 采用SPSS17.0统计软件,计量数据以平均数±标准差(¯x±s)表示,组间比较用单因素方差分析。
2 结 果
2.1 避暗实验
与空白对照组比较,D-半乳糖组小鼠潜伏期缩短,错误次数增多;与D-半乳糖组比较,复合模型组小鼠潜伏期缩短,错误次数增多;与复合模型组比较,逍遥散组小鼠潜伏期延长,错误次数减少(表1)。
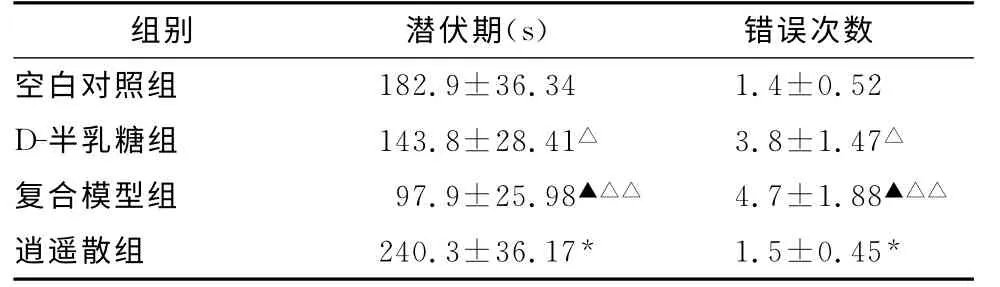
表1 各组小鼠避暗实验的潜伏期和错误次数比较(¯x±s,n=10)
2.2 矿场试验
与空白对照组比较,D-半乳糖组小鼠中央区域路程和总路程均减少,活跃度降低;与D-半乳糖组比较,复合模型组小鼠中央区域路程和总路程均减少,活跃度降低;与复合模型组比较,逍遥散组小鼠中央区域路程和总路程均增加,活跃度增加(表2)。

表2 各组小鼠矿场试验的总路程、中央区域路程和活跃度比较(¯x±s,n=10)
2.3 SOD﹑MDA含量测定
与空白对照组比较,D-半乳糖组小鼠脑组织自由基SOD含量降低,MDA含量升高;与D-半乳糖组比较,复合模型组小鼠脑组织SOD含量降低,MDA含量增加;与复合模型组比较,逍遥散组小鼠脑组织SOD含量升高,MDA含量减少(表3)。

表3 各组小鼠SOD﹑MDA逍遥散含量测定(¯x±s,n=10)
3 讨 论
应激(情志因素)应激是机体受到强烈刺激后出现的一系列神经内分泌免疫反应以及由此引起的各种功能和代谢的改变[5]。积极的情绪是提高人的脑力劳动的效率和耐久力,使人的脏器活动趋于协调一致;对于已处于疾病状态的人体,则可有利于调整自身的内环境,而使相应的疾病趋于减轻,甚至可使之自愈;反之,消极的情绪却可引起人体气机失调,脏器功能失衡,使已发生的疾病加重。D-半乳糖致衰老小鼠模型由我国学者龚国清等提出并在国际上得到认可,该模型小鼠表现出衰老、学习记忆功能障碍、免疫功能低下等一系列自然衰老现象,是模拟AD的良好模型[6]。研究表明,长期心理刺激会导致机体出现正常衰老过程加速、学习记忆障碍,甚至痴呆等多系统疾患[7,8]。祖国医学也认为,慢性应激可通过影响人的心、肾、脑等功能,使机体出现气血流通不畅,脏腑功能紊乱,阴阳失调,加速机体的衰老。
学习、记忆能力的低下是AD的特异性表现。以往的研究发现,正常小鼠的衰老常伴随着自主活动减弱和避暗试验潜伏期缩短[9],本实验结果与此相符。同时本研究也发现在皮下注射D-半乳糖的基础上给予慢性束缚应激刺激,小鼠的活动能力进一步降低,学习记忆功进一步受损,而给予逍遥散后活动能力和学习记忆力好转,表明慢性应激能加重AD症状,逍遥散能改善慢性束缚应激对AD小鼠行为学的影响。现代医学认为AD的发生可能与自由基氧化、神经递质及生化改变、神经生长营养因子缺失等诸多因素有关。超氧化物歧化酶(SOD)是生物机体重要的抗氧化酶,能特异性清除衰老启动因子-超氧化物阴离子自由基,从而减少脂质过氧化反应,防止活性氧的生成和蓄积,使肌体细胞和组织免受损害[10,11],SOD活力高低间接反应了机体清除氧自由基的能力。丙二醛(MDA)是机体非酶系统产生的自由基攻击生物膜中的多不饱和脂肪酸引发脂质过氧化反应的终产物之一[12],脂质过氧化作用通过链式或链式支链反应来放大活性氧的作用,损伤细胞MDA的含量高低可间接反映出机体细胞受自由基攻击的严重程度。本实验结果显示,慢性束缚应激刺激可加速AD小鼠自由基的损伤,而逍遥散干预后可提高体内SOD活性,调动机体自卫,清除氧自由基堆积,降低MDA含量,有效地抑制了自由基过氧化损伤,阻断了未发AD,治疗了已发AD。
综上所述,慢性束缚应激刺激可加重AD症状,而逍遥散能较好地改善慢性应激刺激下拟AD小鼠的行为学异常,并能显著对抗自由基氧化损伤。
1 Novelli G,Reichardt JKV.Molecular basis of disorder of human galactose metabolism:past present and future.Molecular Genetics and Metabolism,2000,71(1-2):62-65.
2 Forcier NJ,Mizisin AP,Rimmer MA,et al.Cellular pathology of the nerve microenvironment in galactose intoxication.J Neuropathol Exp Neurol,1991,50(3):236-255.
3 Yin D,Tuthill D,Mufson RA,et al.Chronic restraint stress promotes lymphocyte apoptosis by modulating CD95 expression.J Exp Med,2000,191(8):1423-1428.
4 张均田,斋藤洋.十二种化学药品破坏小鼠被动回避性行为——跳台实验与避暗实验的作用比较观察.药学学报,1986,21(1):12.
5 Seckl JR.Glucocorticoids,ageing and nerve cell damage.J Neuroendocrinol,2000,12(8):709.
6 龚国清,徐黻本.小鼠衰老模型研究.中国医药大学学报,1991,22(2):101-103.
7 Kudielka BM,Buske KA,Hellhammer DH,et al.HPA axis responses to laboratory psychosocial stress in healthy elderly adults,younger adults,and children:impact of age and gender.Psychoneuroendocrinology,2004,29(1):83-98.
8 Sivapson EE,MeConvilie C,Rae G,et al.Salivary cortisol,stress and mood in healthy older adults:the Zenith study.Biot Psyehol,2008,78(1):l-9.
9 宋 旭,包明敏,李永明.非酶糖基化致衰老的实验研究.中华老年医学杂志,1999,18(3):164-166.
10呼延和.开郁健脾法对脾虚大鼠血清胃泌素、尿D-木糖影响的实验研究.沈阳:辽宁中医药大学硕士论文,2010:19.
11孙琳琳.左归丸对D-半乳糖致亚急性衰老大鼠抗氧化能力影响的实验研究.哈尔滨:黑龙江中医药大学硕士论文,2009.35.
12 Terman A,Brunk UT.Oxidative stress,accumulation of biological garbage,and aging.Antioxid Redox Signal,2006,8(1-2):197-204.
