DNA聚合酶β抑制剂齐墩果酸对帕金森病小鼠模型的保护作用
2014-03-23张振涛王洪财张国新张兆辉
张振涛 王洪财 张国新 胡 丹 熊 婧 张兆辉
帕金森病(Parkinson disease,PD)是一种好发于老年人的神经变性疾病,其主要的病理变化是黑质致密部多巴胺能神经元变性缺失。PD多巴胺能神经元损伤的确切机制尚未阐明,目前认为PD的发病是遗传和环境因素相互作用的结果[1]。1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)是最早发现的与PD相关的环境毒性物质,进入人体或动物体内后转化为其代谢产物1-甲基-4-苯基吡啶(MPP+),特异性损伤黑质致密部多巴胺能神经元,产生类似PD的症状,因此MTPT广泛用作PD动物模型的制作[2]。我们的前期体外研究发现,DNA聚合酶β在MPP+诱导的神经损伤中发挥关键作用[3],因此阻断DNA聚合酶β可能具有神经保护作用。本研究使用MPTP建立小鼠PD模型,观察了DNA聚合酶β抑制剂齐墩果酸对该模型的治疗作用。
1 材料与方法
1.1 主要仪器及试剂
小鼠抗酪氨酸羟化酶(tyrosine hydroxylase,TH)单克隆抗体、齐墩果酸和多巴胺、DOPAC标准品购自Sigma-Aldrich公司,小鼠抗活化的caspase-3抗体购自Cell signaling公司,其余试剂为国产分析纯。Olympus显微镜(日本Nikon),Western blotting系统(美国Bio-rad),HP1100型高效液相色谱系统(美国Aglient)。
1.2 实验动物及模型制作
6月龄健康雄性C57BL/6J小鼠40只,体重16~20 g,由武汉大学医学院实验动物中心提供。将动物随机分为对照组、模型(MPTP)组、齐墩果酸预处理组和齐墩果酸后处理组,每组各10只小鼠。参照文献报道的方法[4],MPTP溶于生理盐水,每24 h腹腔注射1次,每次剂量30 mg/kg,共5次。齐墩果酸预处理组在注射MPTP前5 d开始给药,剂量为50 mg·kg-1·d-1灌胃。齐墩果酸后处理组在造模当天给药,时间为每次MPTP注射后2 h,2组给药时间均持续至最后1次MPTP注射后7 d。对照组给予生理盐水。
1.3 行为学检测
最后1次MPTP注射后第7 d进行行为学评分。扒杆实验方法为在平台上放置一根直径为0.3 cm的水平钢管,钢管高出平台3 cm;实验时将小鼠前爪放在钢丝上,后爪放在平台上,记录小鼠保持该姿势的时间。拖曳实验的方法为提起小鼠的尾巴,只允许双前爪着地,向小鼠后方以恒定的速度(20 cm/s)拖行,观察前爪迈出的步数。
1.4 免疫组织化学染色
小鼠用苯巴比妥深度麻醉后用4%多聚甲醛灌注固定,脑组织石蜡包埋后进行中脑冠状连续切片,二甲苯脱蜡到水,3%过氧化氢去除内源性过氧化物酶,热修复,山羊血清封闭后滴加抗TH单克隆抗体(1:300)4度孵育过夜;经磷酸盐缓冲液清洗后滴加生物素标记的兔抗小鼠IgG,室温孵育10 min后用磷酸盐缓冲液清洗,然后滴加辣根过氧化物酶标记的链霉亲和素,孵育10 min后用磷酸盐缓冲液清洗,最后滴加DAB显色液,苏木素复染,透明,封片,显微镜下观察。每只小鼠随机取3张切片,每张切片随机取3个400倍视野,计数每张切片TH阳性细胞数。
1.5 免疫印迹法
小鼠过深麻醉后取中脑腹侧组织,加细胞裂解液后在冰上裂解、匀浆,取上清液,测定蛋白浓度后聚丙烯酰胺凝胶电泳,电转至硝酸纤维素膜上,然后分别用TH抗体和活化的caspase-3抗体4℃孵育过夜,二抗孵育后显色、曝光。
1.6 纹状体多巴胺水平测定
小鼠断头取脑,迅速分理处双侧纹状体并称重、标记,放入冰冷的0.4 mmol/L高氯酸溶液中匀浆,12 000 r/min离心20 min,取上清液50μl上样,使用高效液相色谱电化学检测器检测多巴胺和DAPAC水平。
1.7 统计学处理
各组数据均用¯x±s表示,采用SPSS软件,采用单因素方差分析(ANOVA)中的SNK-q检验,P<0.05为有显著性差异。
2 结 果
2.1 行为学评分
MPTP注射完成后7 d,小鼠出现行为学异常,表现为扒杆实验维持时间延长,同时拖曳实验步数减少。齐墩果酸预处理组和后处理组运动障碍显著改善,表现为扒杆实验持续时间缩短,拖曳实验步数增加,其中预处理组改善更为明显(P<0.05)(图1)。
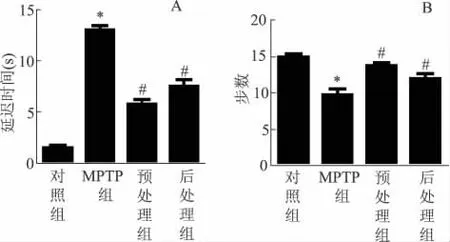
图1 行为学实验 A为扒杆实验;B为拖曳实验。与对照组比较,*P<0.05;与MPTP组比较,#P<0.05
2.2 TH阳性神经元密度测定
对照组小鼠黑质可见大量深染TH阳性神经元,MPTP处理后TH阳性神经元密度显著降低。齐墩果酸预处理组和后处理组TH阳性神经元数量较MPTP组显著增加(P<0.05)(图2)。

图2 TH阳性神经元密度变化 与对照组比较,*P<0.05;与MPTP组比较,#P<0.05
2.3 中脑腹侧TH蛋白和活化的caspase-3表达水平
MPTP处理后TH蛋白水平较对照组明显减低,齐墩果酸预处理组和后处理组TH蛋白水平显著增加。对照组小鼠中脑腹侧组织未发现活化的caspase-3,MPTP处 理 后 出 现 活 化 的caspase-3表达,齐墩果酸预处理和后处理降低了活化的caspase-3的表达水平(图3)。
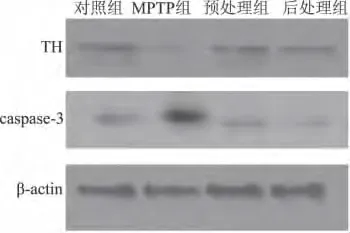
图3 中脑腹侧TH蛋白和活化的caspase-3表达水平
2.4 纹状体多巴胺水平检测
与对照组比较,MPTP处理后纹状体内多巴胺及其代谢产物DOPAC水平显著下降(P<0.01),给予齐墩果酸后纹状体多巴胺及其代谢产物DOPAC水平较MPTP组显著增加(P<0.01)(表1)。

表1 小鼠纹状体多巴胺和DOPAC的水平(¯x±s,μg/g湿重脑组织)
3 讨 论
尽管目前PD的病因和发病机制尚未明确,但已发现某些因素在多巴胺能神经元损伤中发挥重要的作用,如氧化应激、线粒体功能障碍、蛋白异常折叠和聚集等[5]。遗传和环境因素会促进PD相关的病理生理机制,导致PD的发生。MPTP进入体内后转变为其活性代谢产物MPP+,MPP+被转运入多巴胺能神经元内,损伤线粒体复合物 的功能,并促进氧化应激,最终导致多巴胺能神经元损伤。MPTP处理小鼠是国际上通用的PD模型,也是研究PD发病机制和探索新的治疗手段的重要工具[4]。
既往研究发现,MPP+处理的神经元内DNA聚合酶β表达升高,而阻断DNA聚合酶的功能能够抑制MPP+诱导的神经损伤,该结果提示DNA聚合酶β在多巴胺能神经元损伤中起到关键作用[3]。正常状态下可分裂细胞的DNA复制是由DNA聚合酶δ和DNA聚合酶ε完成的,但神经元是不可分裂细胞,一旦启动DNA复制机制,就会诱导神经元损伤。有研究发现神经元的DNA复制是由DNA聚合酶β介导的,这与可分裂细胞完全不同[3]。DNA聚合酶β的正常功能为介导DNA损伤修复,但在神经元中DNA聚合酶β介导DNA复制,其保真度低,产生较多的核酸错配,最终导致基因组不稳定和神经元损伤[6,7]。根据以上前期研究的结果,本研究提出了如下假说:如果能阻断DNA聚合酶β的功能,可能对PD模型具有保护作用。为了验证这个假说,本研究使用MPTP制作小鼠PD模型,初步探讨了DNA聚合酶β抑制剂齐墩果酸的治疗作用,发现齐墩果酸能够改善PD模型小鼠行为学评分,阻断多巴胺能神经元损伤和纹状体多巴胺的缺失。
齐墩果酸是一种自然界广泛存在的三萜类化合物,广泛存在于食物和药用植物如水蒲桃、大蒜等。既往研究发现其具有保护肝脏、抗肿瘤和抗病毒等特性[8]。随后人们发现齐墩果酸是一种DNA聚合酶β抑制剂,在25μmol/L的浓度下具有较强的抗DNA聚合酶β功能。另外,齐墩果酸在100μmol/L的浓度下无明显细胞毒性作用[9]。既往研究发现多发性硬化动物模型中齐墩果酸能够减轻炎症反应,减缓神经损伤[10]。齐墩果酸的这些药理特性提示它是一种极有前途的药物。
PD运动障碍的典型表现为静止性震颤、强直、运动迟缓和姿势步态障碍。MPTP处理后小鼠出现扒杆实验持续时间延长,拖曳实验步数减少,符合PD的临床特点,这与我们以前的报道一致[11]。齐墩果酸处理后小鼠运动功能障碍改善,理论上存在两种可能的机制:一种是齐墩果酸直接保护多巴胺能神经元,另一种是齐墩果酸可通过激活多巴胺受体或受体后信号通路,从而改善运动功能评分。为了明确哪一种机制起主要作用,本研究观察了齐墩果酸对多巴胺能神经元存活和纹状体多巴胺及其代谢产物水平的影响,发现齐墩果酸直接保护多巴胺能神经元,这可能是其发挥作用的主要机制。
综上所述,本研究发现齐墩果酸可部分拮抗MPTP诱导的多巴胺能神经元损伤,其发挥作用的机制可能是通过抑制DNA聚合酶β介导的病理性DNA复制。另外,齐墩果酸还具有其他的生物学活性,如抑制炎症反应等[12],这些作用也可能参与了其对多巴胺能神经元的保护作用。如果能在临床上证实其对PD的疗效,将为PD等神经变性疾病提供新的疗法。
1 Schapira AH,Jenner P.Etiology and pathogenesis of Parkinson's disease.Movt Disord,2011,26(6):1049-1055.
2 Adlard P,Finkelstein D,Doble P,et al.Metallobiology of 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine neurotoxicity.Metallomics,2013,5(2):91-109.
3 Zhang Z,Cao X,Xiong N,et al.DNA polymerase-βis required for 1-methyl-4-phenylpyridinium-induced apoptotic death in neurons.Apoptosis,2010,15(1):105-115.
4 Jackson-Lewis V,Przedborski S.Protocol for the MPTP mouse model of Parkinson's disease.Nat Protoc,2007,2(1):141-151.
5 Dauer W,Przedborski S.Parkinson's disease:mechanisms and models.Neuron,2003,39(6):889-909.
6 Copani A,Caraci F,Hoozemans JJ,et al.The nature of the cell cycle in neurons:focus on a"non-canonical"pathway of DNA replication causally related to death.Biochim Biophys Acta,2007,1772(4):409-412.
7 An CL,Chen D,Makridakis NM.Systematic biochemical analysis of somatic missense mutations in DNA polymeraseβfound in prostate cancer reveal alteration of enzymatic function.Hum Mutat,2011,32(4):415-423.
8 Liu J.Pharmacology of oleanolic acid and ursolic acid.J Ethnopharmacol,1995,49(2):57-68.
9 Gao Z,Maloney DJ,Dedkova LM,et al.Inhibitors of DNA polymeraseβ:Activity and mechanism.Med Chem,2008,16(8):4331-4340.
10 Martín R,Carvalho-Tavares J,Hernández M,et al.Beneficial actions of oleanolic acid in an experimental model of multiple sclerosis:apotential therapeutic role.Biochem Pharmacol,2010,79(2):198-208.
11 Zhang ZT,Cao XB,Xiong N,et al.Morin exerts neuroprotective actions in Parkinson disease models in vitro and in vivo.Acta Pharmacol Sin,2010,31(8):900-906.
12 Córdova C,Gutiérrez B,Martínez-García C,et al.Oleanolic Acid Controls Allergic and Inflammatory Responses in Experimental Allergic Conjunctivitis.PLoS ONE,2014,9(4):e91282.
