大鼠脊髓少突胶质前体细胞的培养与鉴定方法
2014-03-23李彩红喻志源
李彩红 张 婷 陈 雪 王 伟 骆 翔 喻志源
随着现代化进程,交通及建筑事业的迅速发展,脊髓损伤(spinal cord injury,SCI)的发病率急剧上升。SCI导致原发性机械损伤和损伤区缺血缺氧导致的继发性级联损伤[1,2],其中缺血缺氧使少突胶质细胞(oligodendrocytes,OLs)大量死亡,引发广泛的脱髓鞘病变,造成不可逆性的神经功能缺损。成熟的少突胶质细胞自身不能修复,其再生依赖于少突胶质前体细胞(oligodendrocyte progenitor cells,OPCs)的增殖分化[3]。OPCs是处于分化早期的未成熟细胞,既能定向分化为成熟的OLs,又具有一定的增殖与迁移能力。因此,优化脊髓OPCS的分离纯化方法,建立其体外培养分化模型,对进一步研究脊髓损伤后髓鞘修复、轴突再生机制具有重要作用。
本实验采用改良的振摇法(shaking Method)从SD大鼠乳鼠脊髓中获得OPCs并诱导分化,观察其体外生长、标志物表达及定向分化能力,为进一步研究治疗SCI等神经系统脱髓鞘疾病提供可能。
1 材料与方法
1.1 材料与试剂
多聚赖氨酸、胰蛋白酶、DAPI购自美国sigma公司;胎牛血清、N2 supplement(100×)、B27 supplement(50×)购自美国GIBCO公司;DMEM/F12培养基、DMEM/HIGH GLUCOSE培养基购自美国Hyclone公 司;Rat-FGF-Basic、Human PDGFAA、Rat-CNTF购自Peorotech公司;T3购自invitrogen公司;Triton-X100购自武汉博士德生物工程有限公司;小鼠抗大鼠O4抗体、兔抗大鼠NG2抗体、兔抗大鼠MBP抗体、小鼠抗大鼠MBP抗体、小鼠抗大鼠A2B5抗体购自美国Millipore公司;Cy3标记的羊抗兔IgG、FITC标记的羊抗小鼠IgG购自美国Jackson实验室;实验动物为SPF级出生3d内SD大鼠乳鼠,由华中科技大学同济医学院动物房提供。
1.2 SD大鼠乳鼠脊髓混合胶质细胞的原代培养
实验前取4℃预冷D-hank’s液于10 cm培养皿中,将培养皿置于冰上;将3 d内新生的SD大鼠乳鼠浸泡在75%乙醇中消毒5 min后,用眼科剪和眼科镊取出脊髓,在D-hank’s液中充分漂洗;在超净工作台仔细剔除脊膜后,用眼科剪剪成小块;组织块在0.125%胰酶中37℃消化15 min;终止消化,用无菌巴氏管吹打分散成细胞悬液,经直径70μm的筛网过滤;细胞悬液在低温(4℃)离心机中离心(800 r/min×8 min),弃上清,细胞沉淀用含20%胎牛血清的DMEM/F12培养基重悬,制成密度为106/ml的细胞悬液,接种于多聚赖氨酸(0.1 mg/ml)预包被的T75细胞培养瓶中;于37℃、5%CO2培养箱进行培养,第3 d更换为含20%胎牛血清的DMEM/HIGH GLUCOSE培养基,以后每4 d换液一次;直至原代培养的混合胶质细胞长满(约10 d)。
1.3 振摇并差速贴壁法获得纯化少突胶质前体细胞(OPCs)
原代培养的混合胶质细胞长满后拧紧瓶盖,用封口胶封口后置37℃恒温摇床振摇180 r/min,预摇1 h,弃上清,更换培养基,以去除小胶质细胞;继续37℃恒温摇床振摇180 r/min,振摇过夜,约18 h;取摇床振摇过夜细胞上清于为包被的100 mm培养皿中,置于37℃5%CO2培养箱中贴壁40 min,去除多余的小胶质细胞和星形胶质细胞;取培养皿中上清于离心管中在低温(4℃)离心机中离心(800 r/min×8 min),弃去上清,细胞沉淀用OPCs培养基(DMEM/F12,含1×N2,1×B27,10 ng/ml PDGF-AA,10 ng/ml FGF-Basic)重悬,制成密度为106/ml的细胞悬液,细胞接种于铺有盖玻片(多聚赖氨酸预包被)的24孔板中;OPCs接种后隔天换液,接种后3 d收细胞或者更换为分化培养基(DMEM/F12,含1×N2,1×B27,10 ng/ml CNTF,30 ng/ml T3)诱导分化3 d。
1.4 细胞免疫荧光化学染色
取待固定细胞爬片PBS漂洗5 min×3次;用4℃冰箱预冷的4%多聚甲醛室温固定30 min;倾去固定液,PBS漂洗5 min×3次;0.2%Triton/PBS液室温透膜15 min;PBS漂洗5 min×3次;加封闭液(10%BSA-PBS),室温封闭60 min;加预先用抗体稀释液(5%BSA-PBS)按比例稀释的一抗,4℃冰箱中孵育过夜;PBS漂洗5 min×3次,加入按1∶200稀释的二抗(CY3-抗兔,FITC-抗鼠),室温避光孵育60 min;加DAPI工作液(用PBS稀释),室温染色8 min;PBS漂洗5 min×3次;50%甘油封片,于荧光显微镜下观察并照相。各一抗工作浓度为:小鼠抗大鼠A2B5抗体1∶200;兔抗大鼠NG2抗体1∶100;兔抗大鼠MBP抗体1∶200;小鼠抗大鼠O4抗体1∶200;用PBS替代一抗作为免疫细胞化学染色的阴性对照。
2 结 果
2.1 脊髓少突胶质前体细胞的体外培养
原代混合胶质细胞培养至4~5 d后出现分层现象,底层为细胞胞体较大,折光性弱的星形胶质细胞,星形胶质细胞上层贴附少许折光性较强、胞体小的小胶质细胞和OPCs,培养至7 d以后分层更加明显,底层星形胶质细胞融汇成片,上边贴附的小胶质细胞和OPCs明显增多(图1A)。经过振摇并差速贴壁法纯化的OPCs贴壁生长,在OPCs培养基中能分裂增殖,培养3 d的OPCs呈椭圆形、梭形或三角形,大多具有双极性突起,部分为三个突起或者多个突起(图1B)。
2.2 脊髓少突胶质前体细胞的鉴定
少突胶质前体细胞在分化发育为成熟的少突胶质细胞过程中经历多个阶段,每阶段表达标志物不同,在OPCs阶段表达A2B5和NG2等标志物。将OPCs进行免疫荧光组化鉴定显示,95%以上的细胞表达OPCs特异性抗原NG2和A2B5(图2)。
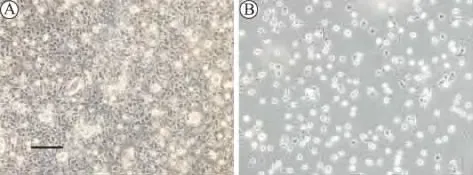
图1 倒置显微镜下细胞形态(200×倍) (A)脊髓混合胶质细胞;(B)纯化后3 d的少突胶质前体细胞

图2 脊髓少突胶质前体细胞的免疫组化鉴定(400×倍) (A)红色为NG2阳性细胞;(B)绿色为A2B5阳性细胞;(C)蓝色为DAPI染色的细胞核;(D)为NG2、A2B5和DAPI三标
2.3 脊髓OPCs诱导分化为少突胶质细胞的鉴定
用分化培养基替换原来的OPCs培养基诱导分化后3 d,OPCs失去了原有的形态特征,伸展出多个细长次级突起,且相互交联成网,免疫荧光组化染色(图3)显示,经诱导分化的细胞逐渐表达成熟前期或成熟的特异性蛋白O4和MBP。
3 讨 论
少突胶质前体细胞(Oligodendrocyte Precursor Cells,OPCs)是上世纪80年代初发现的神经胶质细胞[4],在成年CNS中占据所有胶质细胞数目的5%~8%。它在鼠类胚胎期E14.5 d出现,出生后分布均匀,并在成熟CNS中持续存在[5]。研究发现体外移植OPCs后其迅速迁移并增加成熟少突胶质细胞数量,同时形成髓鞘包绕轴突[6]。因此,建立完善的OPCs体外培养方法对于脱髓鞘性疾病的治疗与研究具有重要作用。

图3 脊髓少突胶质前体细胞诱导分化为少突胶质细胞的鉴定(400×) (A)红色为MBP阳性细胞;(B)绿色为O4阳性细胞;(C)蓝色为DAPI染色的细胞核;(D)为MBP、O4和DAPI三标
目前文献已报道多种获取纯化的OPCs的方法,包括振摇法(shaking Method)[7~9]、免疫抗体包被 筛 选 法(immunopanning)[10~13]、切 片 培 养 法(Slice culture)[14]、神经球诱导分化[15]等方法。我们比较了几种方法后发现,免疫抗体包被筛选法(immunopanning)需要将细胞悬液放在包被有A2B5抗体的培养皿中室温1 h,经过免疫抗体包被筛选出表达A2B5抗原细胞,然后用cell lifter收集细胞,虽然获得细胞纯度较高,但耗费抗体多,实验成本比较大;切片培养法(Slice culture)需要用特定振荡切片机将组织切片后培养,对仪器及技术要求高,操作过程比较繁琐;神经球诱导分化时易出现星形胶质细胞、神经元等杂细胞。以上方法在实验过程中或难以长期大量培养,或难以控制细胞纯度。
本实验采用改良的振摇法(shaking Method)避免耗费昂贵的材料及繁琐操作,采用简便易行的摇床振摇技术从SD大鼠乳鼠脊髓中更为轻松地分离纯化获得纯度较高的OPCs。分离培养成功需注意的事项有以下几个方面:(1)采集组织过程在冰上操作,保持了细胞的活性;(2)用胰酶消化细胞的时间限定为15 min,时间不能太长或太短,如果太长时间会导致细胞死亡,如果太短时间,细胞消化不充分;(3)振摇是根据细胞贴壁牢固程度来纯化细胞,各细胞贴壁牢固程度为小胶质细胞<少突胶质前体细胞<星形胶质细胞,预摇1 h首先将小胶质细胞去除,振摇过夜后OPCs从混合胶质细胞层摇下,与星形胶质细胞分离;(4)振摇时需要密封培养瓶,此时缺氧环境更有利于OPCs从混合胶质细胞层上分离出来;(5)摇床振摇转速为180 r/min,振摇过夜(18 h),时间不要过长以免影响细胞活性;(6)差速贴壁法根据细胞的贴壁时间来纯化OPCs,贴壁时间长短为小胶质细胞<星形胶质细胞<少突胶质前体细胞,在贴壁40 min内小胶质细胞和星形胶质细胞贴壁,而OPCs尚存在于培养基中悬浮,最后进一步纯化OPCs。
本研究纯化培养的细胞从形态上观察为典型的少突胶质前体细胞系,免疫荧光染色显示其表达OPCs的特异性标志物,细胞纯化率达95%以上,并能够诱导分化为成熟的少突胶质细胞。本培养方法的建立为大鼠脊髓少突胶质前体细胞和少突胶质细胞的基础研究提供了良好的研究工具。
1 Tator CH,Fehlings MG.Review of the secondary injury theory of acute spinal cord trauma with emphasis on vascular mechanisms.J.Neuro Surg,1991,75:15-26.
2 Emanuela Esposito,Salvatore Cuzzocrea.Anti-TNF therapy in the injured spinal cord.Cell Press,2011,32(2):107-115.
3 Florencia L,Susana G,Analia L,et al.Progesterone attenuates astro-and microgliosis and enhances oligodendrocyte differentiation following spinal cord injury.Exp Neurol,2011,231(1):135-146.
4 McCarthy KD,de Vellis J.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue.J Cell Bio,1980,85:890-902.
5 Andrew MT,Weibing Zh,Joel ML,et al.NG2:a component of the glial scar that inhibits axon growth.J Anat,2005,207:717-725.
6 Vitry S,Avellana-Adalid V,Lachapelle F,et al.Migration and multipotentiality of PSA-NCAM+neural precursors transplanted in the developing brain.Mol Cell Neurosci,2001,17:983-1000.
7 Ying Ch,Veerakumar B,Jie P,et al.Isolation and culture of rat and mouse oligodendrocyte precursor cells.NATURE PROTOCOLS,2007,2(5):1044-1051.
8 McCarthy KD,de Vellis.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue.Cell Biol,1980,85:890-902.
9 Szuchet S,Yim SH.Characterization of a subset of oligodendrocytes separated on the basis of selective adherence properties.Neurosci Res,1984,11:131-144.
10 Jianguo H,Lingxiao D,Xiaofei W,et al.Effects of extracellular matrix molecules on the growth properties of oligodendrocyte progenitor cells in vitro.Journal of Neuroscience Research,2009,87:2854-2862.
11 Mayer-Proschel M,Kalyani AJ,Mujtaba T,et al,Isolation of lineage-restricted neuronal precursors from multipotent neuroepithelial stem cell.Neuron,1997,19:773-785.
12 Mujtaba T,Piper DR,Kalyani A,et al,Lineage-restricted neural precursors can be isolated from both the mouse neural tube and cultured ES cells.Dev Biol,1999,214:113-127.
13 Cao Q,Xu XM,Devries WH,et al,Functional recovery in traumatic spinal cord injury after transplantation of multineurotrophin-expressing glial-restricted precursor cells.Neurosci,2005,25:6947-6957.
14 Hui-Hsin T,Robert HM,Distinct modes of migration position oligodendrocyte precursors for localized cell division in the developing spinal cord.J Neurosci Res,2009,87(15):3320-3330.
15 Zhang SC,Lipsitz D,Duncan ID,Serf-renewing canine oligedendroglial progenitor expanded as oligospheres.J Neumsci Res,1998,54:181-190.
