TaqMan探针法荧光定量PCR检测鲜切甜瓜中单核细胞增多性李斯特菌的研究
2014-03-23,,*,,
,,*,,
(1. 大连工业大学食品学院,辽宁大连 116034; 2. 大连民族学院生命科学学院,辽宁大连 116600; 3. 大连理工大学生命科学与技术学院,辽宁大连 116024)
单核细胞增多性李斯特菌(Listeriamonocytogenes)是一种能引起人畜共患的食源性致病菌,多通过食品经口感染,该菌已被列为二十世纪90年代四大食品致病菌之一,成为许多国家食品卫生的必检项目,其可诱发食物中毒,导致李斯特菌病,主要引起人类脑膜炎、败血症等,发病率虽低,致死率却高达30%。鲜切果蔬作为即食性食品,易受微生物污染,而目前国内关于此方面研究鲜有报道,但近年常有单核细胞增多性李斯特菌污染果蔬类食品而导致人体患病的现象。因此,本研究以此为切入点,选取鲜切甜瓜为材料,进行了荧光定量PCR快速检测单核细胞增多性李斯特菌的初步研究。本研究根据单核细胞增多性李斯特菌的hly基因序列所设计的简并引物和探针特异性良好,可检测多种不同来源的单核细胞增多性李斯特菌,灵敏度较高,为鲜活农产品的质量与安全控制研究提供技术支持。
1 材料与方法
1. 1 材料与仪器
单核细胞增多性李斯特菌(ATCC 19111、ATCC 19112、ATCC 19115、ATCC 15313)、英诺克李斯特氏菌ATCC 33090、格氏李斯特氏菌ATCC 25401、伊氏李斯特氏菌ATCC 19119、威氏李斯特氏菌ATCC 35897、斯氏李斯特氏菌ATCC 35967 中国工业微生物菌种保藏管理中心;单核细胞增多性李斯特菌GIM 1. 229 北京北纳创联生物技术研究院;大肠埃希氏菌O157∶ H7 NCTC 12900、大肠埃希氏菌ATCC 8739、金黄色葡萄球菌ATCC 6538、乙型副伤寒沙门氏菌CMCC(B)50094、伤寒沙门氏菌CMCC(B)50071、鼠伤寒沙门氏菌ATCC 14028、痢疾志贺氏菌CMCC(B)51105、藤黄微球菌CMCC(B)28001、蜡样芽孢杆菌CMCC(B)63301、奇异变形杆菌CMCC(B)49005 中国微生物菌种网;核酸纯化试剂盒、pMD18 - T Vector、DH5α感受态细胞、小量质粒提取试剂、Premix Ex TaqTM(Probe qPCR) 宝生物工程(大连)有限公司;磁珠法细菌DNA提取试剂盒 北京普华仕科技发展有限公司。
实验材料为附近超市中鲜切的伊丽莎白瓜。
Thermo Scientific PikoReal 实时PCR仪、Thermo Scientific Arktik 热循环仪 Thermo公司。
1. 2 引物及探针的设计
根据从NCBI中下载的多条单核细胞增多性李斯特菌hly基因序列,用Primer5. 0进行引物和探针设计,且找出简并碱基,预计扩增产物长度为180bp,由宝生物工程(大连)有限公司合成引物和探针。简并引物上游:5′ - GGATGAARTAAATTATGATCC - 3′;下游:5′ - ATCAATTACCGTTCTCCAC - 3′;探针:5′ -(FAM)GCACTGGTTTAGCTTGGGAATGG(Eclipse) - 3′。
1. 3 细菌DNA的提取
取1mL 37℃过夜培养的单核细胞增多性李斯特菌菌液,12000r/min离心2min,菌沉淀按照磁珠法细菌DNA提取试剂盒的操作说明提取基因组。通过紫外分光光度计测定OD260、OD280值后确定提取DNA的浓度及纯度,根据测得的OD260值换算成DNA浓度,根据OD260/OD280确定DNA纯度,一般认为比值在1. 8 ~ 2. 0之间适宜。
1. 4 质粒标准品的构建
以提取的单核细胞增多性李斯特菌基因组DNA为模板,用简并引物对其进行PCR扩增,切胶回收、纯化扩增产物,扩增产物与载体pMD18 - T连接后转化至大肠杆菌DH5α感受态细胞中,涂板筛选,疑似阳性的菌落进行培养后,抽提质粒,进行PCR扩增,鉴定为阳性重组质粒的送往宝生物工程(大连)有限公司进行测序。用紫外分光光度法进行纯度和浓度的分析后,10倍倍比梯度稀释作为标准品。
1. 5 荧光定量PCR反应体系和反应条件
本实验所采用的反应体系为20μL:Premix Ex TaqTM(Probe qPCR)10μL,上游引物(10μmol/L)0. 8μL,下游引物(10μmol/L)0. 8μL,探针1μL,模板2. 0μL,无菌水5. 4μL。反应条件为:95℃,30s预变性;95℃,30s;60℃,30s;扩增40个循环。
1. 6 引物的特异性验证
根据1. 4提取5株单核细胞增多性李斯特菌和15株非单核细胞增多性李斯特菌基因组,以其作为模板,且设无菌水为阴性对照,按照1. 5进行荧光定量PCR扩增,验证引物特异性。
1. 7 标准曲线的建立及灵敏度的确定
方法1. 4制备的质粒标准品浓度为1. 12×109~1. 12copies/μL,作为模板,按照1. 5进行荧光定量PCR扩增,以模板的拷贝数为横坐标,以其对应的循环阈值(Cq值)为纵坐标,建立标准曲线,并确定灵敏度。
1. 8 染菌鲜切甜瓜最低检出限的确定
将单核细胞增多性李斯特菌接种于5mL TSBYE培养基中,37℃过夜培养,取1mL菌液喷于称取的25g鲜切甜瓜上,加入225mL TSBYE,37℃增菌过夜。用均质器拍打后,取均质液,用1%的蛋白胨水进行10倍倍比稀释。取各稀释度的菌液涂平板,37℃培养24h后进行菌落计数。同时再取上述各稀释度的菌液1mL,12000r/min离心2min,菌沉淀按照1. 3提取基因组DNA,然后按照1. 5进行荧光定量PCR扩增。
2 结果与分析
2. 1 重组质粒的鉴定
重组质粒通过PCR和酶切鉴定后,将阳性重组质粒送往宝生物工程(大连)有限公司测序后,与NCBI网站上进行在线BLAST比对分析,结果表明扩增产物与单核细胞增多性李斯特菌的hly基因相应区域99%同源。
2. 2 荧光定量PCR特异性检测
用建立的荧光定量PCR方法检测5株单核细胞增多性李斯特菌和15株非单核细胞增多性李斯特菌菌株,结果见图1。由图1可知,5株单核细胞增多性李斯特菌均有扩增曲线生成,结果为阳性,且循环阈值均小于30,其它15株非单核细胞增多性李斯特菌菌株及阴性对照无菌水的检测结果为阴性,表明建立的荧光定量PCR方法特异性良好。

图1 特异性扩增曲线Fig. 1 Primary curve of specificity注:1:单核细胞增多性李斯特菌ATCC 19111;2:单核细胞增多性李斯特菌ATCC 15313;3:单核细胞增多性李斯特菌ATCC 19115;4:单核细胞增多性李斯特菌ATCC 19112;5:单核细胞增多性李斯特菌GIM 1. 229。
2. 3 标准曲线的建立及灵敏度的确定
以质粒标准品作为模板,进行荧光定量PCR扩增,获得荧光定量PCR扩增曲线,见图2。根据得到扩增曲线,以各质粒标准品拷贝数的对数为横坐标,以其对应的Cq值为纵坐标,建立标准曲线,见图3。由图3可知,Cq值和各质粒标准品拷贝数的对数具有良好的线性关系,标准曲线相关系数为R2=0. 9912,线性方程为:y= - 4. 313x+52. 182。

图2 质粒标准品扩增曲线Fig. 2 Primary curve of plasmid standards注:1:质粒标准品浓度为1. 12×109copies/μL;2:质粒标准品浓度为1. 12×108copies/μL;3:质粒标准品浓度为1. 12×107copies/μL;4:质粒标准品浓度为1. 12×106copies/μL;5:质粒标准品浓度为1. 12×105copies/μL;6:质粒标准品浓度为1. 12×104copies/μL;7:质粒标准品浓度为1. 12×103copies/μL;8:质粒标准品浓度为1. 12×102copies/μL。
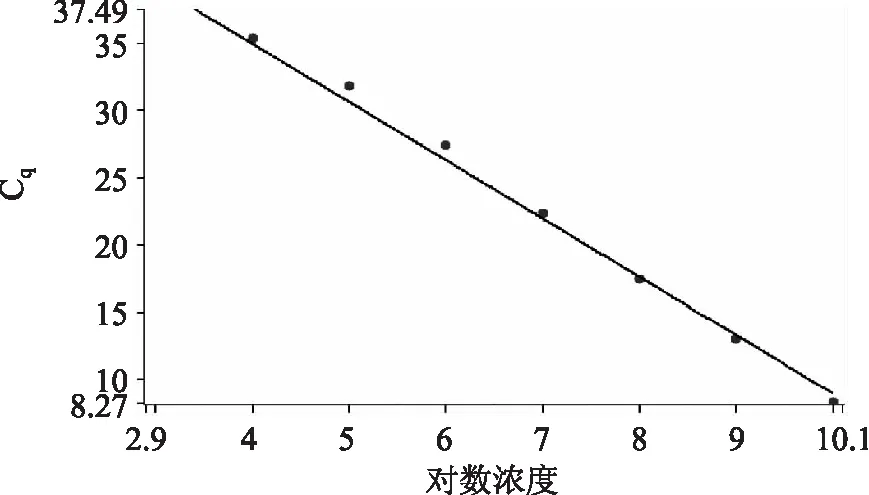
图3 标准曲线Fig. 3 Standard curve
由图2可以得出,当质粒标准品的浓度为1. 12×102copies/μL时,仍有扩增曲线出现,表明该方法的单核细胞增多性李斯特菌的灵敏度为1. 12×102copies/μL。
2. 4 染菌鲜切甜瓜最低检出限的确定
方法1. 8中染菌的鲜切甜瓜原菌液及各稀释度菌液的菌落计数结果为约6. 28×108~ 6. 28×100、0cfu/mL,以其作为模板,按照1. 5进行荧光定量PCR扩增,结果如图4所示,菌液浓度过高或过低均不会扩增出S曲线,菌浓度为6. 28×102cfu/mL时仍有扩增曲线,表明该方法对鲜切甜瓜中单核细胞增多性李斯特菌的最低检出限为6. 28×102cfu/mL。以菌浓度的对数为横坐标,以其对应的Cq值为纵坐标,建立标准曲线,见图5。标准曲线的相关系数为R2=0. 9939,表示线性关系良好,线性方程为:y= - 4. 331x+49. 693。
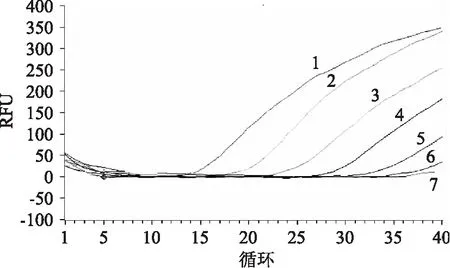
图4 染菌鲜切甜瓜的荧光定量PCR扩增曲线Fig. 4 Primary curve of real time PCR of artificial contamination fresh cut melon注:1:浓度为6. 28×108cfu/mL;2:浓度为6. 28×107cfu/mL;3:浓度为6. 28×106cfu/mL;4:浓度为6. 28×105cfu/mL;5:浓度为6. 28×104cfu/mL;6:浓度为6. 28×103cfu/mL;7:浓度为6. 28×102cfu/mL。

图5 标准曲线Fig. 5 Standard curve
3 讨论
单核细胞增多性李斯特菌在自然界分布广泛,对环境的耐受性较强,可以造成多种食品污染,如奶制品、肉制品、水产品、新鲜蔬菜等植物性食品[1]。近些年,食品污染单核细胞增多性李斯特菌而导致的食物中毒爆发事件日见增多。2002年法国一家公司加工生产的部分肉酱和猪舌受到单核细胞增多性李斯特菌污染,导致9人感染,2人死亡[2]。2008年8月,加拿大共发生57起单核细胞增多性李斯特菌感染事件,造成23人死亡。由于单核细胞增多性李斯特菌在肉类及其加工产品中污染的相关报道较多,故研究人员针对肉类及其制品、奶类等高蛋白、高脂肪食品中污染单核细胞增多性李斯特菌的研究偏多[3 - 8],而对于蔬菜、水果等植物性食品的研究很少。但是2011年9月美国爆发的大规模的甜瓜李斯特菌中毒事件即刻引起专家学者的注意,该事件导致全美24个州出现李斯特菌感染病例,截止2011年12月,30人确认因感染李斯特菌死亡[9]。这表明植物性食品也同样存在由于污染单核细胞增多性李斯特菌而对人体健康造成危害的危险,所以应提高重视。而鲜切果蔬作为即食性食品,存在新鲜、健康、卫生、方便等优点,深受人们青睐,但同时其易受微生物污染等问题同样急需解决。本研究以此为切入点,选取鲜切甜瓜为材料,进行了荧光定量PCR快速检测单核细胞增多性李斯特菌的初步研究。
荧光定量PCR快速检测食品中单核细胞增多性李斯特菌的关键是选择合适的靶基因,设计合适的引物和探针。根据文献报道,在单核细胞增多性李斯特菌的荧光定量PCR检测中,研究学者们选择扩增的靶基因、使用的引物和探针各不相同[10 - 15]。而选择较多的靶基因hly为单核细胞增多性李斯特菌所特有,且在不同菌株之间具有较高的保守性。因此,本研究选择hly基因作为荧光定量PCR反应的靶基因。从GenBank数据库中下载多条不同来源的hly基因序列,通过DNAMAN软件比对后进行引物和探针设计,找出简并碱基,合成简并引物和探针。很少有相关文献关于设计兼并引物的报道,本研究设计的简并引物可对不同来源的单核细胞增多性李斯特菌进行检测,扩大食品中单核细胞增多性李斯特菌的检测范围。
同时,模板DNA的提取也非常关键,提取质量直接影响到检测结果的准确性。要获得可靠的检测结果,很大程度上取决于模板DNA的纯度和浓度。目前大多数的提取DNA的方法为热裂解法、饱和苯酚 - 氯仿提取法、Chelex - 100树脂提取法、细菌基因组DNA提取试剂盒法等。但这些方法都存在操作繁琐或提取质量差等问题。本研究采用的磁珠法提取基因组的方法具有方便快捷、提取质量高等特点,其得到的模板DNA的纯度在1. 8 ~ 2. 0之间,浓度较高,与预实验中细菌基因组DNA提取试剂盒法得到的结果相比较好于前者,表明该方法更适用于模板DNA的提取。
本研究利用所设计的引物和探针定量PCR扩增5株单核细胞增多性李斯特菌,在30个循环内均产生了扩增曲线,为阳性。而同时定量扩增其他15株非单核细胞增多性李斯特菌为阴性。说明建立的荧光定量PCR方法具有较好的特异性。上述建立的荧光定量PCR方法也具有较高的灵敏度,可检测到1. 12×102copies/μL的质粒标准品,在染菌的鲜切甜瓜样品检测中,最低检出限为6. 28×102cfu/mL,与张红娟[16]等人建立的实时荧光定量PCR方法检测蜂王浆和蜂蜜产品中的单核细胞增生李斯特菌的灵敏度(103cfu/mL和102cfu/mL)一致,符合国际上一般认为即食食品中单核细胞增多性李斯特菌的限量标准102cfu[17]。
本研究建立的荧光定量PCR检测方法实现了在染菌鲜切甜瓜样品中的初步应用,为保障鲜切果蔬的食品安全奠定了基础。虽然目前关于单核细胞增多性李斯特菌污染果蔬类而对人类致病的报道不多,但仍应该予以高度重视,深入研究快速检测方法,确保鲜活农产品质量安全,实现防患于未然。
[1]丁建英,韩剑众. 食品中单增李斯特菌的存在现状及检测方法研究进展[J]. 食品研究与开发,2008,29(12):171 - 174.
[2]田霞,李远钊,张培正. 李斯特菌的污染现状及控制措施[J]. 现代食品科技,2005,21(1):160 - 162.
[3]邵美丽,董鑫,赵燕丽,等. 单增李斯特菌和金黄色葡萄球菌双重荧光定量PCR检测方法建立与初步应用[J]. 食品科学,2013,(16):169 - 172.
[4]吴晓芳,韩建康,纪蕾,等. 多重实时荧光PCR快速检测沙门菌和单增李斯特菌[J]. 疾病监测,2011,26(3):234 - 237.
[5]闫冰,姜毓君,曲妍妍,等. 实时RT - PCR检测存活于乳中的单核细胞增多性李斯特菌[J]. 食品科学,2008,29(2):292 - 296.
[6]刘仲敏,郑鸣,王永芬. 食源性单增李斯特菌的实时定量PCR检测[J]. 食品与发酵工业,2007,33(5):100 - 104.
[7]Rantsiou K,Alessandria V,Urso R,etal. Detection,quantification and vitality ofListeriamonocytogenesin food as determined by quantitative PCR[J]. International Journal of Food Microbiology,2008,121:99 - 105.
[8]Vanegas M C,Vasquez E,Martinez A J,etal. Detection ofListeriamonocytogenesin raw whole milk for human consumption in Colombia by real - time PCR[J]. Food Control,2009,20:430 - 432.
[9]关棣锴,胡文忠,姜爱丽,等. 鲜活农产品中单核细胞增多性李斯特菌快速检测技术的研究进展[J]. 食品工业科技,2013,(11):361 - 368.
[10]梅玲玲,王晶,孟真,等. TaqMan - MGB探针Real - time PCR快速检测单增李斯特菌的研究[J]. 中国卫生检验杂志,2007,17(2):211 - 213.
[11]徐德顺,查赟峰. 食品中单核细胞增生李斯特菌实时荧光PCR 快速检测方法的建立[J]. 中国人兽共患病学报,2007,23(4):380 - 383.
[12]Peter Rossmanith,Martina Krassnig,Martin Wagner,etal. Detection ofListeriamonocytogenesin food using a combined enrichment/real - time PCR method targeting the prfA gene[J]. Research in Microbiology,2006,(157):763 - 771.
[13]Hassan Dadkhah,Mohammad Reza Bassami,Saeed Hashemi,etal. Evaluation and comparison of SYBR Green I Real- Time PCR and TaqMan Real - Time PCR methods for quantitative assay ofListeriamonocytogenesin nutrient broth and milk[J]. African Journal of Microbiology Research,2012,6(9):1908 - 1917.
[14]Jaime Navas,Sagrario Ortiz,Pilar Lopez,etal. Evaluation of Effects of Primary and Secondary Enrichment for the Detection ofListeriamonocytogenesby Real - Time PCR in Retail Ground Chicken Meat[J]. Food Borne Pathogens and Disease,2004,3(4):347 - 354.
[15]Justin O’ Grady,Margaret Ruttledge,Sara Sedano - Balba’s,etal. Rapid detection ofListeriamonocytogenesin food using culture enrichment combined with real - time PCR[J]. Food Microbiology,2009,(26):4 - 7.
[16]张红娟,李素芳,李白,等. 单核细胞增生李斯特菌在蜂产品中的生存及检测[J]. 中国食品学报,2012,12(4):175 - 181.
[17]Elena Carrasco,Fernando P′erez - Rodr′guez,Antonio Valero,etal. Risk Assessment and Management ofListeriaMonocytogenesin Ready - to - Eat Lettuce Salads[J]. Comprehensive Reviews in Food Science and Food Safety,2010(9):498 - 512.
