乳糖酸产生菌的发酵培养基优化
2014-03-22,,
,,
(沈阳农业大学食品学院,辽宁沈阳 110866)
乳糖酸(LactobionicAcid)是集修护、抗老、保湿、抗氧化、促进肌肤更新[1-2]于一身的新型多羟基有机酸[3]。乳糖酸本身即存在于人体中,因其具有良好的吸湿性、抗氧化性、金属螯合性以及温和的酸感,被广泛应用于化妆品行业、食品制造业、医药业和精细化工行业中作为皮肤保养品[2]、食品添加剂、Wisconsin移植液[4]、增强红霉素及克拉霉素等抗生素的溶解性[5]和生物降解成分等。
迄今为止,乳糖酸的生产方法主要有化学催化法[6-8]、酶法[9-11]和生物转化法[12-13],但化学催化法伴有多种副产物产生,酶法的生产成本较高,都限制了乳糖酸的工业产量和市场占有率。每年约有290万t废弃乳糖排放到环境中,利用微生物将过剩乳糖转化为乳糖酸,可以变废为宝,增加附加值,并大大减少环境压力,造福于民[14-15]。
本文应用Plackett-Burman实验设计系统考察了影响土生拉乌尔菌RsoultellaterrigenaY20生产乳糖酸的培养基成分,发现该菌是耐高浓度乳糖的菌株且具有高产潜力,这对于进一步推动乳糖酸的产业化是有利的。
1 材料与方法
1.1 材料与仪器
土生拉乌尔菌Y20(RsoultellaterrigenaY20) 由沈阳农业大学微生物实验室分离并保存;斜面培养基(%):乳糖1.0,NH4NO30.2,NaCl 0.05,K2HPO40.1,KH2PO40.1,MgSO40.05,琼脂1.5,pH7.2~7.4;种子培养基(%):乳糖10.0,蛋白胨1.0,NaCl 0.05,K2HPO40.1,KH2PO40.1,MgSO40.05,pH 7.2~7.4。液体发酵培养基(%):乳糖12.0,蛋白胨1.0,NaCl 0.05,K2HPO40.1,KH2PO40.1,MgSO40.05,pH7.2~7.4。乳糖 沈阳市东兴试剂厂;硝酸铵 沈阳化学试剂厂;磷酸二氢钾、磷酸氢二钾、硫酸镁、NaOH 沈阳化学试剂厂;乳糖酸 Sigma公司;NaCl 沈阳沈一精细化学品有限公司;蛋白胨、酵母膏 北京奥博星生物技术责任有限公司;琼脂 Sanland Chemical Co,LTD;乙腈、柠檬酸、磷酸氢二钠 天津市大茂化学试剂厂。
AIR TECH超净工作台 苏净集团安泰公司;LZDX-50KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;HG303-4A电热恒温培养箱 南京实验仪器厂;DHG-9070A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;JD200-3型电子天平 北京赛多利斯仪器系统有限公司;Waters2487高效液相色谱仪 美国waters公司。
1.2 实验方法
1.2.1 培养方法 种子培养:250mL三角瓶装种子培养基50mL,115℃灭菌20min,接种摇瓶培养,摇床转速180r/min,温度30℃,培养12h。
摇瓶发酵:250mL三角瓶装发酵培养基50mL,种子液以2%的接种量接入发酵培养基中,转速180r/min,温度30℃,培养48h。
1.2.2 乳糖酸含量的测定 用高效液相色谱法对乳糖酸生产菌株RsoultellaterrigenaY20的产乳糖酸能力进行定量测定,以NH2P-50为色谱柱,CH3CN和40mmol/L Na2HPO4-20mmol/L柠檬酸缓冲液为流动相,在pH5.0的条件下,以6∶4的比率,0.8mL/min的流速,在40℃下以低比率泵进,进样量为10μL,用示差检测器检测。
1.2.3 单因素实验设计
1.2.3.1 氮源种类对乳糖酸产量的影响 在温度为28℃,乳糖含量为120g/L,Mg2+浓度为0.5g/L,Na+浓度为0.5g/L,pH7.2的条件下,分别以硝酸铵、硫酸铵、蛋白胨、牛肉膏和尿素为氮源,含量均为10g/L,恒温培养2d,以氮源种类为横坐标,乳糖酸产量为纵坐标,重复3次,确定Y20的最佳氮源种类。
1.2.3.2 氮源含量对乳糖酸产量的影响 在温度为28℃,乳糖含量为120g/L,Mg2+浓度为0.5g/L,pH为7.2的条件下,蛋白胨含量分别为5、10、15、20、25g/L,硝酸铵含量分别为1、2、3、4、5g/L时,恒温培养2d,以氮源含量为横坐标,乳糖酸产量为纵坐标,重复3次,确定Y20的最适氮源含量。
1.2.3.3 碳源含量对乳糖酸产量的影响 其他条件不变,碳源(即乳糖)含量分别为20、40、60、80、100、120、140g/L时,恒温培养2d,以碳源含量为横坐标,乳糖酸产量为纵坐标,重复3次,确定Y20的最适碳源含量。
1.2.3.4 pH对乳糖酸产量的影响 其他条件不变,pH分别为5.0、6.0、7.0、8.0、9.0时,考察其对乳糖酸产量的影响。
1.2.3.5 无机盐离子对乳糖酸产量的影响 其他条件不变,Mg2+浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7g/L,Na+浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7g/L时,考察无机盐离子对乳糖酸产量的影响。
1.2.4 响应面实验设计
1.2.4.1 Plackett-Burman设计 在单因素实验的基础上,选用N=8的Plackett-Burman设计对发酵培养基中的8个组分的重要性进行考察,每个因素取高低两个水平,高水平约为低水平的1.25倍,每个实验组设置3个平行,以乳糖酸产量的平均值为响应值Y,实验因素水平见表1。用Design Expert8.0.5软件对实验数据进行处理,比较各因素的t值和可信度。

表1 Plackett-Burman实验因素与水平Table 1 Factors and levels of Plackett-Burman design
1.2.4.2 最陡爬坡实验 对Plackett-Burman 实验的因素作显著性分析,找出主要因素。根据拟合函数回归系数的符号和大小来设计主要因素的最陡上升路径,正效应的因素取较高值,负效应的因素取较低值。实验组数由经验来定,步长由主要因素的效应值确定。通过使主要因素同时朝响应值增大的方向变化,找出峰值,从而逼近最大的响应区域,乳糖酸含量最高的处理,即为下一步响应面分析的中心点。
1.2.4.3 Box-Behnken实验设计 选择Plackett-Burman实验中对RsoultellaterrigenaY20乳糖酸的产量有显著性影响的三个因素作为Box-Behnken设计所要考察的变量并对其进行三水平(-1、0、+1)编码,从而获得乳糖酸产量的最佳培养基组成,实验因素与水平设计见表2。

表2 Box-Behnken实验的因素与水平设计Table 2 Factors and levels of Box-Behnken Design
1.2.4.4 模型验证 用Design Expert8.0.5软件对多元函数进行拟合和方差分析,并得到最佳培养基组合,再按照所得到的参数进行验证实验,以检验模型的重复性和可靠性。
2 结果与讨论
2.1 乳糖酸含量的测定
配制乳糖酸标样的浓度分别为25、50、75、100、125、150mg/mL的梯度溶液,用高效液相色谱法测定其峰面积,绘制乳糖酸标准曲线,乳糖酸标准曲线见图1。

图1 乳糖酸标准曲线 Fig.1 Lactobionic acid standard curve
乳糖酸的产量与峰面积符合线性相关方程y=3907.2x-2657.1,x代表乳糖酸浓度,y代表峰面积,相关系数R2=0.9993,说明该方程具有很好的相关性,可用于乳糖酸含量的测定。
2.2 单因素实验结果
2.2.1 氮源种类对乳糖酸产量的影响 由图2可知,在上述供试的6种氮源中,硝酸铵和蛋白胨对乳糖酸的产量影响较大且影响效果差不多,这是因为该菌利用氮源的能力非常强,既可以利用无机氮源也可以利用有机氮源,无机氮源有硫酸铵、硝酸铵和尿素,其中硝酸铵的含氮量为35%,大于硫酸铵的含氮量,所以乳糖酸的产量也相对较高。虽然尿素的含氮量为46.7%,但是该菌能以尿素为氮源,是由于该菌体内含有脲酶,脲酶的最适温度为60℃左右,而乳糖氧化酶的最适温度在30℃左右,而脲酶的活性受温度影响较大,因此利用尿素为氮源产乳糖酸的含量就会大幅下降。有机氮源中蛋白胨的含氮量≥12%,牛肉膏的含氮量≥7%,胰蛋白胨的含氮量≥10%,所以该菌利用蛋白胨产乳糖酸的能力较强,而且该菌利用有机氮源的能力要高于无机氮源,所以导致硝酸铵和蛋白胨的影响效果相似。考虑到有机氮源和无机氮源的搭配,故选硝酸铵和蛋白胨为复合氮源。

图2 不同氮源对乳糖酸产量的影响 Fig.2 Different nitrogen sources on the influence of Lactobionic Acid production
2.2.2 氮源含量对乳糖酸产量的影响 选择单一氮源蛋白胨和硝酸铵分别测定它们的乳糖酸产量。由图3可知,起初乳糖酸产量随着氮源含量的增加而增加,但到氮源含量达到一定值后,乳糖酸产量基本维持恒定。这是因为起初底物不足,乳糖酸的产量会随着氮源含量的增加而增加,当增加到一定值时,由于该菌中乳糖氧化酶的含量是有一定限度的,不会随之增加,所以乳糖酸的产量基本维持恒定。
2.2.3 碳源含量对RsoultellaterrigenaY20乳糖酸产量的影响 由图4可知,随着乳糖含量的增加,乳糖酸产量逐渐增大,当培养基中乳糖含量达到10%左右时,乳糖酸产量达到最大值,之后随着乳糖含量的增多,反而有下降的趋势,这可能是因为,当底物浓度不足时,乳糖酸的产量会随着底物浓度的增高而增高,但是底物浓度过高会抑制菌体的生长,进而会减少乳糖酸的分泌和积累。

图3 氮源含量对乳糖酸产量的影响 Fig.3 Nitrogen sources on the influence of Lactobionic Acid production
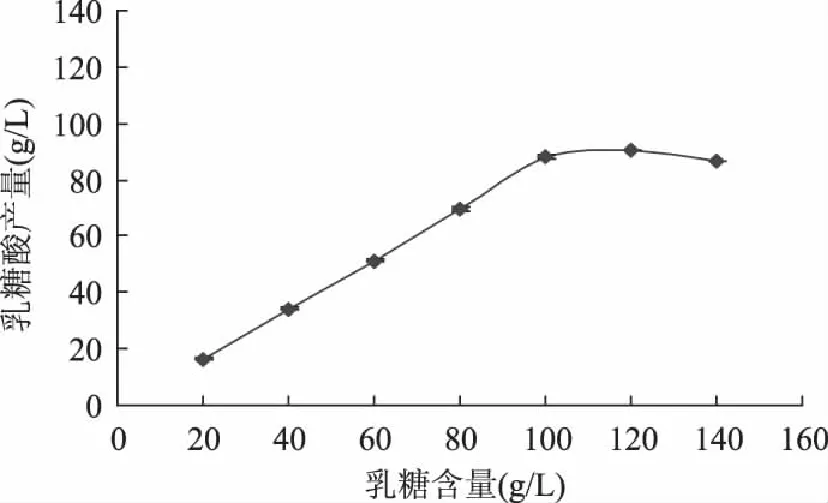
图4 碳源含量对乳糖酸产量的影响 Fig.4 Carbon source content on the influence of Lactobionic Acid production
2.2.4 pH对RsoultellaterrigenaY20乳糖酸产量的影响 由图5可知,土生拉乌尔菌RsoultellaterrigenaY20的最适pH为7.0左右,此时乳糖酸的产量最高达89.25g/L。pH过高或过低可能会影响菌体中乳糖氧化酶的活性,进而影响乳糖酸的产量。
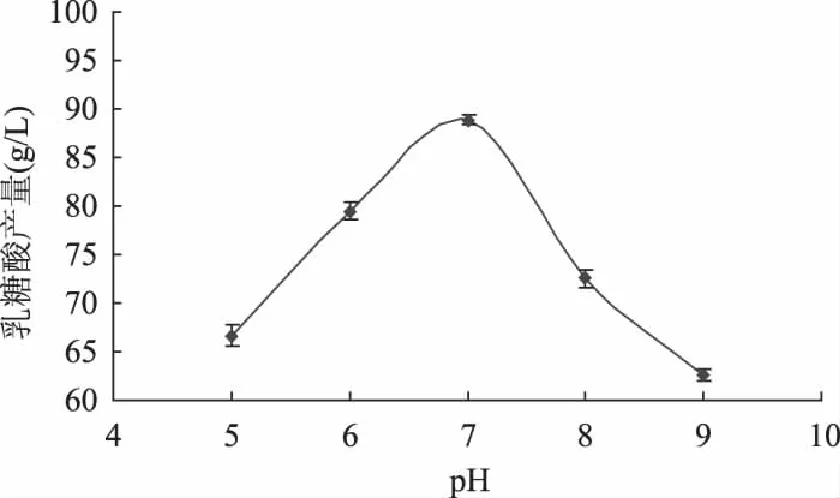
图5 pH对乳糖酸产量的影响 Fig.5 pH on the influence of Lactobionic Acid production
2.2.5 无机盐离子浓度对乳糖酸产量的影响 由上图可知,土生拉乌尔菌RsoultellaterrigenaY20的乳糖酸产量随离子浓度的增大而增大,之后趋于稳定,这可能是因为Mg2+对乳糖氧化酶活性的高低有一定的影响,Na+主要影响菌体的形态和渗透压,所以随着离子浓度的增大,对乳糖酸的产量均有一定的促进作用,但这种促进作用不可能是无限的,当离子浓度达到一定值时,促进作用减弱。

图6 无机盐离子对乳糖酸产量的影响 Fig.6 Inorganic salt ion on the influence of Lactobionic Acid production
2.3 Plackett-Burman实验
在单因素实验的基础上,按照N=12的8因素2水平Plackett-Burman设计进行实验,每组3个平行,摇瓶发酵的结果取平均值,响应值为乳糖酸产量。Plackett-Burman设计及响应值见表3,各因素效应及显著性分析见表4。
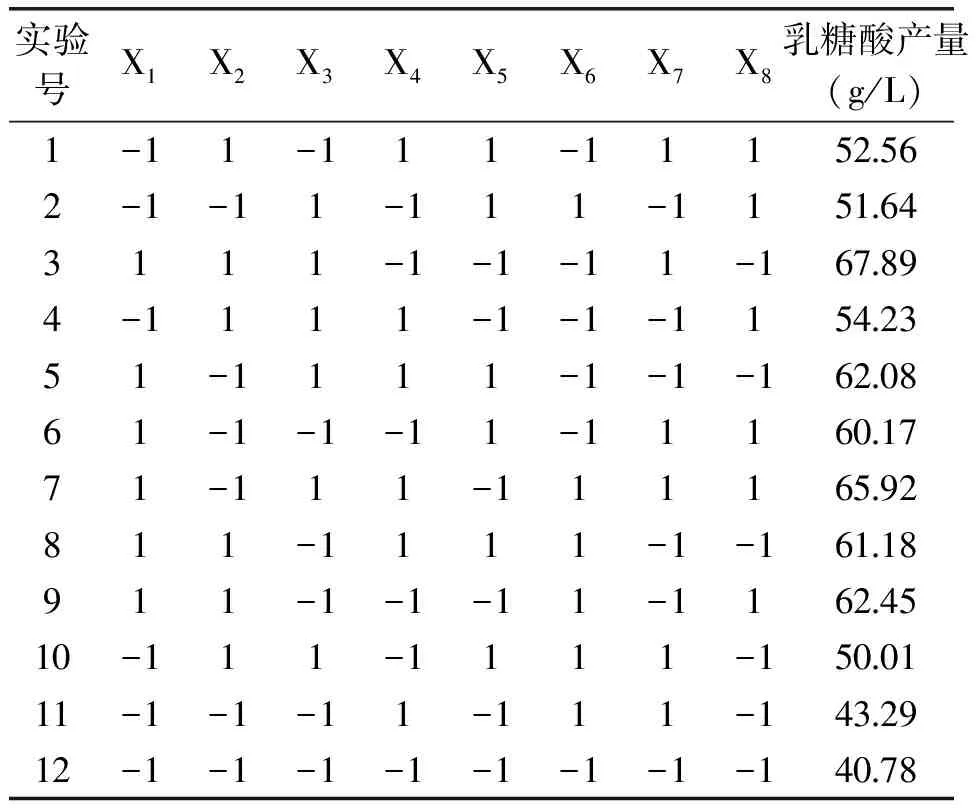
表3 Plackett-Burman设计与结果Table 3 Plackett-Burman design and results of

表4 Plackett-Burman各因素效应及显著性分析Table 4 Plackett-Burman factors effect and significant analysis
由表3可看出,KH2PO4表现为负效应,其余均为正效应。可信度大于90%的因素为乳糖、硝酸铵、蛋白胨和初始pH,其中乳糖的可信度大于95%,表现为极显著。
2.4 最陡爬坡实验
Plackett-Burman实验筛选出的三个最显著因素全为正效应,其浓度水平应增加,根据三个因素的效应值大小设计它们的变化方向及步长进行最陡爬坡实验[16],实验设计结果见表5。

表5 最陡爬坡实验结果Table 5 Results of steepest ascent test
从表5可看出,最优培养基条件在第3组实验附近,因此以第3组的水平作为响应面实验的中心点,即乳糖110g/L,蛋白胨17.5g/L,硝酸铵2.9g/L。
2.5 Box-Behnken实验结果分析
根据PB实验和最陡爬坡实验结果确定Box-Behnken实验的三个因素及水平,Box-Behnken实验结果见表6,利用Design Export8.0.5软件对Box-Behnken实验的结果进行回归拟合,得到响应值Y与因子X之间的回归方程:Y=93.16+4.24A+5.82B+1.87C-1.30AB-0.34AC+1.16BC-9.38A2+1.32B2-1.19C2。

表6 Box-Behnken实验设计与结果Table 6 Design and results of Box-Behnken experiments
根据表6的结果,运用Design Export8.0.5软件对其进行方差分析和模型的显著性分析,结果见表7。

表7 回归方程的方差分析Table 7 Variance analysis of regression equation
从表7中可看出,模型p<0.0001,高度显著,失拟项p=0.8293,失拟不显著,相关系数R2=0.9935说明该模型与实际实验拟合很好,调整后的R2=0.9851,即表明该模型可以解释98.51%的发酵产乳糖酸水平的变化,进一步说明了回归方程的拟合程度较好[17]。各因素的回归系数及方差分析显示,因素A、B、C表现为极显著,二次项A2表现为极显著,B2和C2表现为显著,一次项中的AB和BC表现为显著,影响大小的先后顺序为B>A>C,说明实验中的各个因素对响应值的影响并非简单的线性关系,而是具有很好的交互性。
2.6 响应面优化结果的分析
由二次回归方程所得到的响应面图及相应的等高线图见图7~图9。各因素交互作用对响应值乳糖酸产量的影响由图可直观地反映出来。
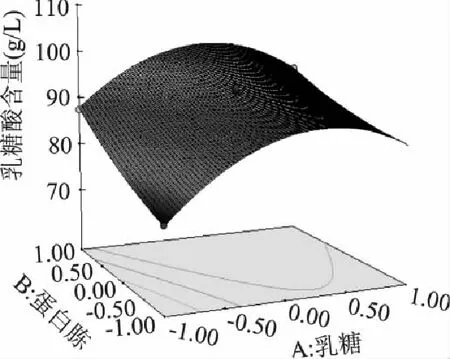
图7 Y=f(A,B)的响应面分析图及其等高线图 Fig.7 Response surface plot and contour plot of Y=f(A,B)
图7表明,在硝酸铵一定的情况下,蛋白胨和乳糖的交互作用显著,随着蛋白胨和乳糖含量的增加,乳糖酸的产量开始不断提高,后期呈现小幅下降。一定程度上,提高培养基中蛋白胨和乳糖的含量有利于提高乳糖酸的产量,蛋白胨的变化对乳糖酸产量的影响没有乳糖明显,乳糖浓度过高会抑制菌体生长,不利于乳糖酸产量的增加。
由图8可知,在蛋白胨一定的情况下,随着硝酸铵和乳糖含量的增加,乳糖酸的产量开始不断提高,后期呈现小幅下降。一定程度上,提高培养基中硝酸铵和乳糖的含量有利于提高乳糖酸的分泌和积累,但乳糖浓度过高会抑制菌体生长,不利于乳糖酸产量的增加。
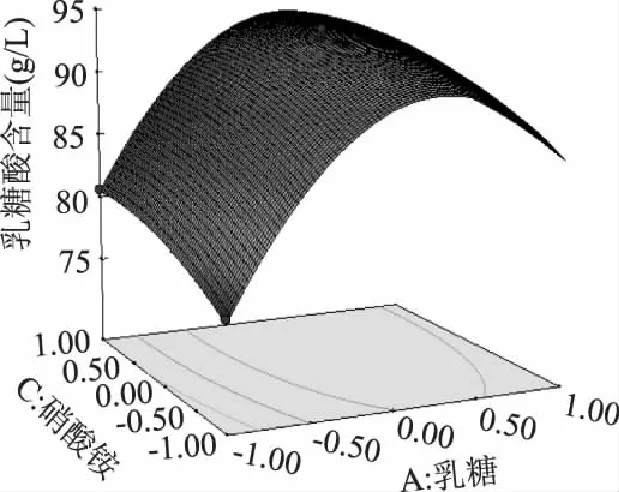
图8 Y=f(A,C)的响应面分析图及其等高线图 Fig.8 Response surface plot and contour plot of Y=f(A,C)
由图9可知,在乳糖一定的情况下,蛋白胨和硝酸铵的交互作用较显著,随着蛋白胨和硝酸铵含量的增加,乳糖酸的产量不断提高,但硝酸铵对乳糖酸产量的影响不及蛋白胨对乳糖酸产量的影响。

图9 Y=f(B,C)的响应面分析图及其等高线图 Fig.9 Response surface plot and contour plot of Y=f(B,C)
2.7 培养基最佳浓度的确定
通过Design Expert8.0.5软件分析得到最佳培养基组成:乳糖110.28g/L,蛋白胨19.00g/L,硝酸铵3.00g/L,在此条件下的乳糖酸产量的理论值为102.328g/L。
2.8 最佳发酵培养基的验证
为了验证建立的模型与实验结果是否相符,根据最佳培养基组成配制发酵培养基,做3次平行实验,RsoultellaterrigenaY20的乳糖酸产量为102.614g/L,与预测值相近。
3 结论
在单因素实验的基础上,经Plackett-Burman实验确定乳糖、蛋白胨和硝酸铵为主要影响因素,在此基础上进行最陡爬坡实验,确定最佳响应面区域,然后采用Box-Behnken设计和Design Expert8.0.5软件分析计算,得到这3种因素的添加量:乳糖110.28g/L,蛋白胨19.00g/L,硝酸铵3.00g/L,经实验验证,在此条件下乳糖酸产量为102.614g/L,转化率为93.05%,比优化前的93.84g/L提高了9.35%。
利用微生物法将乳糖转化为乳糖酸是一种简单而有效的方法,生产成本较低,利于工业化生产。可以对培养基的发酵条件进行优化,以期进一步地提高乳糖酸的产量。
[1]Tasic-Kostov M,Savic S,Lukic M,etal. Lactobionic acid in a natural alkylpolyglucoside-based vehicle:assessing safety and efficacy aspects in comparison to glycolic acid[J]. Journal of Cosmetic Dermatology,2010,9:3-10.
[2]Barbara A,Green. Hydroxy Acids and Beyond[J].Pierce Mattie Public Relations Inc Cosmetic Forecast,2004:38-41.
[3]Ahmad S K,Brinch D S,Friis E P,etal. Toxicological Studies on Caltose Oxidase from Microduchium mivale expreused in Fusdrium Venenatum[J].Regu Latory toxicology and pharmacology,2004,39(3):256-270.
[4]Southard J H,Belzer F O. Organ preservation[J],Annu Rev Med,1995,46:235-247.
[5]Jain N K,Jain S K. Development andinvitrocharacterization of galactosylated low molecular weight chitosan nanoparticles bearing doxorubicin[J]. American Association of pharmaceutical Scientists,2010,11:686-697.
[6]Maki-Arvela P,Murzina E V,Campo B,etal. The effect of palladium dispersion and promoters on lactose oxidation kinetics[J]. Research on Chemical Intermediates,2010,36:423-442.
[7]Maki-Arvela P,Tokarev A V,Murzina E V,etal. Kinetics of lactose and rhamnose oxidation over supported metal catalysts[J]. Physical Chemistry Chemical Physics,2011,13:9268-9280.
[8]Belkacemi K,Hamoudi S. Chemocatalytic oxidation of lactose
to lactobionic acid over PdeBi/SBA-15:reaction kinetics and modeling[J]. Industrial and Engineering Chemistry Research,2010,49:6878-6889.
[9]Pedruzzi I,Borges daSilva E A,Rodrigues A E. Production of lactobionic acid and sorbitol from lactose/fructose substrate using GFOR/GL enzymes from Zymomonas mobilis cells:a kinetic study[J]. Enzyme and Microbial Technology,2011,49:183-191.
[10]Van Hecke W,Bhagwat A,Ludwig R,etal. Kinetic modeling of a bi-enzymatic system for efficient conversion of lactose to lactobionic acid[J]. Biotechnology and Bioengineering,2009,102:1475-1482.
[11]Van Hecke W,Ludwig R,Dewulf J,etal. Bubble-free oxygenation of a bi-enzymatic system:effect on biocatalyst stability[J]. Biotechnology and Bioengineering,2009,102:122-131.
[12]Alonso S,Rendueles M,Diaz M. Efficient lactobionic acid production from whey by Pseudomonas taetrolens under pH-shift conditions[J]. Bioresource Technology,2011,102:9730-9736.
[13]Alonso S,Rendueles M,Diaz M. Role of dissolved oxygen availability on lactobionic acid production from whey by Pseudomonas taetrolens[J]. Bioresource Technology,2012,109:140-147.
[14]Murakami H,Seko A,Azumi M,etal. Microbial Conversion of Lactose to Lactobionic Acid by Resting Cells ofBurkholderiacepaciaNo.24[J]. Japanese Applied Glycoscience,2006,53(1):7-11.
[15]Gutiérrez L-F,Hamoudi S,Belkacemi K. Lactobionic acid:A high value-added lactose derivative for food and pharmaceutical applications[J].International Dairy Journal,2012,5:1-9.
[16]葛珍珍,王杰,周灿灿,等.响应面法优化小球藻培养基[J].食品工业科技,2012,33(16):195-200.
[17]李文婧,赵祥颖,田延军,等.γ-聚谷氨酸产生菌的发酵培养基优化[J].食品与发酵工业,2010,36(3):108-116.
