超声波-酶法联合提取绞股蓝总黄酮及其抗氧化活性的研究
2014-03-22,,,,
,,,,
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
绞股蓝Gynostemmapentaphyllum(Thunb.)Makino又名七叶胆、五叶参、甘茶蔓等,是葫芦科绞股蓝属的多年生草质藤本植物[1]。绞股蓝性寒、味甘、微苦,具有多种生理活性功能,具有抑制肿瘤,清热解毒,降低血脂和止咳祛痰等作用[2]。
绞股蓝化学成分复杂,除了含有皂苷之外,还含有多种黄酮类和氨基酸类等成分[3]。目前,对绞股蓝中黄酮类物质的研究主要集中在不同产地的绞股蓝总黄酮的测定,而对其提取方法的研究较少,主要有醇浸提法[4]、超声波提取法[5]、酶法提取[6]等。
通过纤维素酶的作用不仅可以将植物组织分解,使提取传质阻力减小,而且也可将提取液中的杂质分解除去,降低提取液的黏度,从而简化后续分离纯化工序。目前,利用纤维素酶在多糖类[7]、黄酮类[8]以及皂苷类[9]等化合物提取中多有应用,并取得了较好的效果。果胶酶在总黄酮提取过程中,破坏了细胞壁间相连的果胶物质,使果肉中的黄酮类物质充分地释放出来,提高了总黄酮得率[10]。超声波的次级振动效应能够加速欲提取成分的扩散释放并充分与溶剂混合,有利于有效成分的溶出[11]。联合应用超声波和酶法能够提高提取效率、维持提取物的结构和理化活性。
本文对超声波和酶法联合应用提取绞股蓝总黄酮的方法进行了优选,并对提取的总黄酮进行了抗氧化性能的研究,以期为进一步开发利用绞股蓝中黄酮资源提供技术支持。
1 材料与方法
1.1 材料与仪器
绞股蓝 安徽石台县天然茶叶有限公司;芦丁对照品 南京泽朗生物工程有限公司,纯度≥98%;纤维素酶(30000U/g)、果胶酶(10000U/mL) 合肥一力生物技术有限公司;其它试剂 国药集团上海试剂公司,均为分析纯。
KQ-250DE超声仪 昆山市超市仪器有限公司;723型可见分光光度计 上海菁华科技仪器有限公司;HH-2型恒温水浴锅 金坛市杰瑞尔电器有限公司;SHB-A型真空抽滤机 郑州市上街华科仪器厂;FC104型电子天平 上海精密科学仪器公司。
1.2 样品的预处理
将绞股蓝粉碎,过120目筛,以石油醚为溶剂进行索氏抽提,脱脂和除色素,回流至醚相无色后,取出绞股蓝粉末,挥尽石油醚,烘干备用。
1.3 提取方法
1.3.1 乙醇浸提法 称取5g经过处理的绞股蓝粉末置于500mL锥形瓶中,加入80%的乙醇100mL浸提3h,收集浸提液,滤渣重复浸提一次,合并两次的浸提液。
1.3.2 超声提取法 称取5g经过处理的绞股蓝粉末置于500mL锥形瓶中,加入80%的乙醇100mL超声提取40min,收集浸提液,滤渣重复浸提一次,合并两次的浸提液。
1.3.3 复合酶解法 称取5g经过处理的绞股蓝粉末置于500mL锥形瓶中,加入100mL蒸馏水浸泡24h,加入纤维素酶0.2g和果胶酶3mL,调节pH4.5,于50℃水浴酶解2h,酶解后过滤,药渣加入80%的乙醇浸提两次,过滤后合并。
1.3.4 超声-复合酶解法 称取5g经过处理的绞股蓝粉末置于500mL锥形瓶中,加入100mL蒸馏水浸泡24h后超声处理40min,然后加入纤素酶0.2g和果胶酶3mL,调节pH4.5,于50℃水浴搅拌酶解2h,酶解后过滤,药渣加入80%的乙醇浸提两次,过滤后合并。
1.4 超声-复合酶法提取工艺的选择
在前期实验的基础上,对超声-复合酶法提取工艺进行了优选,选定超声波-复合酶解法、复合酶解-超声波法、超声波-纤维素酶-果胶酶和纤维素酶-果胶酶-超声波等4种方法。
1.4.1 超声波-复合酶解法 按照1.3.4操作。
1.4.2 复合酶解-超声波法 称取5g经过处理的绞股蓝粉末置于500mL锥形瓶中,加入100mL蒸馏水浸泡24h,加入纤维素酶0.2g和果胶酶3mL,调节pH4.5,于50℃水浴酶解2h,然后加入80%的乙醇100mL超声提取40min,收集浸提液,滤渣重复浸提一次,合并两次的浸提液。
1.4.3 超声波-纤维素酶-果胶酶法 称取5g经过处理的绞股蓝粉末置于500mL锥形瓶中,加入100mL蒸馏水浸泡24h后超声处理40min后,加入纤素酶0.2g,调节pH4.8,于50℃水浴搅拌酶解2h,然后再加入果胶酶3mL,调节pH4.0,于50℃水浴搅拌酶解2h,酶解后过滤,药渣加入80%的乙醇100mL浸提两次,过滤后合并。
1.4.4 纤维素酶-果胶酶-超声波法 称取5g经过处理的绞股蓝粉末置于500mL锥形瓶中,加入100mL蒸馏水浸泡24h,加入纤维素酶0.2g调节pH4.8,于50℃水浴搅拌酶解2h,然后再加入果胶酶3mL,调节pH4.0,于50℃水浴搅拌酶解2h,然后加入80%的乙醇100mL超声提取40min,收集浸提液,滤渣重复浸提一次,合并两次的浸提液。
1.5 总黄酮的测定
采用亚硝酸盐法[12],精密移取0.2mg/mL芦丁的标准品溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0mL分别置于10mL具塞试管中,加5%亚硝酸钠溶液0.5mL,混匀,放置6min,加10%硝酸铝溶液0.5mL,摇匀放置6min,加4% NaOH溶液2.5mL,用蒸馏水溶剂定容至10mL,放置15min,在510nm处测吸光度A,以吸光度A为纵坐标,浓度C(mg/mL)为横坐标,绘制标准曲线,得到线性回归方程Y=9.9393X-000012,R2=0.9991。
收集绞股蓝总黄酮提取液定容至200mL,取0.5mL置于10mL具塞试管中,按上述方法测得吸光度值,代入线性回归方程计算出总黄酮的含量。得率按以下公式计算:
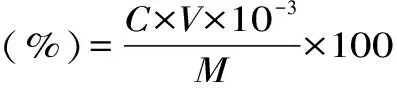
其中:C为根据方程计算出的提取液中总黄酮的含量(mg/mL);V为定容体积(mL);M是提取用的绞股蓝粉末的质量(g)。
1.6 抗氧化能力的测定
本实验以清除DPPH自由基、清除羟基自由基的能力以及还原力作为测定绞股蓝总黄酮抗氧化能力的指标,同时以维生素C为对照,比较同一质量浓度下抗氧化能力的强弱。
1.6.1 清除DPPH自由基的测定 参照丁振柱等的方法测定[13],将总黄酮提取物稀释成不同的质量浓度梯度,各取2.0mL不同质量浓度的黄酮溶液于10mL试管中,再加入2.0mL浓度为0.08mg/mL的DPPH自由基溶液(8mg的DPPH用体积分数80%无水乙醇溶解并且定容于100mL的棕色容量瓶),混合均匀,反应30min后4000r/min离心10min,取上清在波长517nm处测其吸光度(A1);另各取2.0mL不同质量浓度的黄酮溶液于试管中,分别加入无水乙醇2mL,在波长517nm处测其吸光度(A2);以2.0mL 0.04mg/mL的DPPH自由基溶液和2mL无水乙醇反应做为参比,其吸光度记为A3。平行测定3次,取平均值,按照以下公式计算清除率,以维生素C为对照。
DPPH自由基清除率(%)=[1-(A1-A2)/A3]×100
1.6.2 清除羟基自由基的测定 参照陈佳等的方法测定[14],将总黄酮提取物配制成不同的质量浓度梯度,然后各取2mL,依次加入6.0mmol/L硫酸亚铁2.0mL,1.0mmol/L的双氧水2.0mL混匀静置10min后再加入6.0mmol/L的水杨酸2.0mL,反应30min,510nm处测定吸光度(A1)。当用双蒸水代替水杨酸时,其测得的吸光度为(A2)。另取试管,加入2.0mL蒸馏水代替样品,重复上述实验,在510nm处测定吸光度(A3)。平行测定3次,取平均值按照以下公式计算清除率,以维生素C为对照。
羟基自由基清除率(%)=[1-(A1-A2)/A3]×100
1.6.3 总黄酮还原力的测定 参照莫开菊等的方法测定[15],取2.5mL不同质量浓度总黄酮溶液,加入pH6.6的0.2mol/L磷酸缓冲液2.5mL及含1%铁氰化钾水溶液2.5mL,50℃水浴20min后急速冷却,加入含10%三氯乙酸水溶液2.5mL,于3000r/min离心10min,取上清液5.0mL,加蒸馏水4.0mL及含0.1%三氯化铁水溶液1.0mL,混匀后10min于波长700nm处测定吸光度。吸光度越大,则说明还原能力越强。以维生素C为对照。
2 结果与讨论
2.1 提取方法的比较
在对天然产物活性成分的提取过程中常用的方法是用有机溶剂浸提,为了提高提取效率,一般辅以生物或者物理的方法。针对绞股蓝中总黄酮的提取,本实验首先考察了几种常用的提取方法对提取效果的影响,结果如图1所示,可以看出,通过辅助手段的联合应用,可以较显著地提高得率。
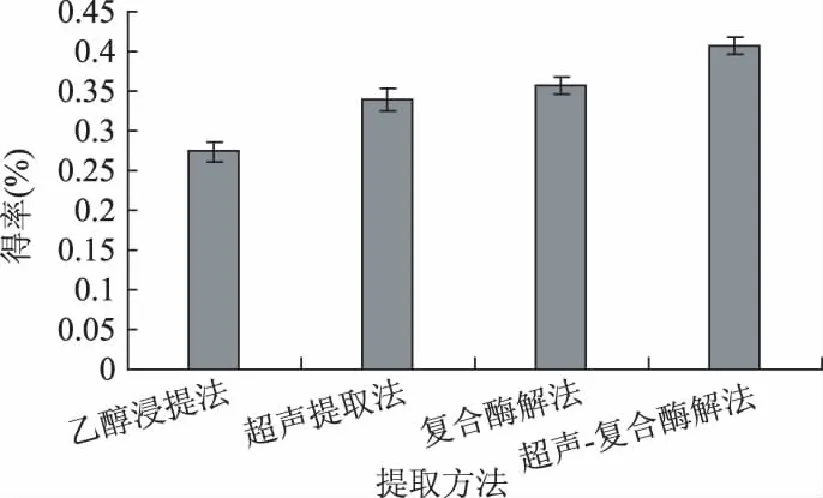
图1 提取方法的比较 Fig.1 Comparison of extraction method
2.2 超声波-酶法提取工艺的选择
在已有的关于应用超声波和复合酶法提取天然产物活性成分的研究中,重点是研究超声条件(功率、时间、温度)[16-17]和酶解条件(加酶量、温度、pH)的优化[18-19],然而对于提取过程中,超声和酶法处理的先后顺序没有做研究。另外,由于纤维素酶和果胶酶属于不同的酶类,其最佳作用条件必然有所不同,然而已有的报道都是将两者混合在一起使用,必然会影响到酶的活力。为了明确这些因素对于提取过程的影响,本实验在前期实验的基础上,根据酶的性质,按照处理顺序的不同对超声波-酶法提取工艺进行了选择,实验结果如表1所示。由表可以看出,先利用纤维素酶和果胶酶酶解后,然后超声波处理后的提取效果最好。纤维素酶和果胶酶分别作用,选择的都是这两种酶各自的最佳反应条件,使酶的作用发挥到最大。经过酶处理破坏了植物组织及细胞间的连接,然后超声波的空化、微环境搅拌作用进一步促使细胞中有效成分的溶出,利用此方法所提取总黄酮的提取率为0.498%,与其它几种方法相比有较大的提高。
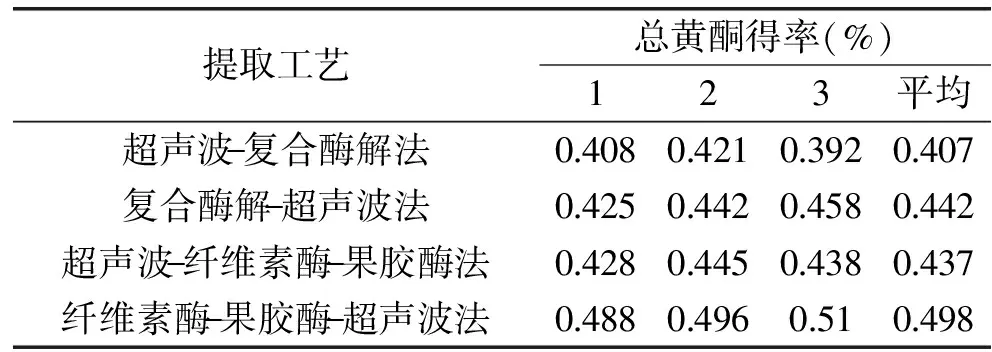
表1 超声波-酶法提取工艺优选的结果Table 1 The optimal results of enzymatic-ultrasonic method
2.3 抗氧化活性的分析
2.3.1 清除DPPH自由基的效果 提取的总黄酮对于DPPH自由基的清除效果见图2。由图可以看出,在0.4~3.2mg/mL的范围内,绞股蓝总黄酮对于DPPH自由基的清除具有一定的量效关系,在低浓度(0.4~1.2mg/mL)范围内,其清除率增长较快,随着总黄酮质量浓度的增加,其清除DPPH自由基能力也是随之提高的。其中在2.4~3.2mg/mL浓度范围内与维生素C的清除DPPH自由基的效果接近。通过数据模拟曲线方程,计算获得维生素C的IC50为0.663mg/mL,绞股蓝总黄酮提取液的IC50为0.965mg/mL,其清除DPPH的能力弱于维生素C。
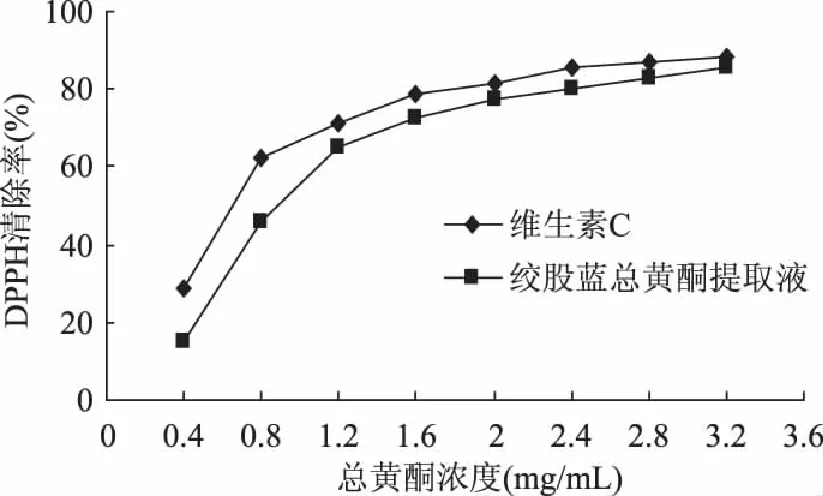
图2 不同浓度绞股蓝总黄酮清除DPPH自由基的能力 Fig.2 DPPH radical scavenging activities of different concentration of total flavonoids from Gynostemma pentaphyllum
2.3.2 清除羟基自由基的效果 机体在代谢过程中会产生羟基自由基,其性质较为活泼,可以与多种生物大分子反应,能够造成蛋白质、核酸、脂类等生物大分子损伤,随着其在细胞中的积累,从而加速机体的老化。提取的总黄酮对于羟基自由基的清除效果如图3所示,质量浓度对清除效果影响较为显著,随着总黄酮浓度的增大而增大,当超过1.2mg/mL时,清除效果基本趋于平衡。与维生素C的比较可以看出,在较低浓度情况下,其清除效果大大弱于维生素C,两者的IC50分别为0.165mg/mL和0.475mg/mL。但是绞股蓝总黄酮还是具有较强的清除羟基自由基的效果,其中在质量浓度为1.4mg/mL时与维生素C的清除能力基本相同。
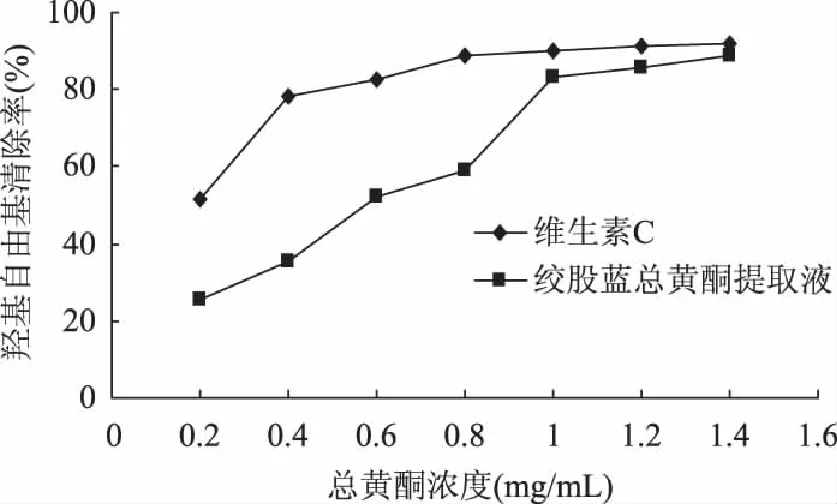
图3 不同浓度绞股蓝总黄酮清除羟基自由基的能力 Fig.3 Hydroxyl radical scavenging activities of different concentration of total flavonoids from Gynostemma pentaphyllum
2.3.3 总黄酮的还原力 黄酮类物质具有供氢的能力,H+与自由基结合,使其还原为惰性化合物或是稳定的自由基,从而清除机体内过多的有害自由基。提取的总黄酮的还原力如图4所示,随着总黄酮质量浓度的增大,其吸光度也增加,虽然其还原力低于同等浓度的维生素C,但还是表现出了较强的还原力。
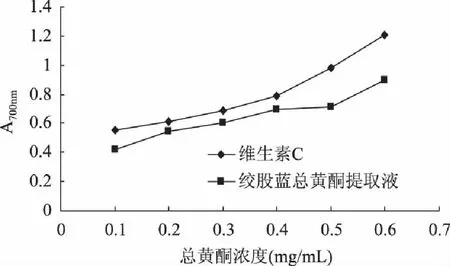
图4 不同浓度绞股蓝总黄酮的还原能力 Fig.4 Reducing power of different concentration of total flavonoids from Gynostemma pentaphyllum
3 结论
在天然产物活性成分的提取过程中,辅助采用生物法和物理法可以提高提取效率,在本实验中先利用纤维素酶,然后利用果胶酶处理,在不同的条件下发挥酶的最大活力,最后辅以超声波处理,在此条件下总黄酮得率最大,达到0.498%。目前应用复合酶法和超声波联合使用提取天然产物活性成分已经广泛应用,已有的文献在单元的操作上做了较为详尽的研究,包括超声以及酶解条件等。本文对各个单元的操作顺序进行了研究,发现先使用纤维素酶和果胶酶分别处理样品后,再利用超声波进行提取的方法所获得的总黄酮的含量最高。
绞股蓝总黄酮具有较强的清除DPPH自由基、羟基自由基的能力,同时绞股蓝黄酮还原能力较强。特别是在较高浓度情况下,绞股蓝总黄酮的抗氧化能力接近于维生素C,说明绞股蓝总黄酮具有一定的应用前景,是一种天然有效的抗氧化剂,可以广泛用于食品添加剂及保健食品中。
[1]刘运美,何军,苗胜斌,等. 绞股蓝中总黄酮的分析[J].中成药,2009,31(8):1300-1302.
[2]李金青,杨洪军. 绞股蓝的药理作用研究进展[J]. 中国现代药物应用,2009,3(7):189-190.
[3]刘欣,叶文才,萧文鸾. 绞股蓝的化学成分研究[J]. 中国药科大学学报,2003,34(1):21-24.
[4]刘运美,何军,徐道龙,等. 绞股蓝中总黄酮提取方法的比较研究[J].中国卫生检验杂志,2009,19(2):253-254.
[5]田国政,刘金龙,郑小江,等. “恩五叶蜜”绞股蓝总黄酮提取工艺研究[J].食品科学,2008,29(9):285-287.
[6]欧阳辉,田启建,余佶,等. 酶法辅助提取绞股蓝中总黄酮工艺优化[J].中草药,2011,42(5):886-889.
[7]王洪伟,崔崇士,徐雅琴. 南瓜多糖复合酶法提取及纯化的研究[J].食品科学,2007,28(8):247-249.
[8]毕会敏,张守勤,刘长姣. 纤维素酶提取红景天总黄酮的研究[J].天然产物研究与开发,2006,18(5):818-821.
[9]李元波,殷辉安,唐明林,等. 复合酶解法提取三七皂苷的实验研究[J].天然产物研究与开发,2005,17(4):488-492.
[10]陈炳华,张清其,谢必峰. 酶解法对山楂总黄酮提取及含量分析的影响[J]. 福建师范大学学报:自然科学版,1997,13(4):90-93.
[11]刘树兴,侯屹,李祥. 超声波-表面活性剂协同提取盾叶薯蓣总皂苷[J].精细化工,2010,27(6):562-566.
[12]董钰明,封士兰,段生玉,等. 不同品种芹菜及其不同部位中总黄酮含量的测定[J]. 兰州医学院学报,2002,28(3):32-33.
[13]丁振柱,黄仁华,王丹. 费约果叶片总黄酮提取工艺优化及其抗氧化活性研究[J].食品与生物技术学报,2011,30(3):371-375.
[14]陈佳,徐怀德,米林峰,等. 洋葱皮总黄酮纤维素酶法提取及抗氧化研究[J].食品科学,2011,32(4):37-41.
[15]莫开菊,柳圣,程超. 生姜黄酮的抗氧化活性研究[J].食品科学,2006,27(9):110-115.
[16]张彬,谢明勇,殷军艺,等. 相应面分析法优化超声提取茶多糖工艺的研究[J].食品科学,2008,29(9):234-238.
[17]刘小丽,张伟,符毅文. 虎杖中白藜芦醇的超声提取及其抗氧化性研究[J].中成药,2011,33(1):150-153.
[18]王晓,李林波,马小来,等. 酶法提取山楂叶中总黄酮的研究[J].食品工业科技,2002,23(3):37-39.
[19]熊知行,叶文峰. 酶法提取桑叶中黄酮类化合物的研究[J].食品工业科技,2009,30(3):223-225.
