板蓝根α-葡聚糖佐剂提高H1N1流感疫苗免疫小鼠体液免疫和细胞免疫功能
2014-03-22贾培媛赵修南武军华张永平王玉霞单俊杰王海南
文 松,李 倩,贾培媛,赵修南,武军华,麻 浩,张永平,王玉霞,单俊杰,王海南,4
(1.贵州大学药学院,贵州贵阳 550025;2.军事医学科学院毒物药物研究所,北京 100850;3.北京中安佐际生物科技有限公司,北京 100111;4.国家食品药品监督管理总局,北京 100053)
板蓝根α-葡聚糖佐剂提高H1N1流感疫苗免疫小鼠体液免疫和细胞免疫功能
文 松1,李 倩2,贾培媛2,赵修南2,武军华2,麻 浩2,张永平3,王玉霞2,单俊杰2,王海南1,4
(1.贵州大学药学院,贵州贵阳 550025;2.军事医学科学院毒物药物研究所,北京 100850;3.北京中安佐际生物科技有限公司,北京 100111;4.国家食品药品监督管理总局,北京 100053)
目的 研究板蓝根α-葡聚糖对H1N1流感疫苗免疫小鼠体液免疫和细胞免疫功能的影响。方法100 μg α-葡聚糖按+H1N1流感病毒裂解液3 μg给每只小鼠一次性肌内注射。分别在免疫后3,5,8,10, 12和14 d采血,ELISA法检测小鼠血清特异性抗体和亚类抗体滴度;MTT法测定小鼠脾T淋巴细胞、B淋巴细胞和巨噬细胞增殖反应;ELISA法测定细胞培养上清干扰素γ(IFN-γ)、白细胞介素4(IL-4)、IL-12和肿瘤坏死因子-α(TNF-α)含量;流式细胞术测定脾细胞中CD3+,CD19+,CD4+,CD8+T细胞亚群百分率。结果 板蓝根α-葡聚糖对人用H1N1流感疫苗抗原显示优良的佐剂作用,初次免疫后5 d即能促进特异性抗体的生成,抗体亚型主要为IgM。免疫后5~14 d,总抗体及亚类IgG1,IgG2a和IgG2b滴度持续升高,IgG3在免疫8 d达峰,之后无明显变化。IgA滴度水平最低,且随时间无明显变化。α-葡聚糖显著促进H1N1流感疫苗免疫小鼠脾T细胞和B细胞增殖(增殖率分别为44.2%和37.8%),促进脾细胞分泌IFN-γ(P<0.01)和IL-12(P<0.05),刺激胸腺细胞分泌IL-4(P<0.01);与单独抗原组相比,联用α-葡聚糖明显提高免疫小鼠脾CD3+细胞百分率(P<0.01)及CD3+/CD19+比值(P<0.01),提高 CD8+T细胞百分率,降低CD4+/CD8+比值(P<0.01)。α-葡聚糖能激活巨噬细胞,促进TNF-α的分泌。结论 板蓝根α-葡聚糖能显著提高免疫小鼠的体液免疫和细胞免疫功能。
板蓝根;α-葡聚糖;流感疫苗;佐剂,免疫;抗体生成;免疫,细胞
板蓝根(Radix Isatidis)为十字花科植物菘蓝(Isatis indigotica)的干燥根,具有清热解毒、凉血利咽之功效,常用于温毒发斑、舌绛紫暗、喉痹、烂喉丹痧、丹毒和痈肿。近年来有文献报道板蓝根水提物及总多糖对动物疫苗有一定的佐剂作用。Chen等[1]研究发现,小鼠接种板蓝根水煎液与口蹄疫病毒(手足口病病毒,foot and mouth disease virus,FMDV)的DNA疫苗,FMDV的抗体反应明显增加,促进T细胞增殖,增强小鼠FMDV攻击的保护能力,作用效果优于单独注射FMDV DNA。邱妍等[2-3]发现,板蓝根总多糖(Isatis indigotica polysaccharides,IIP)能提高鸡外周血T淋巴细胞干扰素γ (interferon-γ,IFN-γ)、白细胞介素4(interferon-4,IL-4)的mRNA表达水平,该多糖与鸡新城疫-传染性支气管炎二联(NDV-IBV)弱毒苗一起免疫小鼠,能显著提高新城疫HI抗体效价,促进外周血T淋巴细胞增殖,提高CD4+,CD8+T淋巴细胞百分率和CD4+/CD8+比值。孔祥峰等[4]将IIP于新城疫Ⅳ系疫苗联用免疫雏鸡,能不同程度地提高抗体效价,且与给药时间、剂量和免疫接种次数有一定关系。IIP作为免疫增强剂联合猪繁殖与呼吸综合征灭活疫苗免疫仔猪,能显著提高仔猪的CD3+,CD8+淋巴细胞的百分率和特异性抗体滴度[5],同时总多糖还能显著促进猪脾淋巴细胞的增殖,提高刀豆蛋白A (concanavalin A,ConA)诱导的猪脾淋巴细胞IFN-γ和一氧化氮的分泌,抑制IL-2的产生[6-7]。
本课题组前期采用卵清蛋白(ovalbumin,OVA)和H1N1流感灭活抗原同样证实IIP具有明显的佐剂活性[8]。IIP经DEAE-纤维素柱层析,分别得到IIP-A(H2O洗脱)、IIP-B(Na2CO30.25 mol·L-1洗脱)、IIP-C(Na2CO30.50 mol·L-1洗脱)和IIP-D (Na2CO30.10 mol·L-1洗脱)4个部位。IIP-A再经Sephadex G-75柱层析纯化,获得均一多糖IIP-A-1。IIP-A-1是一种α-葡聚糖,分子量为3600 u,骨架结构为(1→4)-α-D-葡聚糖,含有(1→6)-α-D-葡萄糖支链。该α-葡聚糖能显著提高H1N1流感疫苗和乙肝疫苗免疫小鼠的体液免疫功能[9]。本文拟研究板蓝根α-葡聚糖对H1N1流感疫苗免疫小鼠体液免疫和细胞免疫功能的影响,为进一步研究作用机制提供实验依据。
1 材料与方法
1.1 细胞、动物、药材、试剂和仪器
DC2.4树突状细胞株购于上海研谨生物科技有限公司;MH-S巨噬细胞株由中国医学科学院药用植物研究所焦晓琳提供。BALB/c小鼠,雌性,6~8周龄,体质量18~20 g。合格证号:军科院SCXK(军)2007-004,由军事医学科学院实验动物中心供给。板蓝根多糖IIP-A-1由本课题组分离和纯化获得。甲型H1N1流感病毒裂解液由北京科兴生物制品有限公司生产;ConA和脂多糖(lipopolysaccharides,LPS)均购自美国Sigma公司;辣根过氧化物酶标记山羊抗小鼠IgG、辣根过氧化物酶(HRP)标记兔抗山羊IgG和N-四甲基联苯胺均购自北京中杉金桥生物技术公司;山羊抗小鼠抗体亚类试剂盒购于美国Sigma公司;PerCP标记仓鼠抗小鼠CD3e,APC标记大鼠抗小鼠CD19,PE标记大鼠抗小鼠CD4以及FITC标记大鼠抗小鼠CD8抗体均购于美国BD公司;小鼠IFN-γ、肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)、IL-4和IL-12 ELISA试剂盒均购于欣博盛生物科技有限公司;胎牛血购自美国Gibco公司;RPMI 1640培养基购自美国Hyclone公司;MTT购自美国Amresco公司。Varioskau Flash version 2.4.3酶标仪和}型洗板机均为美国 Thermo Scientific公司产品;CF16RXⅡ型冷冻离心机为日本Hitachi公司产品;流式细胞仪为美国BD公司产品。
1.2 免疫方案
1.2.1 抗体产生时-效关系免疫方案
18只 BALB/c小鼠随机分为生理盐水组、H1N1抗原组和 H1N1+IIP-A-1组,每组 6只。H1N1抗原的免疫剂量为每只鼠3 μg,IIP-A-1剂量为每只鼠100 μg。采用肌内注射途径免疫,初次免疫后3,5,8,10,12和14 d尾静脉采血,分离血清,测定血清特异性抗体和亚型抗体滴度。
1.2.2 细胞免疫功能影响免疫方案
BALB/c小鼠随机分为生理盐水组、H1N1抗原组和H1N1+IIP-A-1组,每组6只。H1N1抗原的免疫剂量为每只鼠3 μg,IIP-A-1的剂量为每只鼠100 μg。采用肌内注射途径免疫。初次免疫后28 d进行2次免疫,2次免疫后14 d,处死小鼠,进行细胞免疫功能的指标测定。
1.3 ELISA法检测血清抗体滴度
取1.2.1制备的小鼠血清用含0.1%吐温-20的磷酸缓冲溶液(PBST,pH=7.4)按1∶400的比例稀释。采用抗原2 g·L-1包被96孔板,每孔100 μL,4℃包被过夜。每孔再加入 1%牛血清白蛋白200 μL,37℃孵育封闭 1 h。封闭后用 PBST洗3次,然后每孔加入100 μL倍比稀释的血清 (以1∶400稀释液为原液),再37℃继续孵育1 h。用PBST洗板3次后,每孔加入1∶1000稀释的辣根过氧化物酶标记山羊抗小鼠IgG抗体100 μL,37℃孵育1 h。再用PBST洗板5次,N-四甲基联苯胺底物显色,用酶标仪测定450 nm处的吸光度(A450nm)。
1.4 ELISA法检测血清亚型抗体滴度
抗原用碳酸盐缓冲液0.5 mol·L-1(pH 9.6)包被,终浓度为 3 mg·L-1,加入 96孔板中,每孔100 μL,4℃包被过夜。每孔用PBST(含0.1%吐温20的PBS)洗3次后加入5%脱脂奶粉,37℃封闭1 h。PBST洗涤3次后,加入100 μL倍比稀释的1.2.1制备的血清 (以1∶400稀释液为原液),再37℃继续孵育1 h。然后PBST再洗涤3次,每孔加入山羊抗小鼠亚类抗体100 μL(用PBST 1∶1000倍稀释),37℃孵育1 h。PBST洗涤3次后,加入HRP标记的兔抗山羊IgG抗体100 μL(用PBST 1∶1000倍稀释),37℃孵育1 h。再用PBST洗涤5次后,加入TMB显色底物,每孔100 μL,室温避光显色15 min。最后每孔加入50 μL硫酸0.2 mol·L-1终止显色,酶标仪测定450 nm吸光度(A450nm)。
1.5 脾T和B淋巴细胞增殖反应测定
1.2.2免疫处理的小鼠眼球取血,颈椎脱臼处死。无菌条件下取出脾,制备脾细胞悬液,用锥虫蓝(台盼蓝)染色法检测细胞存活率>95%,进行细胞计数,调整细胞密度为5×109L-1。将计数后的脾细胞悬液按每孔100 μL加入到96孔细胞培养板,溶剂对照孔只加等体积的RPMI 1640培养液作为本底。各孔再加入100 μL ConA 4 mg·L-1,或者加入100 μL LPS 40 mg·L-1,每组设3复孔。将培养板置于含5%CO2培养箱中,37℃孵育48 h。加入20 μL MTT 5 g·L-1,继续孵育4 h。弃上清液后,每孔中加入150 μL DMSO,酶标仪检测A570nm,计算细胞增殖百分率。
1.6 流式细胞仪检测脾T和B淋巴细胞亚群
1.2.2免疫的小鼠眼球取血,颈椎脱臼处死。无菌条件下取脾制备脾细胞悬液。取脾细胞悬液100 μL(2×1010L-1),加入100 μL混合抗体(含PerCP-仓鼠抗小鼠CD3e抗体0.25 μg,APC-大鼠抗小鼠CD19抗体0.5 μg,PE-大鼠抗小鼠CD4抗体0.125 μg,FITC-大鼠抗小鼠CD8a抗体0.5 μg),每组设3个平行管。另外设4个相应的单标抗体对照。室温下避光孵育25 min,然后各管加入洗液1.5 mL,混匀。4℃离心10 min(600×g),弃上清,再离心和洗涤3次,重悬细胞,然后加入500 μL PBS,摇匀,进行流式细胞仪分析,测定 CD3+,CD19+,CD4+和CD8+细胞的百分率。
1.7 脾细胞分泌IFN-γ和胸腺细胞分泌IL-4的含量测定
1.2.2免疫处理小鼠处死后,无菌取脾和胸腺,制备脾细胞悬液(5×109L-1)和胸腺细胞悬液(2× 1010L-1)。将脾细胞和胸腺细胞悬液分别加入24孔细胞培养板中,每孔各加入500 μL。细胞样品孔中加入500 μL Con A 2 mg·L-1,空白对照组加入培养液500 μL,每组设3复孔。然后置37℃,5%CO2培养箱中培养。脾细胞培养48 h,胸腺细胞培养72 h,然后取出细胞培养液,600×g离心10 min,收集上清,分别按照ELISA试剂盒说明书测定脾细胞培养上清IFN-γ含量和胸腺细胞培养上清IL-4含量。
1.8 脾细胞分泌IL-12的含量测定
BALB/c小鼠,处死,无菌取脾,制备脾细胞悬液,计数活细胞数,调整细胞密度为2.5×109L-1备用。24孔平底培养板中每孔加入2.5×108L-1细胞悬液100 μL,再各加入100 μL LPS(30 mg·L-1)和IIP-A-1(终浓度为10,50和100 mg·L-1),每组受试药物浓度设3复孔,同时设溶剂对照孔。然后置于5%CO2、37℃饱和湿度的培养箱中培养48 h。离心(600×g),收集上清。采用ELISA试剂盒测定细胞上清液中的IL-12含量。
1.9 MTT法检测巨噬细胞存活及ELISA测定分泌TNF-α的含量
取传代培养48 h MH-S小鼠肺泡巨噬细胞,用DMEM培养液淋洗1次后,每瓶细胞加入10% FBS DMEM培养液4 mL,制成单个细胞悬液,计数活细胞数。用含FBS的DMEM培养液调整细胞密度为2.5×108L-1。96孔培养板中加入2.5×108L-1细胞悬液100 μL,再加入终浓度为1,10和50 mg·L-1的IIP-A-1各100 μL,设3复孔,同时设正常溶剂对照。5%CO2、37℃饱和湿度的培养箱中培养48 h。每孔加入20 μL 0.5%MTT液,再继续孵育3 h,弃去上清液,然后加入DMSO 150 μL,酶标仪检测A510nm,计算吞噬细胞的存活率。同样培养方法,收集巨噬细胞培养上清液,采用ELISA试剂盒测定细胞上清液中TNF-α的含量。
1.10 统计学分析
2 结果
2.1 板蓝根α-葡聚糖佐剂对H1N1抗原免疫小鼠体液免疫的影响
由图1可见,H1N1流感抗原与IIP-A-1联用初次免疫小鼠8 d,单独H1N1抗原组小鼠特异性抗体滴度无明显变化,而联用多糖组抗体滴度明显升高(P<0.05),至14 d抗体滴度进一步升高(P<0.01)。其余时间点抗体滴度无显著差异(数据未显示)。

Fig.1 Co-administration of Isatis indigotica poIysaccharides-A-1(IIP-A-1)adjuvant with H1N1 infIuenza vaccine enhances humoraI responses in mice at 8 d (A)and 14 d(B)after first immunization.BALB/c mice were immunized intramuscularly once with 3 μg H1N1 antigen alone or with 100 μg IIP-A-1each mouse.Blood samples were collected at 3 d,5 d,8 d,10 d,12 d and 14 d after immunization and total IgG was measured by ELISA.n=6.∗P<0.05,∗∗P<0.01,compared with saline group;#P<0.05,##P<0.01,compared with H1N1 antigen alone group.
由图2可见,免疫后5 d,生理盐水组小鼠血清只有IgM滴度略有升高,其他亚型均无明显变化。与盐水组相比,单独抗原免疫组IgM和IgG3滴度在免疫后8 d升高。与单独抗原组相比,联用IIP-A-1免疫后5~14 d,总抗体滴度明显持续升高,主要的亚型抗体为IgG1,IgG2a,IgG2b和IgG3。表明IIP-A-1能显著提高H1N1流感疫苗免疫小鼠的体液免疫功能。

Fig.2 Antibody of IgM(A),IgG1(B),IgG2a(C),IgG2b(D),IgG3(E)and IgA(F)after immunization with IIP-A-1 by ELISA.See Fig.1 for the treatmentn=6.∗P<0.05,∗∗P<0.01,compared with normal saline group;#P<0.05,##P<0.01,compared with H1N1 antigen alone group.
2.2 板蓝根α-葡聚糖佐剂对H1N1免疫小鼠脾T细胞和B细胞增殖的影响
由表1可见,单独免疫H1N1抗原2次,能明显提高B细胞的增殖能力(P<0.01),但对T细胞增殖无明显影响。抗原联用多糖IIP-A-1免疫后,不仅B细胞增殖能力显著高于单独抗原免疫组(P<0.01),而且也能显著地促进T细胞的增殖(P<0.01)。

Tab.1 Effect of IIP-A-1 on proIiferation of spIeen T and B Iymphocytes in H1N1 infIuenza vaccine immunized mice
2.3 板蓝根α-葡聚糖佐剂对H1N1免疫小鼠脾淋巴细胞亚群的影响
表2结果显示,单独H1N1抗原免疫小鼠2次后,CD19+亚群细胞百分率降低,CD3+/CD19+比值明显升高(P<0.05)。与单独抗原组相比,联用IIP-A-1佐剂小鼠脾 CD3+亚群细胞百分率以及CD3+/CD19+比值显著升高(P<0.01),但CD19+亚群细胞百分率降低,表明H1N1抗原联用IIP-A-1有利于T细胞的分化。从表3可以看出,单独免疫H1N1抗原,能提高 CD4+T细胞的百分率(P<0.05),对CD8+T细胞百分率及CD4+/CD8+的比值无明显影响。H1N1抗原联用IIP-A-1免疫后,CD8+细胞的百分率显著升高(P<0.01),但CD4+/CD8+比值显著降低(P<0.01),提示加入IIP-A-1佐剂有利于向Th2细胞的分化。
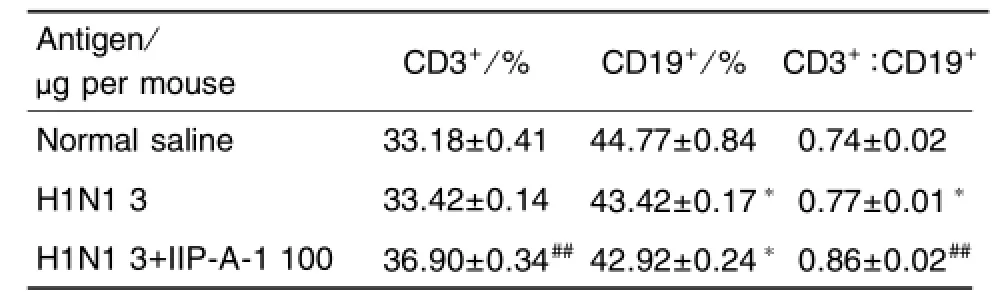
Tab.2 Effect of IIP-A-1 on CD3+and CD19+T ceII percentage in spIeen of H1N1 infIuenza vaccine immunized mice

Tab.3 Effect of IIP-A-1 on CD4+and CD8+T ceII percentagein spIeen ofH1N1 infIuenza vaccine immunized mice
2.4 对免疫小鼠脾淋巴细胞分泌IFN-γ和IL-4的影响
表4结果表明,与生理盐水组相比,单独H1N1抗原免疫小鼠2次后能明显促进脾淋巴细胞分泌IFN-γ(P<0.05),对 IL-4分泌无影响。抗原与IIP-A-1联用后,IFN-γ的分泌量进一步显著增加(P<0.01),IL-4的分泌也明显增多(P<0.05)。提示IIP-A-1佐剂有利于向Th1和Th2细胞的分化。

Tab.4 Effect of IIP-A-1 on spIenocyte interferon γ (IFN-γ)and thymocyte interIeukin 4(IL-4)secretion in H1N1 infIuenza vaccine immunized mice
2.5 IIP-A-1对小鼠脾细胞分泌IL-12的影响
表5结果表明,IIP-A-1 10~100 mg·L-1范围内能促进脾细胞分泌IL-12,100 mg·L-1浓度作用明显(P<0.05)。提示IIP-A-1有利于提高小鼠脾树突状质细胞的成熟和分泌细胞因子的作用。

Tab.5 Effect of IIP-A-1 on spIenocyte IL-12 secretion in BALB/c mice
2.6 IIP-A-1对巨噬细胞活化及分泌TNF-α的影响
表6结果显示,IIP-A-1能活化巨噬细胞,促进巨噬细胞增殖和刺激细胞因子TNF-α的分泌,且随着多糖浓度的升高,分泌的TNF-α量增多。提示IIP-A-1具有活化巨噬细胞的作用。

Tab.6 Effect of IIP-A-1 on production and proIiferation of tumor necrosis factor α(TNF-α)in MH-S macrophage
3 讨论
疫苗佐剂在免疫中的作用主要是提高机体免疫系统(体液或细胞免疫系统)对抗原或免疫原的免疫应答反应,包括增强免疫反应强度和反应的持久性。佐剂的作用原理主要包括3个方面:①激活先天性免疫应答反应(主要效应细胞为巨噬细胞、树突状细胞和B细胞);②提高抗原对免疫系统的递呈和刺激作用(主要效应细胞为巨噬细胞、树突状细胞和T细胞);③延长抗原在机体内的存在时间和保持对免疫系统的持续激活作用[10]。T细胞主要分为CD4+和CD8+T细胞,CD4+T细胞又分为Th1和Th2亚类。Th1反应典型地引发强烈的迟发型超敏反应,产生IL-2,IL-12,TNF-β和γ干扰素(IFN-γ),促进小鼠B细胞产生IgG2a,IgG2b和IgG3抗体和细胞介导的免疫力。Th2反应产生高水平的循环和分泌抗体,通常是IgG1、分泌性IgA抗体及细胞因子IL-4,IL-5,IL-6和IL-10[17,11-12]。Th1应答为机体对细胞内寄生病原体(病毒、原虫等)以及肿瘤产生保护性免疫所必需,Th2免疫则对预防绝大多数细菌和某些病毒感染有效。目前常用的佐剂-铝佐剂和不完全、完全弗氏佐剂主要是诱导Th2免疫应答[13]。
本课题组首次从植物板蓝根中分离得到一种低相对分子质量的(1→4)-α-葡聚糖,带有(1→6)-α-葡萄糖支链。该多糖与H1N1流感灭活疫苗联用初次免疫后8d即能明显提高小鼠的血浆抗体滴度水平,而且到 14 d达峰,产生的主要抗体亚类为IgG1,IgG2a,IgG2b和IgG3。目前对α-葡聚糖作为疫苗佐剂用于人或动物的研究报道很少。Rydell等[14]利用聚丙烯淀粉微球作为佐剂用于白喉疫苗,这种淀粉微球能诱导较强的体液免疫反应。Raveendran等[15]研究发现,青牛胆中一种(1→4)-α-葡聚糖能通过 Toll样受体 6信号途径和NF-κB活化机制激活巨噬细胞,继而刺激细胞因子和趋化因子的分泌。
α-葡聚糖和β-葡聚糖均由一种单糖-葡萄糖构成的多糖,二者区别主要在于葡萄糖连接的构型不同。β-葡聚糖作为疫苗佐剂已有研究报道,如出芽短梗霉(Aureobasidium pullulans)处理的大豆β-葡聚糖能显著提高H5N1流感抗原免疫小鼠的体液免疫能力[16]。从灵芝中提取的高相对分子质量(1→3)-β-葡聚糖对破伤风毒素抗原具有明显的佐剂作用[17]。β-葡聚糖调节机体免疫功能的报道较多,对其作用机制也有一定研究进展。研究发现巨噬细胞、中性粒细胞、单核细胞、NK细胞以及树突状细胞表面都存在 β-葡聚糖的受体,这些受体包括dectin-1、Toll样受体2~Toll样受体6、捕获受体、甘露糖受体等[18]。β-葡聚糖能激活巨噬细胞,促进细胞因子IL-1,TNF-α,IFN-γ和IL-6的分泌[19]。
本课题研究的(1→4)-α-葡聚糖能显著促进H1N1流感疫苗免疫小鼠脾T和B细胞增殖,明显提高CD3+细胞百分率和CD3+/CD19+比值,表明该多糖有利于向T细胞分化。该α-葡聚糖能促进脾脏和胸腺细胞分泌IFN-γ和IL-4,同时能提高CD4+T细胞百分率,显著提高CD8+T细胞百分率,降低CD4+/CD8+比值,提示T细胞有利于向Th1和Th2细胞分化。该多糖还能激活H1N1流感抗原免疫小鼠脾脏树突状细胞分泌IL-12。体外实验发现,该多糖还促进巨噬细胞增殖和分泌TNF-α。以上研究结果提示,板蓝根(1→4)-α-葡聚糖对H1N1流感疫苗免疫小鼠具有良好的体液免疫和细胞免疫促进作用,能克服铝佐剂细胞免疫弱的缺点,有希望进一步进行研究和开发。
[1] Chen L,Lin T,Zhang H,Su Y.Immune responses to foot-and-mouth disease DNA vaccines can be enhanced by coinjection with the Isatis indigotica extract[J].Intervirology,2005,48(4):207-212.
[2] Qiu Y, Cui BA, Hu YL, Dong FM,Zhang HY. Effects of four polysaccharides on expression of IL-4,IFN-γ mRNA in vaccinated chicken[J]. Jiangsu Agric Sci(江苏农业科学),2009,(2):32-25.
[3] Qiu Y, Cui BA, Hu YL,Zhang HY,Wang YG. Effects of four polysaccharides on antibody titer and T lymphocyte in vaccinated chicken[J].J Nanjing Agric Univ(南京农业大学学报),2008,31 (1):77-81.
[4] Kong XF,Hu YL,Li XR,Wang DY,Zhang BK,Liu JG,et al.Effects of nine Chinese herbal medicinal ingredients on serum HI antibody titer after vaccination of NDVⅣstrain vaccine in chicks [J].Acta Vet Zootechn Sin(畜牧兽医学报),2004,35(4):468-472.
[5] Zhang HY,Zhao XM,Cui BA,Xia PA,QIU Y,Hu M,et al.Effects of IRPS on T subpopulations in the immune response to porcine reproductive and respiratory syndrome attenuated virus vaccine [J].Chin J Immunol(中国免疫学杂志),2007,23 (2):134-137.
[6] Zhang HY,Wang YB,Wang XB,Chen HY,Zhao XM,Jin Y,et al.Effects of isatis root polysaccharide on proliferation and excretion of cytokines and NO of swine splenic lymphocytes in vitro[J].J Henan Agric Univ(河南农业大学学报),2009,43 (2):173-176.
[7] Zhang HY,Cui P,Cui BA,Wang XB,Chen HY,Jin Y,et al.Effects of indigowoad root polysaccharide on antibody and T lymphocytes subpopulations in the immune response to PRRS live virus vaccine [J].Chin Agric Sci Bull(中国农学通报),2008,24 (6):4-7.
[8] Dong N,Zhang GQ,Jia PY,Wu JH,Li S,Shan JJ,et al.Adjuvant activities of seven natural polysaccharides on immune responses to ovalbumin in mice[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(3):307-314.
[9] Shan J, Sun G, Ren J, Zhu T,Jia P,Qu W,et al.An α-glucan isolated from root of Isatis indigotica,its structure and adjuvant activity[J].Glycoconj J,2014,31(4):317-326.
[10] Xu AP,Li XM.The status and application of new immunologic adjuvant[J].Livest Poult Ind(畜禽业),2009,(5):10-13.
[11] Brown WC,Woods VM,Chitko-McKown CG,Hash SM,Rice-Ficht AC.Interleukin-10 is expressed by bovine type 1 helper,type 2 helper,and unrestricted parasite-specific T-cell clones and inhibits proliferation of all three subsets in an accessory-cell-dependentmanner[J]. Infect Immun,1994,62(11):4697-4708.
[12] Gupta RK.Aluminum compounds as vaccine adjuvants[J].Adv Drug Deliv Rev,1998,32(3):155-172.
[13] Yang FF,Xue FQ,Wang XY.Development and prospect of the adjuvants[J].Chin J Anim Infect Dis(中国动物传染病学报),2010,18(5):79-84.
[14] Rydell N,Sjöholm I.Oral vaccination against diphtheria using polyacryl starch microparticles as adjuvant[J].Vaccine,2004,22(9-10):1265-1274.
[15] Nair PK,Melnick SJ,Ramachandran R,Escalon E,Ramachandran C.Mechanism of macrophage activation by(1,4)-alpha-D-glucan isolated from Tinospora cordifolia[J].Int Immunopharmacol,2006,6(12):1815-1824.
[16] Le TH,Le KXT,Cuong PV,Nguyen TKC,Le TB,Yasunori I,et al.Adjuvant effects of Sophy β-glucan on H5N1 and H5N2 vaccination using a mouse model[J].Trop Med Health,2010,38(1):23-27.
[17] Lai CY, Hung JT, Lin HH, Yu AL,Chen SH,Tsai YC,et al.Immunomodulatory and adjuvant activities of a polysaccharide extract of Ganoderma lucidum in vivo and in vitro[J].Vaccine,2010,28(31):4945-4954.
[18] Haladová E,Mojžišová J,Smrˇco P,Ondrejková A,Vojtek B,Prokeš M,et al.Immunomodulatory effect of glucan on specific and nonspecific immunity after vaccination in puppies[J].Acta Vet Hung, 2011,59(1):77-86.
[19] Suzuki Y,Adachi Y,Ohno N,Yadomae T.Th1/ Th2-Balancing immunomodulating activity of gelforming(1→3)-beta-glucans from fungi[J].Biol Pharm Bull,2001,24(7):811-819.
Effect of α-gIycan isoIated from Isatis indigotica on humoraI and ceIIuIar immunities in mice immunized with H1N1 infIuenza vaccine
WEN Song1,LI Qian2,JIA Pei-yuan2,ZHAO Xiu-nan2,WU Jun-hua2,MA Hao2,ZHANG Yong-ping3,WANG Yu-xia2,SHAN Jun-jie2,WANG Hai-nan1,4
(1.College of Life Sciences,Guizhou University,Guiyang 550025,China;2.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China;3.Beijing Zhong′an Adjuvant Biotechnology Co.LTD;4.China Food and Drug Administration,Beijing 100053,China)
OBJECTIVE To investigate the effect of α-glycan isolated from Isatis indigotica on humoral immunity and cellular immunity functions in mice immunized with H1N1 influenza vaccine. METHODS BALB/c mice were immunized intramuscularly once with H1N1 influenza vaccine(3 μg) plus α-glycan(100 μg)each mouse.The serum total antibody titer and its isotype antibody titer of immunized mice were analyzed by ELISA at 5,8,10,12 and 14 d after injection at vaccine.The proliferation activities of spleen T and B lymphocytes were determined with MTT method.The levels of cytokines interferon-γ(IFN-γ),tumor necrosis factorα(TNF-α),interleukin-4(IL-4)and IL-12 were measured by ELISA kits.The populations of CD4+,CD8+,CD3+and CD19+lymphocytes were determined by flow cytometry.Furthermore,the proliferation rate of macrophages was studied with MTT method in vitro. RESULTS The α-glycan from I.indigotica could gradually induce high specific-antibody production 5-14 d after immunization with H1N1 influenza antigen plus the α-glycan in mice compared to immunization with antigen alone(P<0.01).After injection of antigen with α-glycan for 5 d,the main IgG isotype was IgM,and the titer levels of total IgG,IgG1,IgG2aand IgG2bwere also significantly raised following 5-14 d after immunization.The α-glycan significantly promoted the spleen T and B lymphocytes proliferation(growth rate 44.2%and 37.8%),stimulated the secretion of IFN-γ and IL-12 of splenocytes(P<0.01,P<0.05),and also promoted IL-4 secretion of thymocytes(P<0.01).The polysaccharide significantly raised the percent age of CD3+T cells(P<0.01),CD3+/CD19+T lymphocytes(P<0.01),and CD8+T cells(P<0.01)but decreased the percentage of CD4+/CD8+T lymphocytes compared with antigen alone group (P<0.01).Furthermore,the α-glycan exhibited significant effects on the proliferation and TNF-α secretion of MH-S macrophages.CONCLUSION The α-glycan isolated from I.indigotica can improve humoral and cellular immunity response in mice immunized with H1N1 influenza vaccine.
Isatis indigotica;α-glycan;influenza vaccines;adjuvants,immunologic;antibody formation;immunity,cellular
s:WANG Yu-xia,E-mail:wanguxia1962@hotmail.com,Tel:(010)66931645;SHAN Jun-jie,E-mail:shanjunjie001@126.com;WANG Hai-nan,E-mail:md_wanghainan@126.com,Tel:(010)88330710
R392,R285
:A
:1000-3002(2014)06-0850-07
10.3867/j.issn.1000-3002.2014.06.006
Foundation item:The project supported by National Sciences and Technology Major Project(2012ZX09301003-001);National Sciences and Technology Major Project(2013ZX09402103);and National Key Technology R&D Program of China(2011BAD26B02-3)
2014-05-20 接受日期:2014-10-08)
(本文编辑:乔 虹)
国家新药创制重大专项(2012ZX09301003-001);国家新药创制重大专项(2013ZX09402103);国家科技攻关计划(2011BAD26B02-3)
文 松(1989-),男,硕士研究生,主要从事中药多糖作用机制研究。
王玉霞,Tel:(010)66931645,E-mail: wangyuxia1962@hotmail.com;单俊杰,Tel:(010) 66930644,E-mail:shanjunjie0012126.com;王海南,Tel: (010)88330710,E-mail:md_wanghainan@126.com
