氨氟乐灵在大鼠体内的毒代动力学
2014-03-22林立红孟庆贺孙常松李晓磊汤保华段明郁
林立红,于 巍,孟庆贺,孙常松,李晓磊,汤保华,段明郁
(沈阳化工研究院有限公司安全评价中心,辽宁沈阳 110021)
氨氟乐灵在大鼠体内的毒代动力学
林立红,于 巍,孟庆贺,孙常松,李晓磊,汤保华,段明郁
(沈阳化工研究院有限公司安全评价中心,辽宁沈阳 110021)
目的 建立大鼠血浆中氨氟乐灵(PDM)及其代谢产物2,4-二硝基-N3-丙基-6-三氟甲基-1,3-苯二胺(DTB)的分析方法,进行氨氟乐灵大鼠体内毒代动力学研究。方法 分别采用ig(100 mg·kg-1, 1000 mg·kg-1)和iv(100 mg·kg-1)单次给予雄性SD大鼠PDM,应用液质联用仪(LC-MS/MS)测定大鼠血浆中PDM和DTB的含量,采用DAS软件拟合毒代动力学参数。结果 单次ig给予PDM 100 mg·kg-1, PDM和DTB的主要毒代动力学参数分别为:曲线下面积〔AUC(0-t)〕分别为2715±102和(6845±316)μg·h·L-1;半衰期(t1/2z)分别为9.0±1.4和(7.1±1.3)h;达峰时间(Tmax)分别为7.0±1.6和(7.0±0.0)h;峰值浓度(cmax)分别为146±51和(473±103)μg·L-1。单次ig给予PDM 1000 mg·kg-1,PDM和DTB的主要毒代动力学参数分别为:AUC(0-t)分别为3401±242和(10364±573)μg·h·L-1;t1/2z分别为8.8±2.1和(6.0±1.8)h;Tmax均为(7.0± 1.6)h;cmax分别为175±56和(586±152)μg·L-1。PDM在大鼠体内的绝对生物利用度分别为44.9% (100 mg·kg-1)和17.1%(1000 mg·kg-1)。结论 该LC-MS/MS分析方法适用于大鼠血浆中PDM和DTB的测定。PDM和DTB在大鼠体内的毒代动力学过程具有非线性动力学性质。
氨氟乐灵;2,4-二硝基-N3-丙基-6-三氟甲基-1,3-苯二胺;毒代动力学
氨氟乐灵(prodiamine,PDM)化学名为2,4-二硝基-N3,N3-二丙基-6-三氟甲基-1,3-苯二胺(图1A)。PDM是1986年由日本Sandoz Crop Protection公司开发的二硝基苯胺类出芽前除草剂,其主要作用方式为抑制纺锤体的形成,从而抑制细胞分裂、根系和芽的生长,为选择性芽前土壤处理剂[1-2]。PDM主要用于大豆、棉花、观赏性植物、芸苔作物和胡萝卜等植物的一年生杂草的防治和消除[3]。PDM原药大鼠(雄/雌)急性经口LD50>5000 mg·kg-1,属于低毒农药,其对家兔眼睛有轻微刺激作用、对皮肤无刺激性、对豚鼠皮肤为I级弱致敏物[1]。有关PDM原药及残留等的分析已有报道[4-8],但PDM在大鼠体内的毒代动力学研究至今未见文献报道,本文建立了PDM原药及代谢产物N-去丙基化合物2,4-二硝基-N3-丙基-6-三氟甲基-1,3-苯二胺(2,4-dinitro-N3-propyl-6-trifluoromethyl-1,3-benzenediamine,DTB;图1B)血浆样品的LC-MS/MS分析方法,将该方法应用于毒代动力学研究,为该农药的毒性安全评价提供科学依据,并为该农药风险评估提供基础数据。

Fig.1 Structure of prodiamine(PDM,A)and 2,4-dinitro-N3-propyI-6-trifIuoromethyI-1,3-benzenediamine (DTB,B)
1 材料与方法
1.1 试剂
PDM原药(96.0%)由沈阳化工研究院新药所提供,PDM(98.1%)和DTB标样(98.8%)由沈阳化工研究院农标所提供;利血平标样(99.8%,内标)由北京盛世康普化工技术研究院提供;乙腈,色谱纯,批号8277029,购自美国Dikma公司;甲醇,色谱纯,批号110301,购自美国Fisher Scientific公司;超纯水由Milli-Q Reference纯水系统制备;乙酸铵,色谱纯,批号1392584,购自德国Fluka公司;DMSO,色谱纯,批号08100317,购自国药集团;CO2,麻醉用;玉米油,金龙鱼牌非转基因油。
1.2 仪器
LC-20A/API3200液质联用仪(日本岛津公司/美国AB公司),配备Analyst1.5.1软件(美国AB公司);DAS 2.1.1软件(由上海中医药大学药物临床研究中心编制);T18型匀质机(德国IKA公司);BP211D型十万分之一电子天平(德国Sartorius公司);3K15型高速离心机(德国Sigma公司);移液器(德国Eppendorf公司);实验室常规玻璃仪器。
1.3 色谱条件及质谱条件
色谱柱:Phenomenex Luna 5 μm C18(2)100 A,50 mm×4.6 mm;流速:0.6 mL·min-1;柱温:室温;进样体积:10 μL;PDM RT:2.9 min,DTB RT: 2.3 min,流动相:A相 2 mmol·L-1乙酸铵水溶液;B相乙腈;梯度洗脱程序:0.5 min时A∶B(30∶70),1.5 min时A∶B(5∶95),3.4 min时A∶B(30∶70)。质谱条件,离子源:ESI源;离子源温度:500℃;喷雾电压:-4500 V;CAD:5.00;DP:-35.00 V;EP:-2.00 V;CXP:-4.00;GAS1:50.00;GAS2: 55.00;气帘气:20.00;检测方式:MRM;定量离子对:PDM 349.00/232.00,CE:-35,CEP:-32.3;DTB 306.90/203.90,CE:-35,CEP:-31.16;利血平607.6/210.8,CE:-20,CEP:-39.28。
1.4 动物及分组处理
15只SD雄性大鼠,体质量220~250 g,由北京维通利华实验动物技术有限公司提供,许可证号: SCXK(京)2012-0001。动物室温度(22.5±3.5)℃,湿度:40%~70%,照明:150~300 Lux(明暗各12 h),噪声<60 dB。动物饲料为全价颗粒饲料,饲养于塑料动物盒内,自由进食饮水。大鼠引入后适应性饲养5 d,每只大鼠饲养于一个代谢笼内,染毒前禁食约18 h。分为ig给PDM 100和1000 mg·kg-1及iv给PDM 100 mg·kg-1组,每组5只。
1.5 血浆样品采集及处理
ig染毒组分别于染毒前和染毒后10,30 min,1,2,4,7,24,31和48 h采集血样。iv染毒组于染毒前和染毒后10,20 min,1,2,4,6,23和27 h采集血样。血样采集方式为大鼠眼眶静脉丛采血,每个时间点采集全血约200 μL。血液用肝素抗凝,11 680×g,离心10 min,取上层血浆,-20℃冷冻。取大鼠血浆50 μL于1.5 mL EP管中,加入200 g·L-1的利血平内标液10 μL,然后加入100 μL甲醇,涡旋混匀1 min,21 900×g,离心10 min,取上清液适量,加入相同体积的超纯水,涡旋混匀后进行仪器分析。超过定量上限的样品,用空白血浆稀释到线性范围内进行分析。
1.7 PDM和DTB标准曲线的制备
准确称取PDM和DTB标样于50 mL容量瓶中,用乙腈溶解并定容,配制成1.00 g·L-1的标准储备液。用乙腈将标准储备液逐级稀释成100,200,400,800,2000,8000和10 000 μg·L-1的标准曲线工作溶液。精密量取空白大鼠血浆190 μL于带盖的 1.5 mL EP管中,加入标准曲线工作溶液10 μL,涡旋混匀,配制成标准曲线样品,浓度分别为5.00(最低定量限),10.0,20.0,40.0,100,400和500 μg·L-1。按 1.6项的方法预处理后进行LC-MS/MS分析,分别以PDM和DTB的峰面积与内标峰面积的比值(y)对浓度(x)进行加权(1/x2)线性回归,计算校正标准曲线方程。
1.8 PDM和DTB在血浆中的回收率和精密度考察
用乙腈将标准储备液逐级稀释成200,1000和8000 μg·L-1的质控样品工作溶液,用空白大鼠血浆稀释质控样品工作溶液,配制成考察回收率与精密度的质控样品,浓度分别为10.0,50.0和400 μg·L-1,每个浓度平行配制5份,按1.6项的方法预处理后进行LC-MS/MS分析,通过线性方程计算质控样品样品的浓度,以检测浓度与理论浓度之比计算回收率,精密度用质控样品样品测定浓度的日内和日间相对标准差(RSD)表示。
1.9 PDM和DTB在血浆中的稳定性考察
用空白大鼠血浆稀释质控样品工作溶液,配制成考察稳定性的质控样品,浓度分别为10.0,50.0和400 μg·L-1,每个浓度平行配制12份,其中3份在室温下放置6 h后再经血浆样品预处理方法处理后进行分析,考察室温稳定性;3份保存于-20℃冰箱中冷冻7 d后预处理进行分析,考察冷冻稳定性;3份预处理后进样器中保存24 h后进行分析,考察预处理后稳定性;最后3份-20℃冰箱冷冻后,室温自然解冻,冷冻与解冻循环3次,分析考察冻融稳定性。稳定性样品按1.6项的方法预处理后进行LC-MS/MS分析,通过计算稳定性样品测定浓度的平均值与理论浓度的百分比来考察血浆样品的稳定性。
1.10 数据计算与统计分析
用DAS Ver2.1.1软件对血浆浓度数据进行拟合,计算毒代动力学参数和进行统计分析,采用梯形法计算AUC,cmax与Tmax均为实测值。
2 结果
2.1 LC-MS/MS分析方法验证

Fig 2. LC-MS/MS chromatograms of prodiamine(PDM)and 2,4-dinitro-N3-propyI-6-trifIuoromethyI-1,3-benzenediamine(DTB)in rat pIasma.A:chromatogram of blank plasma;B:chromatogram of blank plasma spiked with PDM,DTB and internal standard;C:chromatogram of plasma after administration of PDM(iv 100 mg·kg-1,2 h).Peak 1:DTB;Peak 2:internal standard;Peak 3:PDM.
LC-MS/MS测定得到的色谱图(图2)显示,血浆中内源性杂质对PDM和DTB的分析没有影响,此方法的特异性良好。PDM和DTB的保留时间分别为2.9和2.3 min,此分析方法对PDM和DTB的最小检出量为5.0×10-11g,最小检出浓度为5.00 μg·L-1。当PDM和DTB标准曲线浓度范围在5.00~500 μg·L-1范围内时,PDM典型回归方程为y=0.0108x+0.0169,r=0.9975;DTB典型回归方程为y=0.00361x+0.00592,r=0.9971,回归方程相关性良好。
如表1所示,3个批次3个浓度PDM的质控样品的回收率在100.4%~101.0%之间,批内精密度在1.7%~7.2%之间,批间精密度在1.6%~2.6%之间;3个批次3个浓度DTB的质控样品的回收率在98.6%~100.7%之间,批内精密度在1.3%~7.9%之间,批间精密度在0.3%~2.6%之间。

Tab.1 Recovery and precision of PDM and DTB in rat pIasma
如表2所示,PDM和DTB在室温放置6 h、-20℃冷冻7 d、3次冻融、预处理后进样器中保存24 h等条件下,稳定性样品测定浓度与理论浓度百分比在83.7%~98.8%之间,各浓度相对标准差<10%。

Tab.2 StabiIity of PDM and DTB in rat pIasma
2.2 PDM和DTB的药时曲线及毒代动力学参数
图3A为ig给PDM 100和1000 mg·kg-1后的药物浓度-时间曲线,ig给药后,PDM和DTB在大鼠体内7 h达峰(cmax),48 h时血浆中 PDM和DTB浓度已经低于cmax的5%。图3B为iv给PDM 100 mg·kg-1后的药时曲线,iv给药后,DTB在大鼠体内20 min达峰(cmax),23 h时血浆中PDM和DTB浓度已经低于cmax的5%。
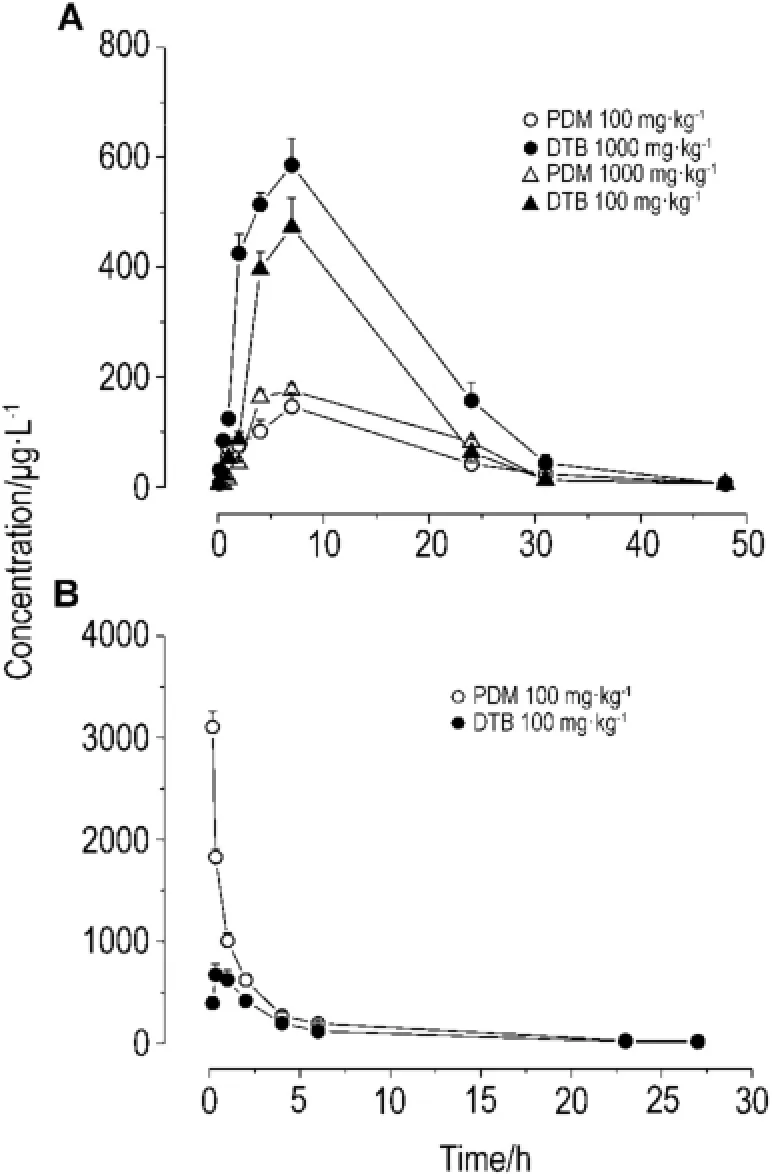
Fig.3 Concentration-time curves of PDM and DTB after a singIe dose of PDM with different administration determined by LC-MS/MS given ig(A)or iv(B).n=5.
经DAS Ver2.1.1软件处理,用统计距模型计算,主要动力学参数结果见表3。PDM经口染毒和静脉注射染毒后10 min血浆中就可检出代谢产物DTB,表明原形药物在大鼠体内可迅速代谢为DTB;PDM半衰期较代谢产物DTB长,同时表观分布容积较代谢产物大,表明PDM比DTB消除慢且分布较广;随给药剂量的提高,PDM 1000 mg·kg-1的cmax相对于给药剂量却较低,提示PDM高剂量组存在吸收饱和现象,PDM 100和1000 mg·kg-1组浓度-时间曲线下面积〔AUC(0-t)〕分别为2715±102和(3401±242)μg·h·L-1,随着剂量的增加,AUC和给药剂量的比值减小,而二者的MRT基本相同,说明药物吸收过程出现了饱和。经计算PDM 100和1000 mg·kg-1剂量在大鼠体内的绝对生物利用度分别为44.9%和17.1%。

Tab.3 Toxicokinetic parameters of PDM and DTB
3 讨论
采用C18色谱柱进行PDM和DTB血浆样品的分析,流动相采用乙腈和水,梯度洗脱,结果PDM响应太低,定量限(信噪比为10)为50 μg·L-1,无法满足毒代生物样品测定要求,尝试向水相中加入乙酸铵,当乙酸铵浓度为2 mmol·L-1时,PDM响应大大提高,定量限为5 μg·L-1,DTB响应也随之提高,因此,采用2 mmol·L-1的乙酸铵水溶液和乙腈为流动相检测PDM及其代谢物DTB。经验证,PDM和DTB检测方法的各项指标符合生物样品分析指导原则对分析测定方法的要求。
美国EPA(68D80056)登记资料显示,PDM在大鼠体内可经N脱烷基作用生成N,N-去二丙基化合物(M1);还可经环化作用生成N-丙基苯并咪唑A (M2)和N-丙基苯并咪唑B(M3),M3可进一步经硝基还原、N-脱烷基和环的羟化作用生成羟化苯并咪唑(M4)。本研究发现了文献未见报道的代谢产物N-去丙基化合物DTB,DTB与M1结构相近,M1为N位上的2个丙基全部脱去,而DTB为N位上仅脱去1个丙基的代谢产物。经质谱二级碎片比对,DTB与PDM大部分碎片相同,并且在给药后的大鼠血浆中也检测到了代谢物DTB,说明DTB为PDM在大鼠体内生成的代谢产物。毒代动力学参数表明,PDM能迅速吸收入血,快速代谢为DTB,随后缓慢分布,快速消除。随着剂量的增加,原形及代谢产物的cmax和AUC并未成比例增加,说明高剂量出现吸收饱和现象。在毒性剂量下,PDM和DTB在大鼠体内的毒代动力学过程具有非线性动力学性质。
[1] Regulatory Affairs Department.Summary of toxicological studies on prodiamine[J].J Pesticide Sci,1994,19:141-145.
[2] Anon.Prodiamine[J].Pestic Sci Admin(农药科学与管理),2011,32(7):62.
[3] Bond W.Comparative tolerance of different plant species to prodiamine[J].Crop Prot,1988,7:75-79.
[4] Duan WS, Gan LJ.The quantitative analysis of prodiamine TC by GC[J].Pestic Sci Admin(农药科学与管理),2010,31(10):36-38.
[5] Huo JL,Li J,Ge YQ,Qi Y,Chu XG.Research progress on determination methodology for dinitroaniline herbicide residues[J].Agrochemicals(农药),2006,45(4):222-226.
[6] Huo JL,Li J,Ge YQ,Chu XG.Determination of dinitroaniline multi-residues in soybean by gas chromatography-mass spectrometry[J].Chin J Anal Chem(分析化学),2006,34(Suppl 1):S63-S67.
[7] Chen QY,Ge BK,Han HF,Wang YF.Determination of 11 dinitroaniline herbicide residues in grainsby gas chromatography-tandem mass spectrometry [J].J Instrum Anal(分析测试学报),2011,30 (5):573-576.
[8] Fillion J,Hindle R,Lacroix M,Selwyn J.Multiresidue determination of pesticides in fruit and vegetables by gas chromatography-mass-selective detection and liquid chromatography with fluorescence detection[J].J AOAC Int,1995,78(5):1252-1266.
Toxicokinetics of prodiamine in rats
LIN Li-hong,YU Wei,MENG Qing-he,SUN Chang-song,LI Xiao-lei,TANG Bao-hua,DUAN Ming-yu
(Safety Evaluation Center,Shenyang Research Institute of Chemical Industry,Shenyang110021,China)
OBJECTIVE To develop an LC-MS/MS method for simultaneous determination of prodamine(PDM)and its metabolite 2,4-dinitro-N3-propyl-6-trifluoromethyl-1,3-benzenediamine(DTB)in rat plasma in order to study toxicokinetics of PDM in rats.METHODS SD male rats were administered a single dose of PDM(ig:100 and 1000 mg·kg-1;iv:100 mg·kg-1).LC-MS/MS method was used to determine PDM and DTB in rat plasma.Toxicokinetic parameters were fitted using DAS Ver2.1.1. RESULTS After ig administration of PDM 100 mg·kg-1,the parameters of PDM and DTB were as follows:AUC(0-t)was 2715±102 and(6845±316)μg·h·L-1,t1/2zwas 9.0±1.4 and(7.1±1.3)h,Tmaxwas 7.0± 1.6 and(7.0±0.0)h,cmaxwas 146±51 and(473±103)μg·L-1.After ig administration of PDM 1000 mg·kg-1,the parameters of PDM and DTB were as follows:AUC(0-t)was 3401±242 and(10364± 573)μg·h·L-1,t1/2zwas 8.8±2.1 and(6.0±1.8)h,Tmaxwas(7.0±1.6)h,cmaxwas 175±56 and(586± 152)μg·L-1.The absolute bioavailability of PDM was 44.9%(100 mg·kg-1)and 17.1%(1000 mg·kg-1). CONCLUSION This method is suitable for the analysis of PDM and DTB in rat plasma.There is evidence that PDM and DTB display nonlinear toxicokinetic characteristics in the studied dose range.
prodiamine;2,4-dinitro-N3-propyl-6-trifluoromethyl-1,3-benzenediamine;toxicokinetics
LIN Li-hong,E-mail:linlihong@sinochem.com,Tel:(024)62353405
R969.1
:A
:1000-3002(2014)06-0887-05
10.3867/j.issn.1000-3002.2014.06.011
Foundation item:The project supported by National Key Technology R&D Program of China(2011BAE06B09)
2014-03-14 接受日期:2014-08-30)
(本文编辑:乔 虹)
国家科技攻关计划(2011BAE06B09)
林立红(1981-),女,工程师,在读博士研究生,主要从事医药、农药及化学品的毒代动力学研究。
林立红,E-mail:linlihong@sinochem.com,Tel:(024)62353405
