药物代谢酶CYP3A5基因多态性与肾移植术后他克莫司和环孢素A早期临床疗效的相关性
2014-03-22潘晓东陈文伟倪晓洁王瑾珺吴存造郑少玲陈必成
潘晓东,陈文伟,倪晓洁,王瑾珺,吴存造,蔡 勇,夏 鹏,郑少玲,陈必成
(温州医科大学附属第一医院移植中心,浙江温州 325000)
药物代谢酶CYP3A5基因多态性与肾移植术后他克莫司和环孢素A早期临床疗效的相关性
潘晓东,陈文伟,倪晓洁,王瑾珺,吴存造,蔡 勇,夏 鹏,郑少玲,陈必成
(温州医科大学附属第一医院移植中心,浙江温州 325000)
目的 研究细胞色素P-450酶(CYP)家族中CYP3A5基因多态性与肾移植术后他克莫司(Tac)和环孢素A(CsA)早期临床疗效的相关性,为其个体化治疗提供依据。方法 选取2012.08-2013.04期间肾移植受者74例,其中术后口服给予Tac+吗替麦考酚酯胶囊(MMF)+甲泼尼松龙三联用药的43例,给予CsA+MMF+甲基强的松龙三联用药的31例。术前应用序列特异性引物-PCR(SSP-PCR)检测受者CYP3A5基因型;分别采用ELISA和化学发光法检测全血Tac和CsA浓度,监测术后2周及1,2,3和6个月血药浓度/剂量比(c/D);同时用己糖激酶法检测血糖、肌酐酶法检测肌酐、尿素酶法检测尿素氮和尿酸酶法检测尿酸水平。结果 74例肾移植受者中,CYP3A5∗1/∗1型占9.5%,CYP3A5∗1/∗3型占48.6%,CYP3A5∗3/∗3型占41.9%。按其表型可分为CYP3A5表达型(包括CYP3A5∗1/∗1型和CYP3A5∗1/∗3型)和不表达型(CYP3A5∗3/∗3型),分别占58.1%和41.9%。Tac受者中CYP3A5表达型在术后2周及1, 2,3和6个月时c/D中位值分别为25.49,49.64,53.72,51.93和44.5;CYP3A5不表达型受者则分别为65.48,100.84,99.54,123.01和133.21;前者均明显低于后者(P<0.05)。对于CYP3A5不表达型受者, Tac的起始剂量(0.1 mg·kg-1)偏大,术后早期肾功能恢复较表达型慢,存在一定的肾毒性损伤。而CYP3A5基因型与CsA疗效无明显相关性,CsA受者上述各时间点血药浓度、血糖、肌酐、尿素氮和尿酸等CYP3A5表达型和CYP3A5不表达型均无显著性差异。结论 CYP3A5不表达型受者使用常规Tac 0.1 mg·kg-1的起始剂量存在一定程度的药物过量,CYP3A5表型是影响Tac肾移植术后受者早期疗效的因素之一。而CYP3A5基因型与术后早期CsA的疗效无相关性。
肾移植;细胞色素P450 CYP3A5;他克莫司;环孢素A
肾移植是治疗终末期肾病的一种有效手段,而肾移植术后选择合适的免疫抑制剂及合适的剂量至关重要。目前临床最常使用的基础免疫抑制剂是钙调神经磷酸酶抑制剂环孢素 A(cyclosporin A,CsA)和他克莫司(tacrolimus,Tac),它们能有效降低急性排斥发生率,提高移植物的存活率;同时又具有治疗窗窄和药动学个体差异大等特点[1]。CsA和Tac在被吸收入血后,主要通过肝细胞色素P-450酶(cytochrome P-450,CYP)家族中的CYP3A5被代谢和清除[1-2],而该酶的活性与其基因多态性密切相关。Jounaïdi等[3]于1996年发现CYP3A5的首个单核苷酸多态性(single nucleotide polymorphism,SNP)即CYP3A5∗2,迄今已从人群中筛选出多个基因变异,其中最重要的SNP分别是第7号外显子内的G>A(CYP3A5∗6)和第3号内含子内的A>G(CYP3A5∗3),它们导致mRNA剪接发生改变和蛋白质截断,从而使CYP3A5活性降低或消失。CYP3A5∗3是中国人群最常见的SNP,是决定CYP3A5活性的最关键因素[4-5]。本研究观察了CYP3A5基因多态性与肾移植术后CsA和Tac早期临床疗效的相关性,为开展个体化治疗提供参考。
1 材料与方法
1.1 药物、试剂和仪器
Tac,每粒0.5 mg,安斯泰来制药(中国)有限公司;CsA,每粒25 mg,杭州中美华东制药有限公司;吗替麦考酚酯胶囊(mycophenolate mofetil,MMF),每粒0.25 g,上海罗氏制药有限公司。基因组DNA提取试剂盒,上海飞捷生物技术有限公司;Tac浓度检测和序列特异性引物-聚合酶链式反应(sequence specific primer-PCR,SSP-PCR)检测CYP3A5基因型试剂盒(含PCR引物),天津秀鹏生物技术开发有限公司;CsA浓度检测试剂,美国雅培公司。Architect i1000全自动免疫发光分析仪,美国雅培公司;ELx800全自动酶标分析仪,美国Bio-kit公司;Bio-Rad S1000 PCR仪,美国伯乐公司;WD-9403F紫外分析仪,北京市六一仪器厂。
1.2 病例的选择和治疗
选取2012.08-2013.04在本院进行同种异体肾移植术的受者共74例,其中男52例,女22例,术后时间为1~9个月;年龄在17~66岁之间,平均年龄(43±12)岁;体质量在39.5~79.0 kg之间,平均为(55.43±9.30)kg。
肾移植术后免疫治疗方案为三联用药。所有受者于术前和术后第4天各注射巴利昔单抗(舒莱,basiliximab)20 mg;术后第1天开始口服 MMF 1.0 g,每天2次,持续3~4周后逐渐减药;甲泼尼松龙术中用500 mg,术后第1天300 mg,术后第2天200 mg冲击治疗,术后第3天改为每天口服泼尼松64 mg,之后每天减8 mg,减至每天16 mg维持。术后监测血肌酐,待肌酐降至300 μmol·L-1开始每天口服Tac 0.1 mg·kg-1(43例)或者CsA 6 mg·kg-1(31例),每隔12 h口服1次,服用4~5 d后分别检测全血Tac和CsA谷浓度,根据浓度调整用量。服用Tac者一般术后1~3个月血药浓度为5~7 μg·L-1,3~6个月为3~5 μg·L-1。服用CsA者一般术后第1年为 100~150 μg·L-1,1年后维持在 50~100 μg·L-1。所有病例未使用影响CYP表达的药物。
1.3 SSP-PCR检测受者CYP3A5基因型
所有病例在移植术前抽取受者静脉血2 mL,置于灭菌的含12.5%依地酸(EDTA)二钾20 μL抗凝管中,用过柱膜吸附法提取基因组DNA,DNA浓度为40~100 mg·L-1,A260nm/A280nm值为1.8~2.0,于4℃低温保存备用。取 SSP-PCR检测试剂盒中440 μL浓缩dNTP缓冲液,加入560 μL无菌水配成1000 μL dNTP缓冲液工作液,分取上述工作液100 μL,加入0.8 μL Taq酶,12 μL基因组DNA,涡旋混匀,分别向透明反应板上1~10号孔各加入10 μL上述混合液,用密封膜密封,置PCR仪扩增。PCR反应条件为96℃预变性2 min;96℃ 20 s,68℃ 60 s,循环5次;96℃ 20 s,65℃ 50 s,72℃45 s,循环10次;96℃20 s,63℃50 s,72℃45 s,循环15次;最后72℃延伸3 min。PCR产物经2.5%琼脂糖凝胶电泳后,于紫外分析仪观察结果并拍照。使用试剂盒提供的结果分型表(表1)判断受者CYP3A5基因型。
1.4 全血药物浓度及肾功能检测
采用化学发光法检测血CsA浓度,采用ELISA检测血Tac浓度,所有操作严格按照试剂盒说明书操作规程进行。取术后2周及1,2,3和6个月的数据统计血药浓度/剂量(c/D)比,即浓度(μg·L-1)/ CsA或Tac服用剂量(mg·kg-1),同时用己糖激酶法检测血糖、肌酐酶法检测肌酐、尿素酶法检测尿素氮和尿酸酶法检测尿酸水平。
1.5 统计学分析
所有统计分析均通过SPSS 13.0软件完成。经Kolmogorov-Smirnov检验数据呈非正态分布,所有数据用中位数(四分位间距)描述,用Mann-Whitney U检验进行两组间比较。P<0.05认为差异具有统计学意义。
2 结果
2.1 肾移植受者CYP3A5基因型分布
根据表1判读受者CYP3A5基因型(图1)的结果显示,本研究共检测的肾移植受者74例中,CYP3A5∗1/∗1型7例(9.5%),CYP3A5∗1/∗3型36例(48.6%),CYP3A5∗3/∗3型 31例(41.9%)。按其表型可分为CYP3A5表达型(包括CYP3A5∗1/∗1型和CYP3A5∗1/∗3型)和不表达型(CYP3A5∗3/∗3型),分别占58.1%和41.9%。所有受者中43例(58.1%)携带CYP3A5∗1等位基因,67例(90.5%)携带CYP3A5∗3等位基因为,后者在人群中更常见。两组人群分布与性别无关(P=0.309)。

Tab.1 AnaIysis tabIe of cytochrome P-450 CYP3A5(CYP3A5)genotypes for sequence specific primer-PCR (SSP-PCR)resuIts
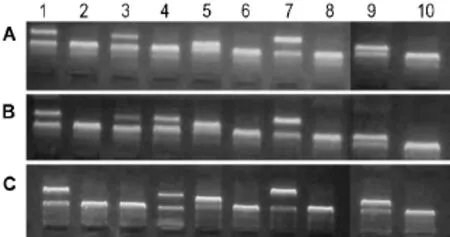
Fig.1 Expression of CYP3A5 genotypes in renaI transpIantation recipients detected by SSP-PCR.According to Tab.1,patient A is CYP3A5∗1/∗1type,patient B is CYP3A5∗1/∗3 type,patient C is CYP3A5∗3/∗3 type.
2.2 CYP3A5表型与肾移植术后早期他克莫司临床疗效的关系
由表2可见,CYP3A5表达型受者术后2周及1,2,3和6个月Tac的c/D值均明显低于非表达型(P<0.05),后者为前者的 1.9~3.0倍,表明CYP3A5基因型与受者Tac血药浓度密切相关,CYP3A5表达型受者对Tac的代谢明显快于非表达型。CYP3A5表达型受者血肌酐、尿素氮和尿酸低于非表达型受者,在术后2周和1个月时更明显(P<0.05),表明在肾移植术后早期服用相同起始剂量的Tac对于慢代谢的非表达型受者可能存在一定的药物过量,其肾毒性导致肾功能恢复较慢。两组血糖无明显差异。

Fig.2 Distribution ofCYP3A5 expression and CYP3A5 non-expression genotypes in renaI transpIantion recipients with high tacroIimus bIood concentration in different time after renaI transpIanation.

Tab.2 ReIationship between CYP3A5 genotypes and earIy curative effect in renaI transpIantion recipients using tacroIimus
根据临床治疗标准,将肾移植术后3个月内全血Tac浓度>7 μg·L-1,3个月后Tac浓度>5 μg·L-1定义为高Tac浓度组。由图2可见,CYP3A5非表达型受者出现高Tac浓度的百分率高于CYP3A5表达型受者,同样表明肾移植术后早期传统的Tac 0.1 mg·kg-1起始量对于CYP3A5非表达型受者存在一定的药物过量。
2.3 CYP3A5表型与肾移植术后早期环孢素A临床疗效的关系
由表3可以看出,肾移植术后2周至6个月期间,在各个时间点CYP3A5基因表达型与非表达型在服用CsA的肾移植受者中c/D值无明显差异,肾功能和血糖亦无明显差异,表明CYP3A5表型对肾移植术后早期CsA疗效无明显的影响。
3 讨论
本研究74例肾移植受者中携带CYP3A5∗1等位基因占58.1%,携带CYP3A5∗3等位基因占90.5%,表明CYP3A5∗3等位基因在人群中较常见。同时本研究结果表明,CYP3A5基因多态性可影响肾移植受者术后体内Tac药物代谢。分析肾移植术后2周及1,2,3和6个月c/D,发现在肾移植术后6个月内,服用相同剂量的Tac,CYP3A5非表达型肾移植受者血药浓度明显高于CYP3A5表达型,携带CYP3A5∗1等位基因受者代谢较快。这一结果与Terrazzino等[6]报道一致。
Tac的不良反应主要为肝毒性和肾毒性,也可见神经毒性、胃肠道反应和血液系统毒性等,这些不良反应主要跟药物浓度过高有关,是可逆转的,且可通过降低给药剂量而改善[7]。Krejci等[8]报道,当肾移植受者体内Tac血药浓度超过基线浓度20%且近期血药浓度>20 μg·L-1时,应考虑出现Tac引起的急性移植肾功能损伤的可能。本研究结果表明,肾移植术后早期CYP 3 A 5非表达型受者血肌酐、尿素氮和尿酸高于CYP3A5表达型受者,尤其在1个月内表现更明显,提示前者肾功能恢复可能较后者慢。由于所有移植受者免疫抑制剂给药的剂量是根据每天0.1 mg·kg-1标准计算的,这也说明传统的标准剂量 Tac对于术后早期CYP3A5非表达型受者而言偏大,造成血药浓度过高,导致一定的肾损伤。如果随着移植术后时间的推移,通过临床监测受者的Tac血药浓度而调整剂量,对肾功能的影响的差异也可能将不再明显。
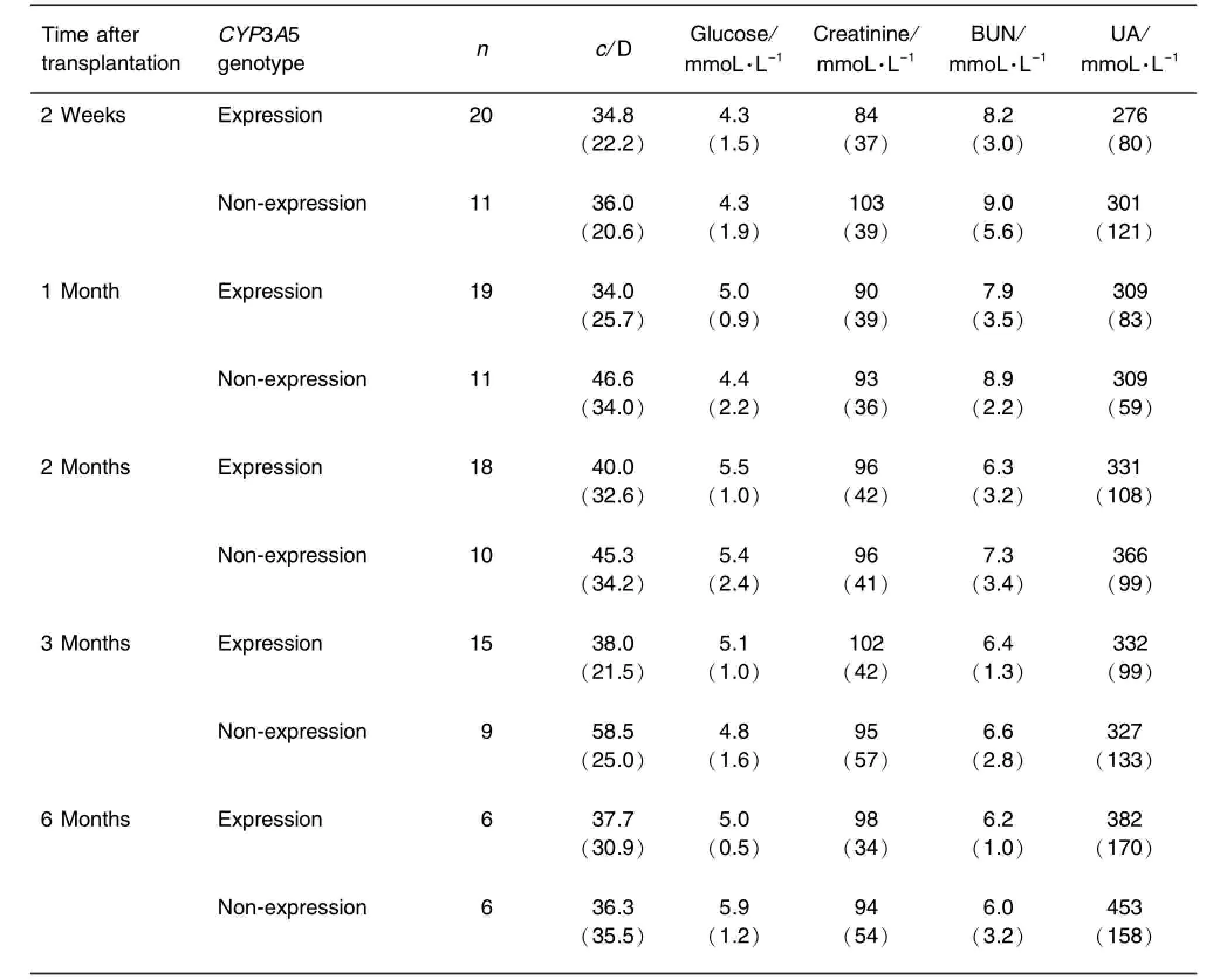
Tab.3 ReIationship between CYP3A5 genotypes and earIy curative effect in renaI transpIantion recipients using cycIosporine A
CsA同样为被CYP3A5代谢清除的钙调神经磷酸酶抑制剂,与Tac不同的是服用CsA肾移植受者CYP3A5的单核苷酸多态性对移植术后早期CsA使用过程中的血药浓度及肾功能恢复无显著影响。国内外目前对CYP3A5基因多态性是否影响CsA药物代谢存在争议。Yates等[9]报道,CYP3A5的表达水平与CsA的清除率、血药峰浓度和血药浓度-时间曲线下面积之间存在相关性。胡永芳等[10]报道,在中国汉族人群CYP3A5基因多态性与CsA的药动学个体差异有相关性。而Tang等[11]的一项荟萃分析显示,CYP3A5∗3/∗3携带者需要CsA的剂量较CYP3A5∗1携带者更低,但差异无统计学意义。Bouamar等[12]的一项随机对照研究指出,CYP3A5,CYP3A4和ABCB1基因型与CsA剂量校正的血药浓度谷值和服药2 h的血药浓度均无相关性。本研究的结果也表明,CYP3A5基因型与CsA的疗效关系不显著,这其中可能的原因是 CsA主要由 CYP3A酶系中的CYP3A4代谢,其对CsA的清除率是CYP3A5的2.3倍[13]。
综上所述,肾移植术后CYP3A5非表达型受者使用比目前的临床常规用药更低剂量的Tac起始量可达到治疗浓度,也更有利于术后受者肾功能的恢复。另外,本研究尚未发现肾移植早期CYP3A5基因型与受者血糖的关系。因此,术前常规检测CYP3A5基因型非常必要,而且临床上应大力提倡根据CYP3A5基因型来确定受者Tac的起始剂量,CYP3A5表达型受者甚至可以考虑不用Tac而改用CsA,这样安全性可能会更高。当然,本研究仅对肾移植术后6个月以内的情况进行研究,至于CYP3A5表达型和CYP3A5非表达型受者在药物不良反应、排除反应发生及供肾存活等方面是否有差异还需长期的观察。
[1] Masuda S,Inui K.An up-date review on individualized dosage adjustment of calcineurin inhibitors in organ transplant patients[J].Pharmacol Ther,2006,112(1):184-198.
[2] Dai Y, Hebert MF, Isoherranen N, Davis CL,Marsh C,Shen DD,et al.Effect of CYP3A5 polymorphism on tacrolimus metabolic clearance in vitro[J].Drug Metab Dispos,2006,34(5):836-847.
[3] Jounaïdi Y,Hyrailles V,Gervot L,Maurel P.Detection of CYP3A5 allelic variant:a candidate for the polymorphic expression of the protein?[J].Biochem Biophys Res Commun,1996,221(2):466-470.
[4] Wang HM,Hu YF.Influence of genetic polymorphisms on the pharmacokinetics of tacrolimus in patients with organ transplantation[J].Chin J New Drugs(中国新药杂志),2009,18(14):1300-1303.
[5] Lin L,Song WL,Shen ZY,Zhang Y.Effect of CYP3A5 and CYP3A4 on pharmacokinetics of tacrolimus in renal transplantation recipients[J]. Chin J Organ Transplant(中华器官移植杂志),2012,33(4):220-224.
[6] Terrazzino S,Quaglia M,Stratta P,Canonico PL,Genazzani AA.The effect of CYP3A5 6986A>G and ABCB1 3435C>T on tacrolimus dose-adjusted trough levels and acute rejection rates in renal transplant patients:a systematic review and metaanalysis[J].Pharmacogenet Genom,2012,22 (8):642-645.
[7] Chen B,Ma AM,Lin JQ.The adverse reactions of tacrolimus[J].Strait Pharm J(海峡药学),2007,19(10):130-131.
[8] Krejci K,Tichy T,Bachleda P,Zadrazil J.Calcineurin inhibitor-induced renal allograft nephrotoxicity[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2010,154(4):297-306.
[9] Yates CR,Zhang W,Song P,Li S,Gaber AO,Kotb M,et al.The effect of CYP3A5 and MDR1 polymorphic expression on cyclosporine oral disposition in renal transplant patients[J].J Clin Pharmacol,2003,43(6):555-564.
[10] Hu YF,Zhou HH.Contribution of genetic polymorphisms of the CYP3A4,CYP3A5 and MDR1 genes to cyclosporine disposition[J].Chin Pharmacol Bull (中国药理学通报),2005,21(3):257-261.
[11] Tang HL, Ma LL, Xie HG, Zhang T,Hu YF. Effects of the CYP3A5∗3 variant on cyclosporine exposure and acute rejection rate in renal transplant patients:a meta-analysis[J].Pharmacogenet Genom,2010,20(9):525-531.
[12] Bouamar R, Hesselink DA, van Schaik RH,Weimar W,Macphee IA,de Fijter JW,et al.Polymorphisms in CYP3A5,CYP3A4,and ABCB1 are not associated with cyclosporine pharmacokinetics nor with cyclosporine clinical end points after renal transplantation[J].Ther Drug Monit,2011,33 (2):178-184.
[13] Dai Y,Iwanaga K,Lin YS,Hebert MF,Davis CL,Huang W,et al.In vitro metabolism of cyclosporine A by human kidney CYP3A5[J].Biochem Pharmacol,2004,68(9):1889-1902.
Association between CYP3A5 genotypes and earIy efficacy of tacroIimus and cycIosporin A in kidney transpIantation recipients
PAN Xiao-dong,CHEN Wen-wei,NI Xiao-jie,WANG Jin-jun,WU Cun-zao,CAI Yong,XIA Peng,ZHENG Shao-ling,CHEN Bi-cheng
(Transplantation Center,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou325000,China)
OBJECTIVE To investigate the association between CYP3A5 genotypes and the early efficacy of tacrolimus(Tac)and cyclosporin A(CsA)in renal transplantation recipients,and provide a basis for individualized treatment.METHODS Seventy-four kidney transplantation recipients were enrolled in this study between August 2012 and April 2013.Thirty-one patients were treated with the combination of CsA,MMF and methylprednisolone while the rest were treated with Tac,MMF and methylprednisolone.The genotype CYP3A5 was detected by sequence specific primer-polymerase chain reaction (SSP-PCR)before transplantation.The levels of Tac and CsA were detected by ELISA and chemiluminescence,respectively,to monitor the blood concentration/dose of drugs(c/D)at 2 weeks,1 month,2 months,3 months and 6 months after transplantation.Simultaneously,the concentrations of blood glucose,creatinine,urea nitrogen and uric acid were determined with hexokinase method,creatininase method,urease method and uricolase method,respectively.RESULTS Among the 74 recipients,9.5% carried CYP3A5∗1/∗1,48.6%carried CYP3A5∗1/∗3 and 41.9%carried CYP3A5∗3/∗3.According to the phenotype of CYP3A5,the patients were divided into CYP3A5 expression group(including CYP3A5∗1/∗1 and CYP3A5∗1/∗3)and non-expression group(including CYP3A5∗3/∗3),which accounted for 58.1%and 41.9%of the cases,respectively.Among the patients taking Tac,the median value of c/D at 2 weeks,1 month,2 months,3 months and 6 months was 25.49,49.64,53.72,51.9 and 44.5 in CYP3A5 expression group,and 65.48,100.84,99.54,123.01 and 133.21 in non-expression group.The c/D ratio of CYP3A5 non-expressers was higher than among CYP3A5 expressers at each time point(P<0.05).The initial dose of Tac 0.1 mg·kg-1was high for CYP3A5 non-expressers,and the kidney function recovered more slowly than among CYP3A5 expressers and kidney damage occurred. However,there was no association between CYP3A5 genotype and the early efficacy of CsA.The levels of blood glucose,creatinine,urea nitrogen and uric acid were not significantly different between CYP3A5 expression and non-expression groups.CONCLUSION CYP3A5 non-expression recipients whose starting amount of Tac was 0.1 mg·kg-1have drug overdoses.CYP3A5 genotype is one of the factors affecting the efficacy of Tac.CYP3A5 genotype has no association with the efficacy of CsA in renal transplantation recipients.
kidney transplantation;cytochrome P-450 CYP3A5;tacrolimus;cyclosporin A
ZHENG Shao-ling,Tel:(0577)55579220,E-mail:zslhospital@163.com
R969
:A
:1000-3002(2014)06-0892-06
10.3867/j.issn.1000-3002.2014.06.012
Foundation item:The project supported by Science and Technology Foundation of Wenzhou City(H20100070);Natural Science Foundation of Zhejiang Province(Y2110944);and Natural Science Foundation of Zhejiang Province (LY12H1004)
2014-04-16 接受日期:2014-10-08)
(本文编辑:齐春会)
温州市科技计划项目(H20100070);浙江省自然科学基金(Y2110944);浙江省自然科学基金(LY12H10004)
潘晓东(1980-),女,主管技师,硕士,主要从事移植相关的基础与临床研究;郑少玲(1956-),女,主任医师,教授,硕士生导师,主要从事肾病和器官移植方面的临床研究。
郑少玲,Tel:(0577)55579220,E-mail: zslhospital@163.com
