拟南芥乙烯合成酶ACS基因家族研究进展
2014-03-21吕淑芳江静
吕淑芳江静
(1.河南大学生命科学学院 棉花生物学国家重点实验室,开封 475004;2.河南科技大学农学院,洛阳 471003)
拟南芥乙烯合成酶ACS基因家族研究进展
吕淑芳1,2江静1
(1.河南大学生命科学学院 棉花生物学国家重点实验室,开封 475004;2.河南科技大学农学院,洛阳 471003)
1-氨基环丙烷-1-羧酸(1-aminocyclopropane-1-carboxylic acid,ACC)合酶(ACC synthase,ACS)是乙烯生物合成的限速酶。ACS酶活性是ACC和乙烯调控植物生长发育的基础,其酶活性调节主要涉及转录启动、翻译后修饰、酶高级结构形成、生化特性等方面。简要总结拟南芥ACS酶活性研究进展。
ACS酶 活性调控 乙烯
植物激素乙烯(ethylene)是气体小分子(C2H4),不仅调节植物种子萌发、细胞伸长、组织分化、叶片和花的衰老脱落、果实成熟[1-8]等生长发育过程,还调控生物胁迫和非生物胁迫[9-11]等应答反应。多种逆境因子都可以增加乙烯生物合成量,并因此改变植物抵抗和耐受逆境胁迫能力。
植物乙烯生物合成是一系列酶促反应过程:首先腺苷蛋氨酸合成酶催化蛋氨酸与腺苷酸(AMP)反应生成腺苷蛋氨酸(SAM);然后,SAM由ACC合酶催化生成ACC;最后,ACC氧化酶(ACC oxidase,ACO)催化ACC发生氧化反应而生成乙烯[11-14]。其中,ACS催化SAM向ACC转化是关键的限速步骤,所以ACS被认为是ACC和乙烯生物合成的限速酶。现已从番茄、冬瓜、苹果、康乃馨、笋瓜、豇豆及拟南芥中克隆到一些ACS基因[15-18],这些同源的ACS酶活性调节过程各种各样。本研究着重介绍模式植物拟南芥ACS酶活性及其调控特点。
1 拟南芥ACS基因家族成员及其生理特性
拟南芥基因组包含12个ACS同源基因,分别分布在5条染色体上。家族成员之间的氨基酸序列相似性为32%-91%,核苷酸序列相似34%-84%[19],ACS蛋白序列具有7个相同的功能结构域和11个保守性位点,包含了辅基磷酸吡哆醛结合位点、底物特异性结合位点、磷酸化位点等结构信息。其中,ACS1缺少3个保守的氨基酸(T、N和P),没有酶促活性[20],ACS3的基因是假基因[19,21],ACS10和
ACS12执行氨基转移酶功能[19],其余9个ACS酶具有催化ACC生物合成功能。根据其蛋白C末端序列的差异分为3个类型,即TypeI:ACS1、2和6;TypeII:ACS4、5、8和9;TypeIII:ACS7、11[22-24](图1)。其中,TypeI有一个钙依赖蛋白激酶(Calcium-dependent protein kinase,CDPK)磷酸化位点和3个有丝分裂原蛋白激酶(Mitogen activated protein kinase,MAPK)磷酸化位点,TypeII仅有一个单独CDPK磷酸化位点,TypeIII没有以上所述蛋白激酶磷酸化位点。

图1 拟南芥ACS蛋白C端差异及其分类
研究表明,ACS蛋白序列和结构存在一定的保守性和差异性。就蛋白序列而言,肽链长度,分子量的不同,氨基酸的丰度、功能性位点各不相同[27];就结构特点而言,N末端序列的保守性、C末端序列的多样性等也不相同[28]。这些决定了其生化特性不同,如等电点、底物亲和力和最大反应速度的不同,对ACS抑制剂AVG、Sinefungin的敏感程度不同[19],同时也决定了其功能差异(表1)。
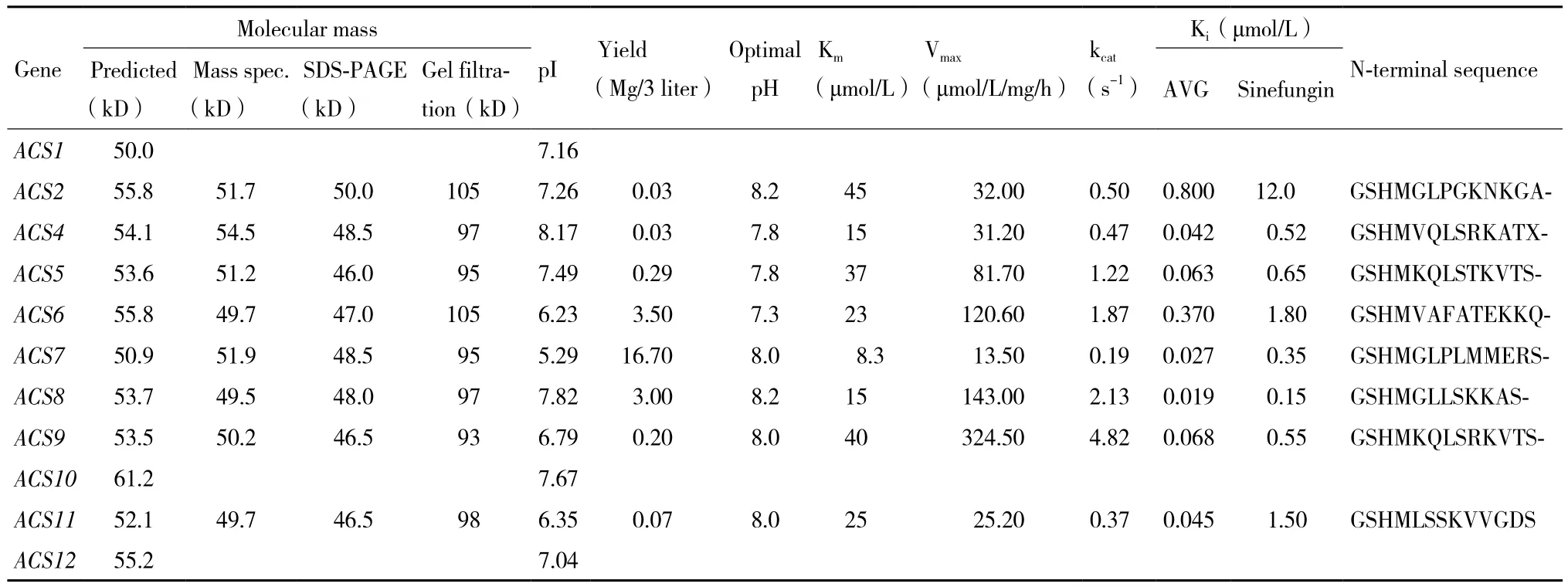
表1 ACS家族成员的生化指标[19]
拟南芥ACS酶活性直接关系到体内乙烯含量。野生型植株(Wild type,WT)的黄化苗过量产生乙烯(Ethylene over-produce),在ACS5和ACS9功能缺失突变体acs5、acs9或者acs5acs9这一过程受限[25,26],说明ACS5和ACS9是WT植株黄化苗时期乙烯过度产生的主效基因。光照条件下,5 d龄的WT植株中的乙烯含量高于功能缺损的acs1-1突变体;类似的功能缺失突变体acs4-1与acs9-1植株中的乙烯含量要显著高于WT;而单突变acs2-1,acs5-1 对乙烯含量的影响并不显著[29]。这些结果暗示,ACS酶活性随着植物生长发育阶段而改变,且各成员具有功能特异性。但是,令人费解的是,ACS1被认为无催化乙烯合成活性[29,30],acs1-1突变体却表现出乙烯含量显著变化。据此推测,单个ACS基因突变可能影响ACS基因家族整体表达水平的调节。
ACS单个成员具有功能特异性和专一性,主要表现在下胚轴伸长、开花时间和子叶面积的大小3个方面。acs1-1 和 acs9-1黑暗中生长的黄化幼苗下胚轴伸长得到促进,而acs4-1下胚轴长度受到抑制;光下生长的所有ACS单突变体下胚轴伸长得
到促进,子叶面积增加。acs1-1、acs6-1、acs7-1和acs9-1开花时间较WT提前,但acs6-1 acs7-1双突变体早花表型受到抑制,开花时间较WT延迟[29]。暗示ACS6和ACS7在调控开花时间方面可能存在功能拮抗作用。
2 ACS基因家族转录调控
基因的转录水平调控是植物应答各种信号刺激的重要过程。借助于基因芯片技术、Northern blot、定量PCR技术、GUS转基因和酶活性分析等技术,分析不同的生长发育时期、不同外界信号刺激下ACS基因家族的转录活性调节发现,ACS家族成员转录调控各有特点。
2.1 不同发育时期、不同器官组织中特点
除ACS9在发育后期表达外,拟南芥ACS家族其它基因在5 d的黄化苗、光下生长的幼苗及表皮细胞、保卫细胞、维管组织中均有表达[9,31-34];其中ACS11在萼片的香毛簇中特异表达,ACS1在胚座框中特异表达;而在拟南芥中胚轴、根、花的不同组织和长角果中表现为多个ACS基因共表达[21]。
2.2 不同环境因素调节的ACS表达特点
生物胁迫与非生物胁迫可改变ACS转录活性和乙烯合成。物理伤害虽然能抑制下胚轴中ACS1、ACS5的组成性表达,但却诱导ACS2、ACS4、ACS6、ACS7、ACS8的表达[21];冷处理抑制ACS5 和ACS11表达,且改变了ACS8表达模式;热处理增强了ACS4的mRNA含量,改变了ACS8和ACS11的表达模式;缺氧环境下诱导ACS2、ACS6、ACS7、ACS9的表达[21]。ACS基因转录活性也被外源激素所调控。IAA可提高ACS2、ACS4、ACS5、ACS6、ACS7、ACS8、ACS11在拟南芥根中的表达,特异的诱导拟南芥黄化苗中ACS4表达[32];油菜素内酯能够增强ACS4的mRNA含量[33]。同时,基因芯片结果(http://bar.utoronto.ca/efp)显示,处理150 mmol/L NaCl时,ACS家族各基因mRNA含量呈现不同的时间相关性。光照诱导ACS8表达呈现昼夜节律变化[35]。
ACS基因表达也会受到体内或体外乙烯水平自催化调节。ACS4、ACS 7、ACS9受到ACC显著性的诱导[34,36];ACS9在乙烯不敏感突变体etr1-1与ein2-1均表现为mRNA含量的下降,且ACC处理不能恢复ACS9的mRNA含量[37]。这些研究结果暗示,ACC处理对ACS酶活性诱导是必要而非充分的,同时也暗示了乙烯的自催化调节是通过乙烯受体感受乙烯信号后反馈调节ACS基因表达。
另外,张舒群等[38]报道ACS2和ACS6转录活性可被促有丝分裂活化蛋白激酶(Mitogen-activated protein kinase,MPK)3/MPK6和转录因子WRKY33所调控,从而影响乙烯的合成。
3 ACS家族蛋白水平调控
ACS是以磷酸吡哆醛为辅因子的胞质酶,半衰期很短,通常只有30 min到几小时[39-41]。ACS蛋白结构决定了自身的生化功能,保守性较低的C端往往是蛋白修饰位点;位于中间某些位置的Arg、Try是二聚体相互作用的位点。这些位点属于非酶活性位点,但是调节着ACS命运。
3.1 ACS家族蛋白修饰
广谱蛋白激酶抑制剂K252a或十字孢碱(Staurosporine)能够抑制真菌诱导剂对番茄悬浮细胞ACS酶活性的诱导作用[42],而用蛋白磷酸化酶抑制剂花萼海绵诱癌素A(Calyculin A)处理番茄后能够组成型的诱导ACS酶活性[42,43],说明磷酸化可以调节ACS活性。进一步的研究证明,磷酸化对ACS活性的调节是通过对其稳定性的调节来改变ACS活性[22,44,45]。
TypeI和TypeII ACSs在没有乙烯存在时通过蛋白酶体降解。对于TypeI ACSs,乙烯的存在可能诱导E3识别位点的磷酸化从而阻止了E3的识别。TypeII ACSs,其降解受到拟南芥3个BTB 结构域的E3180 连接酶的作用,其适配器蛋白是ETO1、EOL1和EOL2。其中ETO1与cullin3和AtACS5互作,ETO1表达的破坏导致了ACS5的稳定性和持续乙烯的合成,所以ETO1可能作为一个特异的底物适配器介导AtACS5的降解[46-48]。ACS4、ACS8和ACS9具有与ACS5相似的C端,都含有类似的丝氨酸位点,同时ACS5蛋白的C端丝氨酸位点被证明是CDPK磷酸化位点[49]。XBAT32是E3连接酶环指区域的一个蛋白,酵母双杂交显示XBAT32能与ACS4和ACS7相互作用,修饰ACS蛋白负调控乙烯的合成,从而调控拟南芥侧根的发育[50-52]。
14-3-3蛋白在乙烯信号传递中发挥一定的作用,14-3-3蛋白可能通过结合ACS磷酸化的C末端来调节ACS的活性,保护ACS在乙烯生物合成时不被降解。用串联亲和纯化标签(Tandem affinity purification,TAP)标记拟南芥14-3-3ω(At1g78300),并在转基因植物中表达。串联MS分析纯化复合物,结果表明14-3-3蛋白能与121个蛋白相互作用,其中包括参与乙烯合成的ACC合成酶(ACS-6、-7和-8)[53]。 最近,Huang等[54]证明14-3-3与ACS7相互作用参与根的向重力性。Yao等[55]通过酵母双杂交系统,证明在酵母细胞中水稻14-3-3蛋白和ACS能发生相互作用。

图2 ACS蛋白在乙烯合成中的调控模式[58]

表2 ACS蛋白之间互作[8]
番茄成熟后期,Le-ACS2位于C端的第460位氨基酸被磷酸化后,表现出乙烯的过量产生,而Le-ACS4并没有表现出磷酸化[22]。说明ACS蛋白磷酸化是由其蛋白结构决定的,更准确地说是由其C末端的序列决定的[56,57]。植物体内、体外因子都可以改变ACS蛋白的磷酸化进程。正常条件下,ACS表现出低活性,当植物受到外界刺激的时候,能够迅速产生乙烯,蛋白激酶通过直接与ACS相互作用并对其磷酸化来参与这一过程。拟南芥I型ACS家族成员具有保守的MPK3和MPK6作用位点,ACS2、6能够被MPK6磷酸化[45,57]。II型与III型的ACS家族成员不具备MPK磷酸化位点(图2),当ACS6没有被磷酸化的情况下,能够被迅速形成的26S蛋白酶复合体降解,而磷酸化的作用就是抑制蛋白酶复合体对C端的结合,从而改变其蛋白稳定性[56]。验发现,ACS蛋白之间能够形成同源二聚体与异源二聚体,位于其肽链中间位置的Arg、Try是二聚体相互作用位点。不同的二聚体具有不同的生化特性,也决定了不同的蛋白纯化条件[36],同时表现出不同的酶活力[59],包括对底物SAM结合的米氏常数(Km值:8.3-4 mol/L)、催化常数(kcat值:0.19-4.82 s-1)和对抑制剂AVG的抑制常数(Ki值:0.019-0.8 mol/L)。但并不是所有的二聚体都具有酶活力。ACS单体间能够形成25个具有酶活力的二聚体与20个不具有酶活力的二聚体。除了ACS1外,拟南芥ACS家族其他蛋白同源二聚体都具有酶活力(表2)。ACS7能够与TypeI和TypeII的ACS单体形成功能性的异源二聚体。意外的是,ACS1同源二聚体不具备酶活力,但能够与ACS2和ACS6形成具有酶活力的异源二聚体[9]。但是,迄今为止,这些二
3.2 ACS蛋白互作
通过大肠杆菌(E. coli)ACS蛋白体外纯化实
聚体如何形成,以何种方式结合,亚细胞定位以及具有什么样的生物学调控功能与意义都还不确定。
4 小结
ACS每个基因成员的表达调控受不同胁迫因素的诱导,基因的表达也较为复杂,其调节主要发生在转录水平上,同时也发生在翻译水平上[60,61]。因此,乙烯生物合成的调控可能存在多种因素,通过不同的调控因子分别接受不同的刺激,诱导特定的ACS的表达[62-65],同时也通过所编码蛋白的氨基酸序列的差异决定其反应的动力学性质及乙烯生物合成的速度[13,65]。但是到目前为止,调控ACS表达的转录因子、转录调控的信号通路等都鲜少报道。
乙烯生物合成途径中的ACC合成酶基因不断被分离克隆,有的已经通过基因工程技术,将其转入到不同的物种中,通过转基因技术来调控植物ACC合成酶基因的表达。但植物体内参与乙烯生物合成的ACC合成酶基因的数目及特性尚不清楚。今后,需要进一步从分子和蛋白水平上进行研究。
[1]Hidenori T, Takahiro I, Tetsuhito S, et al. Isolation and characterization of the ACC synthase genes from lettuce and the involvement in low pH-induced root hair initiation[J]. Plant Cell Physiol, 2003, 44(1):62-69.
[2]Yuri T, José RB. Silencing of the ACC synthase gene ACACS2 causes delayed flowering in pineapple[J]. J Exp Bot, 2006, 57(14):3953-3960.
[3]Salman MA, Levi A, Wolf S, et al. ACC synthase genes are polymorphic in watermelon and differentially expressed in flowers and in response to auxin and gibberellin[J]. Plant Cell Physiol, 2008, 49(5):740-750.
[4]Muñoz-robredo P, Rubiob P, Infanteb R, et al. Ethylene biosynthesis in apricot:Identification of a ripening-related 1-aminocyclopropane-1-carboxylic acid synthase(ACS)gene[J]. Postharvest Biol Technol, 2012, 63(1):85-90.
[5]Akira N, Shinjiro S, Yasutaka K, et al. Expression and internal feedback regulation of ACC synthase and ACC oxidase genes in ripening tomato fruit[J]. Plant Cell Physiol, 1997, 38(10):1103-1110.
[6]Yoon GM, Kieber JJ. 1-Aminocyclopropane-1-carboxylic acid as a signalling molecule in plants[J]. Aob Plants, 2013, 5:plt017.
[7]Xia LS, Keller JA, Shen NF. The 1-aminocyclopropane-1 -carboxylate synthase gene family of Arabidopsis thaliana[J]. Proc Natl Acad Sci USA, 1992, 89(22):11046-11050.
[8]Wang A, Li T, Harada T. The regulation of 1-aminocyclopropan-1-carboxylate synthase genes on fruit shelf life of apple[J]. Eur J Hortic Sci, 2011, 76(8):77-83.
[9]Wang NN, Shih MC, Li N. The GUS reporter-aided analysis of the promoter activities of Arabidopsis ACC synthase genes ACS4, ACS5, and ACS7 induced by hormones and stresses[J]. J Exp Bot, 2005, 56(3):909-920.
[10]Wi SJ, Park KY. Antisense expression of carnation cDNA encoding ACC synthase or ACC oxidase enhances polyamine content and abiotic stress tolerance in transgenic tobacco plants[J]. Mol Cells, 2002, 13(2):209-220.
[11]Young TE, Meeley RB, Gallie DR. ACC synthase expression regulates leaf performance and drought tolerance in maize[J]. Plant J, 2004, 40(2):813-825.
[12]Lin ZF, Zhong S, Dong G. Recent advances in ethylene research[J]. J Exp Bot, 2009, 60:3311-3336.
[13]Zeinolabedin J. Ethylene Biosynthesis[J]. Tech J Engin & App Sci, 2012, 1(4):107-110.
[14]Argueso CT, Hansen M, Kieber JJ. Regulation of ethylene biosynthesis[J]. J Plant Growth Regul, 2007, 26(2):92-105.
[15]Boller T, Herner R, Kende H. Assay for and enzymatic formation of an ethylene precursor, 1-aminocyclopropane-1-carboxylic acid[J]. Planta, 1979, 145(3):293-303.
[16]Johnson PR, Ecker JR. The ethylene gas signal transduction pathway:a molecular perspective[J]. Annu Rev Genet, 1998, 32:227-254.
[17]Ge L, Liu J, Wong W, et al. Identification of a novel multiple environmental factor-responsive 1-aminocyclopropane-1-carboxylate synthase gene, NT-ACS2, from tobacco[J]. Plant Cell Environ, 2000, 23(11):1169-1182.
[18]Shi HY, Zhang YX, Chen L. Cloning, characterization and expression analysis of a 1-aminocyclopropane-1-carboxylate synthase gene from pear[J]. Can J Plant Sci, 2013, 93(3):465-471.
[19]Yamagami T, Tsuchisaka A, Yamada K, et al. Biochemical diversity among the 1-amino-cyclopropane-1- carboxylate synthase isozymes encoded by the Arabidopsis gene family[J]. J Bio Chem, 2003,
278(49):49102-49112.
[20]Liang XW, Abel S, Keller JA, et al. The 1-aminocyclopropane-1-carboxylate synthase gene family of Arabidopsis thaliana[J]. Proc Natl Acad Sci USA, 1992, 89(22):11046-11050.
[21]Tsuchisaka A, Theologis A. Heterodimeric interactions among the 1-amino-cyclopropane- 1-carboxylate synthase polypeptides encoded by the Arabidopsis gene family[J]. Proc Natl Acad Sci USA, 2004, 101(8):2275-2280.
[22]Yoshida H, Nagata M, Saito K, et al. Arabidopsis ETO1 specifically interacts with and negatively regulates type 2 1-aminocyclopropane-1-carboxylate synthases[J]. BMC Plant Biol, 2005, 5:14-20.
[23]Wang KL, Yoshid AH, Lurin C, et al. Regulation of ethylene gas biosynthesis by the Arabidopsis ETO1 protein[J]. Nature, 2004, 428(6986):945-950.
[24]Hansen M, Chae HS, Kieber JJ. Regulation of ACS protein stability by cytokinin and brassinosteroid[J]. Plant J, 2009, 57(4):606-614.
[25]Woeste KE, Ye C, Kieber JJ. Two Arabidopsis mutants that overproduce ethylene are affected in the posttranscriptional regulation of 1-aminocyclopropane -1-carboxylic acid synthase[J]. Plant Physiol, 1999, 119(2):521-530.
[26]Vogel JP, Woeste KE, Theologis A, et al. Recessive and dominant mutations in the ethylene biosynthetic gene ACS5 of Arabidopsis confer cytokinin insensitivity and ethylene overproduction, respectively[J]. Proc Natl Acad Sci USA, 1998, 95:4766-4771.
[27]Zhang TC, Qiao Q, Zhong Y. Detecting adaptive evolution and functional divergence in aminocyclopropane-1-carboxylate synthase(ACS)gene family[J]. Comput Biol Chem, 2012, 38:10-16.
[28]Choudhury S, Roy S, Sengupta D. C-terminal phosphorylation is essential for regulation of ethylene synthesizing ACC synthase enzyme[J]. Plant Signal Behav, 2013, 8:e23000.
[29]Tsuchisaka A, Yu G, Jin H, et al. A combinatorial interplay among the 1-aminocyclopropane- 1-carboxylate isoforms regulates ethylene biosynthesis in Arabidopsis thaliana[J]. Genetics, 2009, 183(3):979-1003.
[30]Liang X, Oono Y, Shen NF, et al. Characterization of two members(ACS1 and ACS3)of the 1-aminocyclopropane-1-carboxylate synthase gene family of Arabidopsis thaliana[J]. Gene, 1995, 167(1-2):17-24.
[31]Toufighi K, Brady SM, Austin R, et al. The botany array resource: e-northerns, expression angling, and promoter analyses[J]. Plant J, 2005, 43(1):153-163.
[32]Tsuchisaka A. Unique and overlapping expression patterns among the Arabidopsis 1-amino-cyclopropane-1-carboxylate synthase gene family members[J]. Plant Physiol, 2004, 136(2):2982-3000.
[33]Joo S, Seo YS, Kim SM, et al. Brassinosteroid induction of AtACS4 encoding an auxin-responsive 1-aminocyclopropane-1-carboxylate synthase 4 in Arabidopsis seedlings[J]. Physiologia Plantarum, 2006, 126(4):592-604.
[34]Tang X, Chang L, Wu S, et al. Auto-regulation of the promoter activities of Arabidopsis 1-aminocyclopropane-1-carboxylate synthase genes ACS4, ACS5, and ACS7 in response to different plant hormones[J]. Plant Sci, 2008, 175(1-2):161-167.
[35]Simon CT, Filip V, Lucas JJ, et al. Circadian rhythms of ethylene emission in Arabidopsis[J]. Plant Physiol, 2004, 136(11):3751-3761.
[36]Peng HP, Lin TY, Wang NN, et al. Differential expression of genes encoding 1-aminocyclopropane-1-carboxylate synthase in Arabidopsis during hypoxia[J]. Plant Mol Biol, 2005, 58(1):15-25.
[37]Jose MA, Takashi H, Gregg R, et al. EIN2, a bifunctional transducer of ethylene and stress responses in Arabidopsis[J]. Science, 1999, 284(5423):2148-2152.
[38]Li G, Meng X, Wang R, et al. Dual-level regulation of acc synthase activity by mpk3/mpk6 cascade and its downstream wrky transcription factor during ethylene induction in Arabidopsis[J]. PLoS Genet, 2012, 8(6):e1002767.
[39]Chae HS, Faure F, Kieber J. The eto1, eto2 and eto3 mutations and cytokinin treatment crease ethylene biosynthesis in Arabidopsis by increasing the stability of ACS protein[J]. Plant Cell, 2003, 15:1-15.
[40]Yip WK, Dong JG, Kenny JW, et al. Characterization and sequencing of the active site of 1-aminocyclopropane-1-carboxylate synthase[J]. Proc Natl Acad Sci USA, 1990, 87:7930-7934.
[41]Bleecker AB, Kendeh. Ethylene:a gaseous signal molecule in plants[J]. Annu Rev Cell Dev Biol, 2000, 16(1):1-18.
[42]Grosskopf DG, Felix G, Boller T. K-252a inhibits the response of tomato cells to fungal elicitors in vivo and their microsomal protein kinase in vitro[J]. FEBS Lett, 1990, 275(1-2):177-180.
[43]Felix G, Grosskopf DG, Regenass M, et al. Elicitor-induced
ethylene biosynthesis in tomato cells characterization and use as a bioassay for elicitor action[J]. Plant Physiol, 1991, 97(1):19-25.
[44]Sunjoo J, Liu YD, Abraham L, et al. MAPK phosphorylationinduced stabilization of ACS6 protein is mediated by the noncatalytic C-terminal domain, which also contains the cis-determinant for rapid degradation by the 26S proteasome pathway[J]. Plant J, 2008, 54(1):129-140.
[45]Han L, Li GJ, Yang KY, et al. Mitogen-activated protein kinase 3 and 6 regulate botrytis cinerea-induced ethylene production in Arabidopsis[J]. Plant J, 2010, 64(1):114-127.
[46]Delaure SL, van Hemelrijck W, De Bolle MFC, et al. Building up plant defenses by breaking down proteins[J]. Plant Sci, 2008, 174(4):375-385.
[47]Wang KL, Yoshida H, Lurin C, et al. Regulation of ethylene gas biosynthesis by the Arabidopsis ETO1 protein[J]. Nature, 2004, 428(6986):945-950.
[48]Chae HS, Faure FKieber JJ. The eto1, eto2, and eto3 mutations and cytokinin treatment increase ethylene biosynthesis in Arabidopsis by increasing the stability of ACS protein[J]. Plant Cell, 2003, 15(2):545-559.
[49]Spanu P, Grosskopf DG, Felix G, et al. The apparent turnover of 1-aminocyclopropane-1 -carboxylate synthase in tomato cells is regulated by protein phosphorylation and dephosphorylation[J]. Plant Physiol, 1994, 106(2):529-535.
[50]Prasad ME, Schofield A, Lyzenga M, et al. Arabidopsis RING E3 ligase XBAT32 regulates lateral root production through its role in ethylene biosynthesis[J]. Plant Physiol, 2010, 153:1587-1596.
[51]Wendy J, Lyzenga M, Judith K, et al. The Arabidopsis RING-type E3 ligase XBAT32 mediates the proteasomal degradation of the ethylene biosynthetic enzyme, 1-aminocyclopropane-1-carboxylate synthase 7[J]. Plant J, 2012, 71(1):23-34.
[52]Prasad ME, Stone SL. Further analysis of XBAT32, an Arabidopsis RING E3 ligase, involved in ethylene biosynthesis[J]. Plant Signal Behav, 2010, 5(11):1425-1429.
[53]Chang IF, Curran A, Woolsey R, et al. Proteomic profiling of tandem affinity purified 14-3-3 protein complexes in Arabidopsis thaliana[J]. Proteomics, 2009, 9(11):2967- 2985.
[54]Huang SJ, Chang CL, Wang PH, et al. A typeIII ACC synthase, ACS7, is involved in root gravitropism in Arabidopsis thaliana[J]. J Exp Bot, 2013, 14(64):4343-4360.
[55]Yao Y, Du Y, Jiang L, et al. Interaction between ACC synthase 1 and 14-3-3 proteins in rice:a new insight[J]. Biochemistry(Moscow), 2007, 72(9):1003-1007.
[56]Skottke KR, Yoon GM, Kieber JJ. Delong a protein phosphatase 2a controls ethylene biosynthesis by differentially regulating the turnover of acc synthase isoforms[J]. PLoS Genet, 2011, 7(4):e1001370.
[57]Tatsuki M. Phosphorylation of tomato 1-aminocyclopropane-1-carboxylic acid synthase, LE-ACS2, at the C-terminal region[J]. J Biol Chem, 2001, 276(30):28051-28057.
[58]McManus MT. The plant hormone ethylene[M]. New York:John Wiley Sons, 2012.
[59]Kende H. Ethylene biosynthesis[J]. Annu Rev Plant Physiol Plant Mol Biol, 1993, 44(1):283-307.
[60]Woeste KE, Ye C, Kieber JJ. Two Arabidopsis mutants that overproduce ethylene are affected in the post-transcriptional regulation of 1-aminocyclopropane-1-carboxylic acid synthase[J]. Plant Physiol, 1999, 119(29):521-529.
[61]Varanasi V, Shin S, Mattheis J, et al. Expression profiles of the Md-ACS3 gene suggest a function as an accelerator of apple(Malus× domestica)fruit ripening[J]. Postharvest Biol Technol, 2011, 62(2):141-148.
[62]Mark LT, Xue P, Yang RH. 1-Aminocyclopropane-1-carboxylic acid(ACC)concentration and ACC synthase expression in soybean roots, root tips, and soybean cyst nematode(Heterodera glycines)-infected roots[J]. J Exp Bot, 2010, 61 : 463-472.
[63]Tan DM, Li TZ, Wang AD. Apple 1-aminocyclopropane-1-carboxylic acid synthase genes, MdACS1 and MdACS3a, are expressed in different systems of ethylene biosynthesis[J]. Plant Mol Biol Rep, 2013, 31(1):204-209.
[64]Shi HY, Zhang YX, Sun W. Molecular characterization of pear 1-aminocyclopropane-1-carboxylate synthase gene preferentially expressed in leaves[J]. J Agr Sci, 2012, 4(6):72-79.
[65]Wang KL, Yoshida H, Lurin C, et al. Regulation of ethylene gas biosynthesis by the Arbidopsis ETO1 protein[J]. Nature, 2004, 428(6986):945-950.
(责任编辑 狄艳红)
Review of Arabidopsis 1-Aminocyclopropane-1-Carboxylic Acid Synthases
Lü Shufang1,2Jiang Jing1
(1. State Key Laboratory of Cotton Biology,College of Life Science,Henan University,Kaifeng 475004;2. College of Agricultural,Henan University of Science and Technology,Luoyang 471003)
1-aminocyclopropane-1-carboxylic acid(ACC)synthase(ACS)is the key rate-limiting enzyme of ethylene biosynthesis. The activity of ACS enzyme is the basis of ACC or ethylene regulates plant growth and development. This regulation is mainly involved in various levels:transcription, post-transcriptional modification, enzyme structure formation, biochemical characteristics, and so on. Here we briefly review the research progresses of ACS enzymic activity.
ACS enzyme Activity regulation Ethylene
2014-03-27
国家自然科学基金项目(31271510)
吕淑芳,女,讲师,硕士研究生,研究方向:植物学与分子生物学;E-mail:lvshufang780515@sina.com
江静,博士,教授,研究方向:植物抗逆生理与分子生物学;E-mail:jiangjing@henu.edu.cn
