毒素蛋白基因mazF在基因修饰系统中的应用进展
2014-03-21石杨董会娜张大伟
石杨董会娜张大伟
(1.天津大学药物科学与技术学院,天津 300072;2.中国科学院天津工业生物技术研究所,天津 300308)
毒素蛋白基因mazF在基因修饰系统中的应用进展
石杨1,2董会娜2张大伟2
(1.天津大学药物科学与技术学院,天津 300072;2.中国科学院天津工业生物技术研究所,天津 300308)
毒素-抗毒素系统(Toxin-antitoxin system,TA系统)存在于大部分细菌中。mazEF是大肠杆菌中一种毒素-抗毒素系统。毒素基因mazF编码的MazF毒素蛋白可以特异性地剪切自由mRNA的ACA序列,从而抑制蛋白合成、引起细胞生长停滞;近些年,许多学者利用mazF基因作为反向筛选标记对不同种微生物建立了无标记或无痕的基因修饰系统,并实现了不同菌株的基因组修饰。主要综述了大肠杆菌mazF基因作为反向筛选基因的应用原理及其在不同种类微生物的基因修饰系统中的应用进展,然后对mazF基因及其他毒素基因在基因修饰系统中的应用进行了展望。
mazF 毒素蛋白基因 反向筛选标记 基因修饰方法
近年来,随着后基因组学研究(如基因组简化工程、反向代谢工程和合成生物学)的快速发展,人们更加需要简单高效的遗传操作工具来对多基因进行修饰以研究分子生物学机制。基因修饰系统中常用的方法包括位点特异性重组(FRT/Flp、Cre/lox等)[1,2],嘌呤代谢基因或代谢途径中相关基因及其他阻遏蛋白基因和启动子作为反向筛选标记的操作方法[3-6]等。但位点特异性重组会在修饰的基因处留有疤点(Scar),而以嘌呤代谢基因或代谢途径中相关基因为反向筛选标记的方法需要在基因组上缺失特定的基因才能发挥作用。mazF基因作为反向筛选标记在基因修饰系统中应用可以克服上述方法的缺点,因此,它作为新的分子改造工具,越来越广泛地被用于多种微生物的遗传改造中。本文对mazF基因在基因修饰系统中的作用机理和应用进展进行了综述,并对其应用进行了展望。
1 mazF的作用机理
mazEF是一类研究最为广泛,作用机理鉴定最为清晰的毒素-抗毒素系统(TA系统),Ⅱ类TA分类系统根据同源性分为6个组,分别为:kid家族(kid/kis、toxiN、mazEF、ccdAB和ydcDE),relE家族(relBE、yoeB/yefM、mqsAR和parDE),doc家族(phD/doc),vapC家族(vapBC、fitAB),hipA家族(hipAB、pezAT)和ξ家族(ξ/ε),mazEF属于kid
家族[7]。mazF基因是TA系统mazEF的下游基因,编码稳定的毒素蛋白。MazF是一种不依赖于核糖体的mRNA干扰酶(核糖核酸内切酶),能在特异的序列位点切割单链的mRNA,并且在大多数微生物和一些古生菌种中具有保守性。大肠杆菌的MazF蛋白最早被发现,随后学者们发现了一系列具有不同mRNA切割位点的MazF结构类似物和其他的mRNA干扰酶。目前,鉴定的MazF结构类似物能够特异性的在3或5或7个碱基的特定序列处切割mRNA[8]。
大肠杆菌的MazF能识别ACA序列并水解其第一个A位点5'或3'端的磷酸二酯键,从而抑制被剪切断裂的mRNA上核糖体的释放和蛋白的合成[9]。此后,异常编码的多肽被释放,并被胞内蛋白酶降解,继而造成细胞死亡。MazE抗毒素蛋白形成特殊构象后,能识别并结合MazF毒素蛋白而使MazF失去毒性。相比5个碱基或7个碱基的特定序列,3个碱基的特定序列在基因中出现的概率更大。大肠杆菌的MazF蛋白能够裂解几乎所有的mRNA,但是仍然有一些mRNA能够抵抗MazF,这些mRNA或者不含ACA序列或者其中的ACA序列被mRNA形成的二级结构保护而避免被MazF切割[10]。
大肠杆菌的MazF蛋白的作用机理研究得最为清楚,过表达或诱导表达MazF蛋白可以抑制蛋白的合成进而导致细胞死亡,在其他种类的微生物中mazF亦能发挥毒性作用,从而在遗传修饰系统中被用作能够致死的反向筛选标记。
2 mazF在基因修饰系统中的应用
在宿主细胞中表达MazF,不但能引起E.coli的细胞程序性死亡,同样也可以引起其他原核生物,如芽孢杆菌、梭杆菌和真核生物如毕赤酵母的程序性死亡[11-13]。MazF蛋白能在不同种类的微生物中发挥作用的前提,是编码这些菌株生长和存活的必须蛋白的mRNA上含有ACA序列。目前,mazF基因作为分子改造工具,在微生物的遗传改造中已有广泛地应用。mazF筛选盒(mazF-cassette)构成如图1所示,共3部分,分别为:正向筛选基因(一般为抗性基因)及其启动子(Selectable gene和P);毒素蛋白启动子的抑制蛋白基因;毒素蛋白基因和常用诱导表达型启动子,如Pspac和Pxyl。此方法在不同的微生物中应用时,需要把筛选盒中的正向筛选基因和控制mazF表达的表达调控系统替换为在该宿主菌种发挥作用的正向筛选基因和表达调控系统。
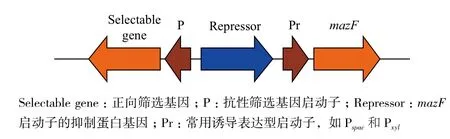
图 1 mazF筛选盒示意图
2.1 mazF在芽孢杆菌属中的应用
2006 年,Zhang等[14]首次用大肠杆菌(E.coli)的mazF基因在芽孢杆菌属(Bacillus species)中建立了一种普适无标记的基因修饰系统。在此基因修饰系统中受异丙基硫代半乳糖苷(IPTG)诱导的启动子Pspac、mazF及奇霉素(Spectomycin)抗性基因一起构成了MazF筛选盒(图2-A),Pspac受IPTG的诱导而启动mazF的转录表达。其两侧是两个直接重复序列(Directly-repeated,DR)。线性的质粒与基因组发生双交换同源重组,mazF表达盒被整合到基因组的目的位点上。获得的重组菌菌株对IPTG敏感,有奇霉素抗性。然后,两个DR片段发生单交换同源重组,MazF筛选盒被删除,重组后菌株对IPTG有抗性,对奇霉素敏感。此方法可以将需要的遗传改变引入到基因组上而不引入任何筛选标记。
这种方法也有一定的缺陷:首先,这种基于克隆基因修饰方法需要约2周时间;其次,在枯草芽孢杆菌(B. subtilis)中[15]spac表达系统诱导效率低,在缺乏诱导物时会产生泄露表达[16-18]。mazF显著的泄露表达会造成自发突变的MazF抗性突变株累积,降低分离筛选得到目的突变菌株的阳性率。
随后,Morimoto等[19]将IPTG诱导的Pspac系统与高保真融合PCR方法结合建立了一种新方法。他们设计了与mazF筛选盒相结合的双交换序列和一个用于删除筛选盒的单交换序列。这个方法成功地删除了长度从8.5 kb到128 kb不等的序列。与Zhang等[14]的方法相比,这个操作过程可以在更短的时间内完成。然而此法仍有其局限性,如少量的泄露表达,4.0 kb PCR融合片段会增加DNA突变的概率而且不同的基因片段组装也有一定的难度。
启动子PxylA受木糖阻遏蛋白XylR的抑制。当木糖出现时,XylR离开操纵子序列,PxylA被激活。巨大芽孢杆菌(B. megaterium)的xyl操纵子是一个特别严谨的转录调控系统。Yu等[20]把mazF基因放在B. megaterium的启动子PxylA之后,mazF受木糖诱导表达(图2-B)。在B. subtilis基因组上引入突变的无标记基因修饰方法。此方法中mazF基因受来自B. megaterium的xyl表达系统的调控。因B. megaterium的xyl表达系统严格进行转录调控,且有更高的诱导效率,相对于spac表达系统具有显著的优越性[18,21]。但需要融合长约3.9 kb的片段和抗mazF的自发突变菌株的产生仍是这种方法的不足。
有文献报道B. subtilis的启动子Pxyl也具有严格的转录调控[22,23]。而且B. subtilis W23的启动子Pxyl显示比B. megaterium的Pxyl启动子有更高的诱导/表达效率(246-279倍/150-200倍)[16,18]。Lin等[24]构建的“mini-mazF-cassette”筛选盒(图2-C),其包含B. subtilis的启动子Pxyl,mazF和微型的博莱霉素(Zeocin)抗性基因。用此筛选盒成功地敲除了amyE基因、一个90 kb的基因簇和一个绿色荧光蛋白基因。mini-mazF-cassette可以重复的对多个基因或基因簇进行操作,而且融合片段只有2-2.5 kb,这就可以减小PCR带来的核酸突变频率。Lin的方法比上述两种mazF-cassettes的转化效率高3倍,而且所有克隆中有超过95%的菌株都能丢掉筛选盒,而Yu的方法中只有50%[20]。
本课题组在改造B.subtilis基因组时尝试应用upp基因(编码尿嘧啶磷酸核糖基转移酶,催化5-氟尿嘧啶生成5-氟尿嘧啶脱氧核苷酸而使菌体致死)和mazF基因为反向筛选标记,初步结果表明以mazF为反向筛选标记方法有阳性率更高的优势。upp基因作为反向筛选标记时需失活出发菌的upp基因,使其能在含有5-氟尿嘧啶的基本培养基上生长,而mazF作为反向筛选标记时对出发菌的背景就无要求(数据未发表),且试验周期相比较短。
2.2 mazF在毕赤酵母中的应用
Yang等[12]用大肠杆菌的mazF作为反向筛选基因在甲醇营养型酵母——毕赤酵母中建立了一种无标记基因修饰方法。mazF的表达受甲醇诱导型启动子PAOX1控制,毕赤酵母中MazF被诱导表达后终止细胞的生长。他们构建了一个模块化质粒,mazF和博莱霉素抗性基因分别作为反向筛选标记和正向筛选标记,其中的mazF-ZeoR表达框的两侧包含CYCl TT同向重复重组位点和多克隆位点(图2-D)。通过模块化质粒可以构建引入基因修饰的递送质粒。将递送质粒线性化后转化毕赤酵母,通过同源重组将基因修饰引入毕赤酵母基因组。用博莱霉素筛选出基因改造的菌株,再用甲醇诱导表达MazF,通过CYCl TT同向重复重组位点之间同源重组实现遗传标记的再利用。应用这种方法,研究者在不引入筛选标记的情况下,实现了毕赤酵母ARG1和MET2基因的敲除,一个绿色荧光蛋白表达盒的敲入和ARG1基因的定点突变。这种方法可以使筛选标记基因重复用于多个基因修饰。
2.3 mazF在梭菌属中的应用
梭菌属是产孢子的革兰氏阳性细菌,属于厚壁菌门。这个属的成员是专性厌氧菌,包含许多有医学和商业价值的重要菌株。但分离得到基于等位基因交换产生的基因替换突变菌株仍然是这些重要菌株应用的主要限制。
Dong等[25]发现mazF基因在丙酮丁醇梭菌(Clostridium acetobutylicum)中也可发挥反筛选作用,此发现对丙酮丁醇梭菌的基因操作工具的开发有一定的促进作用。mazF基因的诱导表达可以用于ClosTron系统中便携质粒的固化从而使基因失活,或者用于同源重组基因敲除方法中快速筛选双交换突变株[26]。Al-Hinai等[27]报道了一种利用可诱导的反向筛选标记的基因修饰方法,此方法无需营养缺陷型突变株或者应用可移动的II类内含子,就可快速高效的在基因组的任意位点实现无标记的DNA缺失和整合。这个方法中将来自大肠杆菌的经密码子优化的mazF毒素基因放在来自产气荚膜梭菌(Clostridium perfringens)的乳糖诱导型启动子Pgal之后。启动子Pgal控制MazF的表达,可在含乳糖和抗生素的固体培养基上直接筛选出目的基因被删除的突变株。进而作者又建立了一个可诱导可隔离的不稳定质粒系统可以使编码硫霉素抗性的基因快速缺失,即结合FLP-FRT位点特异性重组系统[28]
(图2-E),在质粒上下游同源臂内的抗性标记基因两侧加上了FRT序列。重组完成后,通过在突变株中表达FLP重组酶剔除抗性基因,以便该抗性基因可被继续用作筛选标记。该方法既可实现基因敲除亦可实现外源基因在染色体上的敲入。大多数梭菌属菌种的基因组有相似的低G+C含量和类似的密码子使用率,因此这个系统有可能应用到这些菌株中。但该方法会在删除基因的位置留下一段FRT疤痕(Scar),并未真正实现基因无痕删除。随着基因敲除数量的增加,染色体上的FRT疤痕会随之增多,当有FLP重组酶存在时,可能引起这些FRT短序列之间的重组,从而造成非预期的基因序列缺失。故在一定程度上限制了这种方法的应用。
2.4 mazF在蓝藻细菌中的应用
蓝藻菌集胞藻属是光合生物,能有效的集合光能同时利用环境中的CO2。集胞藻属有两个主要的变种,一个变种(认为是野生型,WT)只能光合自养生长,第二个变种(葡萄糖耐受型菌,GT)既可光合自养也可进行光合异养生长。GT型集胞藻属可以利用来自枯草芽孢杆菌的sacB基因作为反向筛选标记,但WT型不可以,因为sacB编码的果聚糖蔗糖酶可将蔗糖转化为果聚糖将WT型细胞杀死。
Cheah等[29]建立了一种新的可用于GT和WT型集胞藻属基因修饰方法。研究者用集胞藻属自有的镍响应系统(nrs)来控制mazF的表达。此响应系统在Ni2+的浓度很低(约0.5 μmol/L)时就可以被诱导表达[30]。镍响应系统由nrsBACD操纵子和其上游的两个基因nrsR和nrsS组成。nrsBACD操纵子主要将细胞质中额外的Ni2+泵出,nrsS和nrsR分别响应Ni2+和诱导启动子PnrsB启动转录[31]。受NrsR诱导的启动子PnrsB位于nrsR和nrsBACD操纵子的间隔区。NrsR、NrsS和启动子PnrsB被用来驱动mazF的表达。卡那霉素抗性基因(aphII)作为正筛选标记放在mazF的下游,形成mazF/aphII筛选盒(图2-F)。此方法中应用了两个质粒,一个含有筛选盒和目的基因的上下游同源臂;另一个则只含有特定基因的上下游同源臂。通过第一次同源重组,第一个质粒与基因组发生基因交换将筛选盒整合到基因组的特定位点,利用卡那霉素抗性筛选正确的菌株。第二次同源重组是第二个质粒与第一步筛选到的菌株的基因组进行基因交换,用Ni2+筛选出弹掉筛选盒的菌株。此方法成功的用于slr1609基因的部分敲除和PHB(聚-β-羟基丁酸)合成基因(slr1993和slr1994)的完全敲除,也可将其他基因整合入特定的位点。此方法有可能应用于能进行同源重组的蓝藻细菌和藻类等的基因修饰。

图2 mazF筛选盒示意图[14,20,24,12,27,29]
3 其他毒素蛋白基因在基因修饰系统中的应用
除了mazEF外,ccdAB也是II类TA系统中研究和应用较多的毒素-抗毒素系统之一。ccdAB来自于F质粒,最初用于大肠杆菌中筛选阳性转化子[32]。CcdB蛋白通过抑制拓扑异构酶II的一个亚基旋转酶A来杀死细胞,CcdA蛋白可以解除CcdB蛋白的毒性活性。商用系统StabyCloningTM,StabyExpressTM和Delphi Genetics SA都是基于CcdB蛋白的毒性作用而使质粒稳定的保存。其应用方式有两种:一种是将ccdB基因整合到质粒的多克隆位点。获得的质粒
在缺少CcdA蛋白的情况下,其毒性可以杀死细菌。当在多克隆位点插入外源DNA片段后,ccdB失活,重组质粒不能产生CcdB蛋白,从而不会影响宿主细胞的生存。这种用于重组克隆的正筛选方法非常有效,并且简化了克隆程序。另一种是在基因组上整合ccdB基因,当含有ccdA的目的质粒转入细胞后,细胞生存,而未转入质粒的细胞则会因为CcdB蛋白的毒性作用而死亡。随后,研究者用来自质粒R1的毒素蛋白Gabant[33]和质粒RK2的ParE[34]研发了相似的技术。
灿烂弧菌(Vibrio splendidus)是海水中一种具有优势培养的弧菌,与一些海洋动物的死亡密切相关。但是菌株中编码致病蛋白的基因却知之甚少。牡蛎病原菌(V. splendidus)LGP32菌株的全基因组测序为通过候选基因的破坏而解密毒性蛋白提供了可能。Le等[35]构建了一种新的自杀质粒,该质粒包含依赖pir的R6K复制起始位点以及由启动子PBAD控制的来自质粒F的ccdB基因。其起始位点可以通过基于RP4的接合作用转移到任何弧菌。该自杀质粒通过两步等位基因替换作用可以将特定的基因敲除。首先,等位基因两端的任何一端均可与基因组发生等位交换,通过氯霉素筛选,选出正确整合菌株。然后,用含阿拉伯糖的培养基进行第二步筛选,只有菌株中带有PBAD-ccdB的质粒被重组掉后才能够在含阿拉伯糖的培养基上生长。该方法可以有效的在灿烂弧菌和霍乱弧菌(Vibrio cholerae)中进行无痕等位基因替换。
ccdB和parE基因等毒素基因在微生物筛选中开发应用较早较多,但是其在微生物的基因修饰方面应用却非常有限。这些毒素基因是非常有效的反向筛选标记,若将其应用到基因修饰方面,相信会发展出许多高效、准确的无标记基因修饰方法,丰富分子操作工具,极大地提高遗传操作的速度和效率。
4 毒素蛋白基因作为反向筛选标记的基因修饰策略
毒素蛋白基因(如mazF、ccdB)作为反向筛选基因应用于微生物基因修饰系统中是通过同源重组实现的。基因修饰策略主要分两步进行,第一步将整合片段插入到微生物的染色体上;第二步将筛选标记剔除。整合片段可以以质粒形式通过单交换或双交换同源重组整合到染色体上或者以融合PCR片段形式通过双交换同源重组整合到染色体上。筛选标记的剔除可以通过同源DNA片段或者直接重复片段进行重组而实现。以敲除为例,图3-图5分别为不同基因修饰策略的示意图。这些修饰策略实现了无痕敲除和筛选盒的再利用,即可以进行特定基因或大片段基因的敲除,亦可以进行基因点突变和相关基因的敲入。对于不同的微生物菌种应选用合适的策略。

图3 双交换,通过down片段同源重组实现的基因敲除

图4 单交换,通过up或down片段实现的基因敲除
毒素蛋白基因作为反向筛选基因应用于微生物基因修饰系统应满足以下要求:(1)基因修饰系统的目标菌株中编码其生长和存活的必须蛋白的mRNA应含有ACA序列,即保证MazF蛋白能够正
常发挥作用;(2)目标菌种中有能够发挥作用的正向筛选的抗性基因和可选用的诱导表达调控系统,以便第一步的正向筛选和mazF的诱导表达。

图5 双交换,通过DR片段同源重组实现的基因敲除
5 结语
近年来,在分子操作工具研究方面取得了较大进展,研究人员开发出了一系列用于基因中断、敲除和敲入的新方法和新工具。mazF作为反向筛选标记不仅可用于操作手段成熟的菌株(如枯草芽孢杆菌、毕赤酵母等),使其遗传操作更加快捷和精准,而且也可用于操作手段不完善的菌株(如梭菌、蓝藻等)的分子水平改造及遗传学方面的基础性研究。mazF等反向筛选标记的运用推进了微生物遗传操作的发展。反向筛选能够导致整合了反向筛选基因的微生物死亡。经过这样的处理,不仅筛选更为容易,而且没有引入标记基因,这使得基因的连续操作成为可能。基于以上分析,为了获得操作更简便,筛选效率更高,通用性更强的基因修饰系统,可从几方面进行升级和改进。第一,进一步优化现有的基于毒素蛋白基因的遗传操作方法或结合其他的基因修饰系统,降低假阳性出现的概率,提高筛选效率。第二,开发其他TA系统中通用性更好的毒素蛋白基因作为反向筛选标记,建立新的通用性更强的基因修饰系统和方法。
[1]Yan X, Yu HJ, Hong Q, et al. Cre/lox system and PCR-based genome engineering in Bacillus subtilis[J]. Appl Environ Microbiol, 2008, 74(17):5556-5562.
[2]Enyeart PJ, Chirieleison SM, Dao MN, et al. Generalized bacterial genome editing using mobile group II introns and Cre-lox[J]. Molecular Systems Biology, 2013, 9:685.
[3]Fabret C, Ehrlich SD, Noirot P. A new mutation delivery system for genome-scale approaches in Bacillus subtilis[J]. Molecular Microbiology, 2002, 46(1):25-36.
[4]Liu S, Endo K, Ara K, et al. Introduction of marker-free deletions in Bacillus subtilis using the AraR repressor and the ara promoter[J]. Microbiology, 2008, 154(Pt 9):2562-2570.
[5]Keller KL, Bender KS, Wall JD. Development of a markerless genetic exchange system for Desulfovibrio vulgaris hilden borough and its use in generating a strain with increased transformation efficiency[J]. Appl Environ Microbiol, 2009, 75(24):7682-7691.
[6]Kostner D, Peters B, Mientus M, et al. Importance of codB for new codA-based markerless gene deletion in Gluconobacter strains[J]. Appl Microbiol Biotechnol, 2013, 97(18):8341-8349.
[7]Blower TR, Salmond GP, Luisi BF. Balancing at survival’s edge:the structure and adaptive benefits of prokaryotic toxin-anti-toxin partners[J]. Curr Opin Struct Biol, 2011, 21(1):109-118.
[8]Yamaguchi Y, Inouye M. Regulation of growth and death in Escherichia coli by toxin-antitoxin systems[J]. Nature Reviews Microbiology, 2011, 9(11):779-790.
[9]Zhang Y, Zhang J, Hoeflich KP, et al. MazF cleaves cellular mRNAs specifically at ACA to block protein synthesis in Escherichia coli[J]. Molecular Cell, 2003, 12(4):913-923.
[10]Amitai S, Kolodkin-Gal I, Hananya-Meltabashi M, et al. Escherichia coli MazF leads to the simultaneous selective synthesis of both“death proteins” and “survival proteins”[J]. PLOS GENET, 2009, 5(3):e1000390.
[11]Shimazu T, Degenhardt K, Nur EKA, et al. NBK/BIK antagonizes MCL-1 and BCL-XLand activates BAK-mediated apoptosis in response to protein synthesis inhibition[J]. Genes & Dev, 2007, 21(8):929-941.
[12]Yang J, Jiang W, Yang S. mazF as a counter-selectable marker for unmarked genetic modification of Pichia pastoris[J]. FEMS Yeast Res, 2009, 9(4):600-609.
[13]Kolodkin-Gal I, Hazan R, Gaathon A, et al. A linear pentapeptide is a quorum-sensing factor required for mazEF-mediated cell death in Escherichia coli[J]. Science, 2007, 318(5850):652-655.
[14]Zhang XZ, Yan X, Cui ZL, et al. mazF, a novel counter-selectable marker for unmarked chromosomal manipulation in Bacillus subtilis[J]. Nucleic Acids Research, 2006, 34(9):e71.
[15]Yansura DG, HENNER DJ. Use of the Escherichia coli lac repressor and operator to control gene expression in Bacillus subtilis[J]. Proc Nati Acad Sci USA, 1984, 81:439-443.
[16]Bhavsar AP, Zhao X, Brown ED. Development and characterization of a xylose-dependent system for expression of cloned genes in Bacillus subtilis:conditional complementation of a teichoic acid mutant[J]. Appl Environ Microbiol, 2001, 67(1):403-410.
[17]Vagner V, Dervyn E, Ehrlich SD. A vector for systematic gene inactivation in Bacillus subtilis[J]. Microbiology, 1998, 144:3097-3104.
[18]Hartl B, Wehrl W, Wiegert T, et al. Development of a new integration site within the Bacillus subtilis chromosome and construction of compatible expression cassettes[J]. Journal of Bacteriology, 2001, 183(8):2696-2699.
[19]Morimoto T, Ara K, Ozaki K, et al. A new simple method to introduce marker-free deletions in the Bacillus subtilis genome[J]. Genes Genet Syst, 2009, 84:315-318.
[20]Yu HJ, Yan X, Shen WL, et al. Efficient and precise construction of markerless manipulations in the Bacillus subtilis genome[J]. J Microbiol Biotechnol, 2010, 20(1):45-53.
[21]Kim L, Mogk A, Schumann W. A xylose-inducible Bacillus subtilis integration vector and its application[J]. Gene, 1996, 181:71-76.
[22]Daniel RA, Harry EJ, Katis VL, et al. Characterization of the essential cell division gene ftsL(yIID)of Bacillus subtilis and its role in the assembly of the division apparatus[J]. Molecular Microbiology, 1998, 29(2):593-604.
[23]Lewis PJ, Marston AL. GFP vectors for controlled expression and dual labeling of protein fusions in Bacillus subtilis[J]. Gene, 1999, 227(1):101-110.
[24]Lin Z, Deng B, Jiao Z, et al. A versatile mini-mazF-cassette for marker-free targeted genetic modification in Bacillus subtilis[J]. Journal of Microbiological Methods, 2013, 95(2):207-214.
[25]Dong H, Tao W, Zhang Y, et al. Development of an an hydrotetracycline-inducible gene expression system for solvent-producing Clostridium acetobutylicum:a useful tool for strain engineering[J]. Metabolic Engineering, 2012, 14(1):59-67.
[26]Heap JT, Pennington OJ, Cartman ST, et al. The ClosTron:a universal gene knock-out system for the genus Clostridium[J]. Journal of Microbiological Methods, 2007, 70(3):452-464.
[27]Al-Hinai MA, Fast AG, Papoutsakis ET. Novel system for efficient isolation of Clostridium double-crossover allelic exchange mutants enabling markerless chromosomal gene deletions and DNA integration[J]. Appl Environ Microbiol, 2012, 78:8112-8121.
[28]Schlake T, Bode J. Use of mutated FLP recognition target(FRT)sites for the exchange of expression cassettes at defined chromosomal loci[J]. Biochemistry, 1994, 33:12746-12751.
[29]Cheah YE, Albers SC, Peebles CAM. A novel counter-selection method for markerless genetic modification in Synechocystis sp. PCC 6803[J]. Biotechnol Prog, 2013, 29(1):23-30.
[30]Zang X, Liu B, Liu S, et al. Optimum conditions for transformation of Synechocystis sp. PCC 6803[J]. The Journal of Microbiology, 2007, 45(3):241-245.
[31]Lopez-Maury L, Garcia-Dominguez M, Florencio FJ, et al. A twocomponent signal transduction system involved in nickel sensing in the cyanobacterium Synechocystis sp. PCC 6803[J]. Mol Microbiol, 2002, 43(1):247-256.
[32]Bernard P, Gabarit P, Bahassi EM, et al. Positive-selection vectors using the F plasmid ccdB killer gene[J]. Gene, 1994, 148(1):71-74.
[33]Gabant P, Van Reeth T, Drèze PL, et al. New positive selection system based on the parD(kis/kid)system of the R1 plasmid[J]. Biotechniques, 2000, 28(4):784-788.
[34]Kim HG, Hwang HJ, Kim MS, et al. pTOC-KR:a positive selection cloning vector based on the ParE toxin[J]. Biotechniques, 2004, 36(1):60-62, 64.
[35]Le Roux F, Binesse J, Saulnier D, et al. Construction of a Vibrio splendidus mutant lacking the metalloprotease gene vsm by use of a novel counter selectable suicide vector[J]. Appl Environ Microbiol, 2006, 73(3):777-784.
(责任编辑 狄艳红)
Application Progress of mazF Gene in Genetic Modification System
Shi Yang1,2Dong Huina2Zhang Dawei2
(1. School of Pharmaceutical Science and Technology,Tianjin University,Tianjin 300072;2. Tianjin Institute of Industrial Biotechnology,Chinese Academy of Science,Tianjin 300308)
Toxin-antitoxin system(TA)exists in most of the genetic material of bacteria. mazEF is a kind of toxin-antitoxin system in E. coli. MazF encoded by mazF is an mRNA interferase that specifically cleaves free mRNAs at ACA sequences, resulting in inhibited protein synthesis and cell growth arrest. Recently, some scholars have used mazF as a counter-selection marker in genetic modification systems, and achieved modifications of the genome in various strains. In this article, the research advances of E. coli mazF used as counter-selection marker in bacterial genetic modification were reviewed, followed by application of other toxin gene. Finally, perspective of the possible new pathways for developing new genetic modification methods were addressed.
mazF Toxin gene Counter-selection marker Genetic modification method
2014-03-27
国家自然科学基金项目(31200036,31370089),天津市科技支撑计划重点项目(12ZCZDSY12700,11ZCZDSY08500)
石杨,男,硕士研究生,研究方向:枯草芽孢杆菌代谢途径的改造;E-mail:yun1986feiyang@sina.com
张大伟,男,博士,研究员,研究方向:微生物代谢工程和芽孢杆菌表达系统;E-mail:zhang_dw@tib.cas.cn
