无机盐用量调整对太行菊不定芽增殖与生长的影响
2014-03-21赵元增单长卷
赵元增 单长卷
(河南科技学院生命科技学院,新乡 453003)
无机盐用量调整对太行菊不定芽增殖与生长的影响
赵元增 单长卷
(河南科技学院生命科技学院,新乡 453003)
以太行菊不定芽为材料,通过调整MS培养基中大量元素、微量元素、铁盐、Ca2+、K+的用量与配比,研究MS培养基不同的无机盐用量水平对太行菊不定芽增殖和生长的影响。结果表明,太行菊不定芽的增殖与生长适应较高含量的MS大量元素,降低培养基中的MS大量元素用量,不定芽分化数量减少,增殖系数降低,并且不定芽长势弱,叶片出现黄枯。单独加倍MS培养基中的K+(KNO3与KH2PO4)含量,可促进太行菊不定芽的增殖与生长,不定芽增殖系数明显高于对照及其他处理。增加或降低MS培养基中的Ca2+含量,对太行菊不定芽的增殖与生长影响不大;去掉培养基中的微量元素,不定芽的增殖与生长明显受到抑制,不定芽分化数量减少,且不定芽的叶片枯死严重。减半培养基中的铁盐含量,对不定芽的生长影响较小;但加倍培养基中的铁盐含量,对不定芽的增殖和生长均产生强烈的抑制作用。
太行菊 不定芽 离体培养 增殖系数
太行菊[Opisthopappus taihangensis(Ling)Shih]是菊科太行菊属多年生草本植物,为我国太行山区特有珍稀物种,仅见于豫、晋、冀三省交界的太行山区[1,2]。由于生境独特,分布区域狭窄,繁殖能力弱,加之人为的大量挖掘采摘,太行菊现处于濒危状态,已被列为国家珍稀濒危保护植物及河南省重点保护植物[1,2]。与传统药用野菊相比,太行菊具有更好的保健或药用功效,其整株的开发利用潜力巨大[3,4]。近年来,出于对太行菊资源保护与综合开发的需要,对太行菊的遗传多样性[5,6]、生殖生物学[7-10]、远缘杂交等[11-16]的研究和报道逐渐增多。但对太行菊离体繁殖方面的研究极少,仅
见姚连芳等[17]、王建博等[18]两篇报道。这些研究中均以MS培养基为基本培养基,侧重于太行菊的形态发生与植物生长调节剂的作用,而对于培养基中的基本成分组成(特别是无机盐)对太行菊离体培养的作用,国内外尚未见报道。由于太行菊多生长于向阳山谷的裸露崖壁或岩石的缝隙中,所处生境土壤稀少,有机质、全氮含量较低,钙含量较高[19]。基于太行菊的独特生境,其生长发育对各种无机盐的需求可能存在特殊性,MS基本培养基的无机盐含量水平对太行菊的生长发育并不一定适宜。为此,本试验探讨MS培养基不同无机盐含量水平对太行菊不定芽增殖与生长的影响,旨在建立高效的太行菊繁育体系,为太行菊种质资源的保护和开发利用奠定基础,同时对于太行菊的引种驯化与栽培也有借鉴意义。
1 材料与方法
1.1 材料
太行菊采自新乡关山国家地质公园,接种材料为太行菊无菌不定芽。
1.2 方法
1.2.1 培养基 在MS基本培养基的基础上,保持其他组成成分用量不变,仅对培养基中的无机盐按照表1所示进行含量水平调整。所有培养基中均加入蔗糖30 g/L,琼脂粉4.6 g/L,6-BA 0.4 mg/L,NAA 0.1 mg/L,pH调整为5.8。
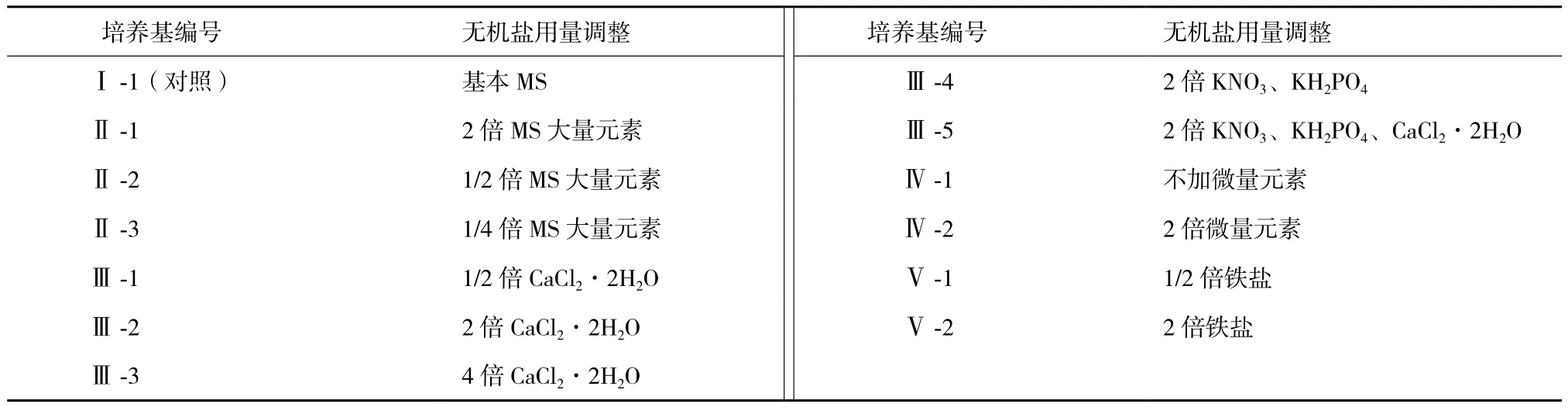
表1 培养基编号及其无机盐用量
1.2.2 接种与培养 在超净工作台上,选择长势且大小一致的太行菊不定芽块,将其切成1 cm3大小,然后将芽块分别接种于以上各培养基中,每种培养基接种20瓶,每瓶接种3块。接种时不定芽块基部嵌入培养基,不定芽生长点外露。
培养温度 24-26℃,光照强度 1 500-2 000 lx,光照时间 12 h/d。
1.2.3 调查项目与方法 接种后7 d观察、记录不定芽开始增殖的情况,以后定期观察不定芽的增殖情况及其长势。接种培养40 d时,记录每个处理的接种不定芽块总数、芽块大小、不定芽长势(不定芽的叶色、叶片长度、叶片枯死情况等)等结果。然后将增殖后的不定芽块切割成与接种时的一致大小(1 cm3),统计各处理增殖后芽块的分割总块数,并计算各处理的增殖系数:不定芽增殖系数=增殖后芽块的分割总块数/接种芽块总数。
2 结果
2.1 培养基中大量元素用量对太行菊不定芽增殖与生长的影响
培养基中MS大量元素的不同使用量,对太行菊不定芽的增殖与生长状况产生较大影响(表2)。
由表2可见,在MS基本培养基(Ⅰ-1)与大量元素加倍的培养基(Ⅱ-1)中,芽块均产生大量不定芽,不定芽增殖系数与芽块大小相近,均达到较大值;并且不定芽生长正常,芽块中很少存在枯死的叶片。两者稍有差异的是,在大量元素加倍的培养基上(Ⅱ-1),不定芽较大且生长更为茁壮,有较多的不定芽的叶片长度达到5-10 mm,有些可达15-17 mm。当降低培养基中的大量元素用量时(Ⅱ-2和Ⅱ-3培养基),芽块上新分化的不定芽数量减少,增殖系数降低,芽块变小,芽块表面出现颗粒状的愈伤组织,不定芽的增殖受到抑制。此外,
随着培养基中大量元素用量的降低,不定芽的长势变差,芽体纤小,叶片枯黄,芽块中变褐枯死的不定芽数量增多。特别是在1/4 倍MS大量元素的培养基上(Ⅱ-3),不定芽生长几乎停滞,叶片细小卷曲且多呈水浸状,淡黄至黄褐色,有些不定芽块甚至整个枯死。

表2 大量元素不同用量对太行菊不定芽的增殖与生长的影响
2.2 培养基中Ca2+、K+用量对太行菊不定芽增殖
与生长的影响
为了进一步弄清MS大量元素中哪种无机盐对太行菊不定芽的增殖与生长影响更大,我们调整了培养基中的KNO3、KH2PO4、CaCl2·2H2O用量。太行菊不定芽在各培养基上的增殖与生长状况,见表3。
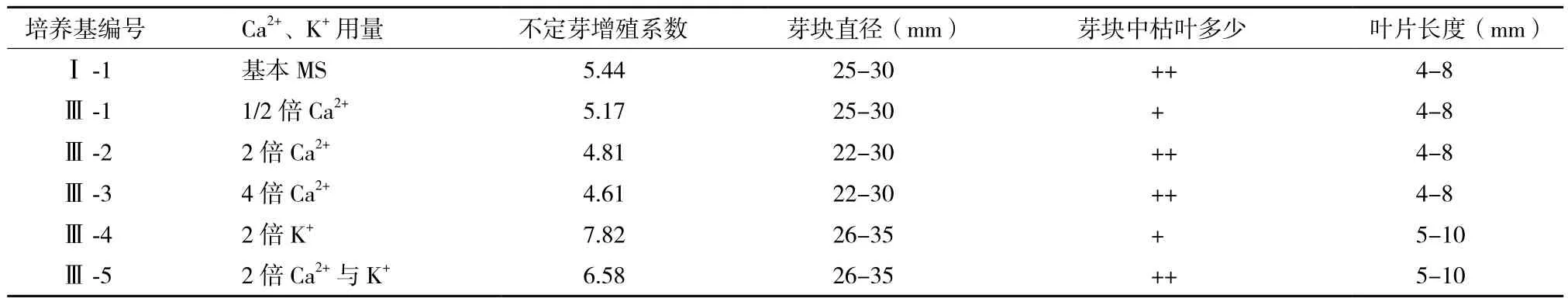
表3 Ca2+、K+不同用量对太行菊不定芽的增殖与生长的影响
由表3可知,与对照(Ⅰ-1)相比,单独改变培养基中的CaCl2·2H2O用量,对太行菊不定芽的增殖与生长影响相对较小。在CaCl2·2H2O用量减半(Ⅲ-1)、加倍(Ⅲ-2)与4倍(Ⅲ-3)的培养基上,接种芽块均分化产生大量不定芽,不定芽增殖系数、芽块大小及不定芽长势都与对照相差不大。这表明太行菊不定芽的增殖与生长可适应较广范围的Ca2+浓度变化,MS基本培养基中CaCl2·2H2O的正常用量或减半即可满足其生长发育的需要。
单独加倍培养基中的K+(KNO3与KH2PO4)用量,对太行菊不定芽的增殖与生长有明显的促进作用。当培养基中K+(KNO3与KH2PO4)用量加倍时(Ⅲ-4培养基),不定芽的增殖系数达到最大(7.82),明显高于对照(Ⅰ-1),也高于Ⅲ-5培养基中Ca2+与K+同时加倍时的增殖系数(6.58)。并且在该培养基中,分化产生大量不定芽,不定芽大小均一,生长旺盛,叶色浓绿,芽块中几乎无黄化枯死的叶片。多数芽块直径在30 mm左右,有些芽块甚至达到35 mm。当培养基中Ca2+、K+用量同时加倍时(Ⅲ-5培养基),不定芽的增殖与生长状况稍差,不定芽分化数量减少,芽块中出现少量黄褐色或褐色枯死的叶片。
2.3 培养基中微量元素用量对太行菊不定芽增殖与生长的影响
与对照(Ⅰ-1)相比,将培养基中的MS微量元素全部去除或将其用量加倍,对太行菊不定芽的增殖与生长都不利(表4)。两者都将导致不定芽增殖系数大幅降低,芽块变小,不定芽长势变差。特别是在MS微量元素全部去除的培养基中(Ⅳ-1),不仅不定芽分化数量减少,并且不定芽生长停滞,小的不定芽叶片卷曲,水浸透明,较大的不定芽多数叶片黄化,芽块中出现大量黄褐色至褐色的枯死的叶片。相比而言,加倍培养基中的微量元素用量(Ⅳ-2),对太行菊不定芽的生长影响相对较小。在Ⅳ-2培养基上,虽然分化产生的不定芽数量也大幅减少,但不定芽叶色淡绿,生长正常,芽块中仅夹
杂少量黄化枯死的叶片,不定芽生长状况好于去除MS微量元素的处理。

表4 微量元素用量对太行菊不定芽的增殖与生长的影响
2.4 培养基中铁盐用量对太行菊不定芽增殖与生长的影响
在MS铁盐用量不同的培养基上,太行菊不定芽的增殖与生长状况(表5)显示,减半或加倍培养基中的铁盐用量,对太行菊的不定芽增殖与生长均产生不利影响。与对照(Ⅰ-1)相比,当铁盐用量减半(Ⅴ-1)时,致使不定芽分化数量减少,芽块变小,增殖系数降低。但不定芽生长基本正常,芽体大小、芽块中枯叶多少等状况与对照相似。当培养基中的铁盐用量加倍(Ⅴ-2)时,不仅不利于芽的分化,不定芽的生长也明显受到抑制,绝大多数的不定芽纤小,叶片长度只有3-5 mm,并且叶片卷曲,水浸状透明,叶尖、叶缘尤为严重。此外,在铁盐加倍的培养基中,芽块中出现大量黄褐色至褐色的枯叶,致使整个芽块颜色暗淡,毫无生机。

表5 铁盐用量对太行菊不定芽的增殖与生长的影响
3 讨论
在植物的离体繁殖中,培养基中无机盐含量是影响培养物增殖与分化的重要因素之一。针对不同植物对无机盐需求的差异,研究者开发出了不同的高盐培养基(如MS、B5、N6等培养基)、中盐培养基(如Nitsch培养基)和低盐培养基(如White培养基),分别用于不同植物类型、不同形态发生方式、不同培养阶段的无机盐需求[20]。对太行菊离体培养的研究很少,在已有研究中,研究者均采用MS培养基作为基本培养基[17,18]。从理论上讲,MS培养基的大量元素浓度较高,微量元素及有机成分齐全而丰富,适用于许多植物的增殖培养。因此,在对某种植物无机盐需求未知的情况下,研究者常常采用MS培养基作为离体培养的基本培养基。该法虽简便可行,但未必对所培养植物是最适宜的。MS培养基中的无机盐含量是否最适宜于太行菊的离体培养,还未见报道。
由于太行菊多生长于裸露崖壁或岩石的缝隙,所处生境土壤稀少,多为风化的石灰岩与枝叶腐殖质构成的混合物[19]。在这样的生境中,供太行菊生长发育所需要的无机盐种类和含量相对贫乏,据此推测,MS培养基的高无机盐水平也许并不适宜太行菊的生长发育。为此,本研究首先对培养基中的MS大量元素用量进行了加倍、减半及1/4倍处理。试验结果表明,降低培养基中的大量元素用量,对太行菊不定芽的增殖与生长均不利,特别是在1/4倍大量元素用量的条件下,不定芽生长几乎停滞,且枯死严重。相反,加倍培养基中的大量元素含量更有利于不定芽的生长与增殖。在自然界中,处于石缝中的太行菊能够正常生长,并未出现枯萎死亡,太行菊是如何从有限且贫瘠的生境中获取生长所需的N、P、K等大量元素的,也许测定太行菊的生境基质成分有助于解决这一问题。在太行菊的人工栽培与驯化中,提供丰富的N、P、K等大量元素供给,也许更有利于太行菊的生长。
太行菊生长的岩石缝穴主要由石灰岩构成,有机质和全氮的含量较低,而全钙的含量较高[19]。通过调整MS培养基中Ca2+(CaCl2·2H2O)用量,发现降低或提高Ca2+用量对太行菊不定芽的增殖与生
长影响较小,即使在4倍CaCl2·2H2O用量的条件下,太行菊不定芽也能基本正常生长。这表明,在较高钙含量的生境条件下,太行菊已适应较广范围的Ca2+浓度变化,在高Ca2+浓度下也能正常生长发育。除石灰岩风化产物外,太行菊生境中还有较多的腐化枝叶,这必将增加土壤中的K+含量,太行菊应当喜好K+丰富的基质条件,试验结果印证了这一点。加倍培养基中的K+(KNO3与KH2PO4)用量,对太行菊不定芽的增殖与生长具有十分明显的促进作用,在本试验所有的处理中,该培养基上的太行菊不定芽的增殖与生长状况表现最好。这表明K+在太行菊的生长发育中起重要作用,在其引种驯化时,适当加大钾肥的供给,应当有利于太行菊的生长。
在植物的离体培养中,微量元素对形态发生的影响较大,而对已分化器官的生长影响相对较小,在一些简化的培养基中,微量元素可以部分或全部省略掉,有时并无显著的影响[21]。在本研究中,全部去除培养基中的MS微量元素,不仅使太行菊不定芽分化数量减少,不定芽的生长也受到严重抑制,不定芽生长停滞甚至枯死。这表明对于太行菊的离体培养,微量元素不仅为不定芽的分化所必需,对不定芽的正常生长也是必不可少的。
4 结论
在太行菊不定芽的增殖培养中,太行菊更喜好较高浓度的大量元素环境,降低培养基的大量元素用量,对太行菊不定芽的增殖与生长十分不利,而在基本MS与加倍MS大量元素用量的培养基上,太行菊不定芽的增殖与生长相对较好,并且两处理间的差异不大。提高或降低培养基中的Ca2+(CaCl2·2H2O)用量,对太行菊不定芽的增殖与生长影响较小。单独加倍培养基中的K+(KNO3与KH2PO4)用量,对太行菊不定芽的增殖与生长有明显的促进作用,在太行菊不定芽的增殖培养中,可以选择K+(KNO3与KH2PO4)用量加倍的改良MS培养基作为其增殖与生长的基本培养基。培养基中的MS微量元素对于太行菊不定芽的增殖与生长是必不可少的,去除培养基中的微量元素将使不定芽分化数量减少,生长停滞,甚至枯萎死亡。相对而言,将培养基中的微量元素用量加倍,虽然不利于不定芽的分化,但对芽的生长影响较小。以MS基本培养基的铁盐用量为基准,降低培养基中铁盐用量,不利于不定芽的分化增殖,但对其生长影响不大。加倍培养基中的铁盐用量,对太行菊不定芽的增殖与生长均产生强烈的毒害作用,致使不定芽分化数量减少,生长受阻,甚至引起大量不定芽枯萎死亡。
[1]丁保章, 王遂义.河南植物志:第3册[M].郑州:河南科学技术出版社, 1997:632.
[2]卢炯林, 王磐基.河南省珍稀濒危保护植物[M].开封:河南大学出版社, 1990:197-199.
[3]刘海芳, 魏东伟, 刘全军, 等.太行菊不同器官中绿原酸和4种黄酮类物质含量研究[J].天然产物研究与开发, 2013, 25:646-651, 671.
[4]刘莹, 孙跃枝, 田转运.太行菊的生物学特性及保护利用[J].湖北农业科学, 2012, 51(17):3775-3776.
[5]Wang YL. Chloroplast microsatellite diversity of Opisthopappus Shih(Asteraceae)endemic to China[J]. Plant Systematics and Evolution, 2013, 299:1849-1858.
[6]Wang YL, Yan GQ. Genetic diversity and population structure of Opisthopappus longilobus and Opisthopappus taihangensis (Asteraceae)in China determined using sequence related amplified polymorphism markers[J]. Biochemical Systematics and Ecology, 2013, 49:115-124.
[7]高亚卉, 戴攀峰, 姬志峰, 等.太行菊属植物花粉形态研究[J].西北植物学报, 2011, 31(12):2464-2472.
[8]Li J, Chen SM, Chen FD, et al. Karyotype and meiotic analyses of six species in the subtribe Chrysantheminae[J]. Euphytica, 2008, 164:293-301.
[9]Li J, Teng NJ, Chen FD, et al. Reproductive characteristics of Opisthopappus taihangensis(Ling)Shih, an endangered Asteraceae species endemic to China[J]. Scientia Horticulturae, 2009, 121(4):474-479.
[10]李健, 陈发棣, 陈素梅, 等.太行菊和芙蓉菊花粉母细胞减数分裂过程[J].南京农业大学学报, 2009, 32(4):43-46.
[11]胡枭, 赵惠恩.太行菊属与菊属亚菊属远缘杂交试验初报[J].现代农业科学, 2008, 15(6):13-14.
[12]Tang FP, Wang HB, Chen SM, et al. First intergeneric hybrids within the tribe Anthemideae Cass. III.Chrysanthemum indicum L.
Des Moul.×Opisthopappus taihangensis (Ling)Shih[J]. Biochemical Systematics and Ecology, 2012, 43:87-92.
[13]Yang DY, Hu X, Liu ZH, et al. Intergeneric hybridizations between Opisthopappus taihangensis and Chrysanthemum lavandulifolium[J]. Scientia Horticulturae, 2010, 125(4):718-723.
[14]Zheng Y, Shen J, An YM, et al. Intergeneric hybridization between Elachanthemum intricatum(Franch.)Ling et Ling and Opisthopappus taihangensis(Y. Ling)C. Shih[J]. Genet Resour Crop Evol, 2013, 60:473-482.
[15]何敏杰, 程月琴, 王红卫, 等.太行菊DNA提取和ISSR标记的筛选与优化[J].中国农学通报, 2012, 28(16):202-207.
[16]桑叶子, 孙明, 张启翔.太行菊细胞悬浮培养体系的建立[J].河南农业大学学报, 2011, 45(2):177-182.
[17]姚连芳, 董美华, 毛玉收.太行菊组织培养研究[J].中国农学通报, 2004, 20(6):29-31.
[18]王建博, 徐思明, 董鹏, 等.太行菊顶芽离体高效再生系的建立[J].首都师范大学学报:自然科学版, 2008, 29(5):45-50.
[19]沈世华, 陆文梁, 王伏雄.太行花生殖生物学研究:I太行花生境的分析[J].生物多样性, 1994, 2(4):210-212.
[20]柳俊, 谢从华.植物细胞工程[M].第2版.北京:高等教育出版社, 2011:87-90.
[21]李友勇, 李秀菊.应用生物技术[M].北京:中国农业科技出版社, 2004:55-60.
(责任编辑 马鑫)
Effect of Adjustment for Inorganic Salt Contents on Adventitious Buds Proliferation and Growth of Opisthopappus taihangensis in vitro
Zhao Yuanzeng Shan Changjuan
(School of Life Science and Technology,Henan Institute of Science and Technology,Xinxiang 453003)
The effect of different content of MS medium inorganic salts, including macro-element, micro-element, ferric salts, Ca2+and K+, on Opisthopappus taihangensis adventitious buds proliferation and growth were investigated using adventitious buds of Opisthopappus taihangensis as test materials. The results showed that the medium containing a relatively higher content of MS macro-element was more suitable for adventitious buds proliferation and growth of Opisthopappus taihangensis. The proliferation and growth of Opisthopappus taihangensis adventitious buds, which were tiny and weak, and many of adventitious buds leaves became yellow or brown, were inhibited on the medium with reduced content of MS macro-element. The adjusted medium with doubled content of KNO3and KH2PO4could facilitate the growth and prolif eration of Opisthopappus taihangensis adventitious buds;it showed the best performance on the proliferation and growth of adventitious buds among all treatments in the study. The adjustment, whether the Ca2+content increased or decreased in media, had little effect on the proliferation and growth of Opisthopappus taihangensis adventitious buds. The proliferation and growth of Opisthopappus taihangensis adventitious buds was inhibited on the proliferation medium without any micro-element. The proliferation and growth of adventitious buds was strongly inhibited on the proliferation medium containing a twofold content of ferric salts, but slightly affected on the medium with a half content of ferric salts.
Opisthopappus taihangensis Adventitious buds Culture in vitro Propagation coefficient
2014-04-21
河南科技学院博士科研启动基金项目(201010612002),河南教育厅科学技术研究重点项目(14B210005)
赵元增,男,博士,副教授,研究方向:细胞工程与遗传育种;E-mail:yuanzengzh@126.com
