原发性局灶节段性肾小球硬化的转录组学研究
2014-03-21综述审校
仝 君 综述 陈 楠 审校
自1957年局灶节段性肾小球硬化(FSGS)首次被报道以来,近年来已成为成人和儿童激素抵抗肾病综合征(SRNS)中最常见的原因之一。FSGS以大量蛋白尿为主要临床表现,部分为NS,常合并高血压和进展性肾功能不全。激素和免疫抑制剂是目前治疗NS表现FSGS的主要手段,部分FSGS患者对激素治疗无反应(激素抵抗),部分患者缓解后复发(激素依赖),激素抵抗或激素依赖的FSGS患者肾功能易进行性恶化、预后差。
FSGS根据病因可分为原发性、继发性和家族性三类。其中继发性FSGS是指继发于肥胖、高血压、糖尿病等系统性疾病,此外,人类免疫缺陷病毒(HIV)等病毒感染或药物(如雷帕霉素)等也可引起FSGS样病理改变。家族性FSGS(FFSGS)又称遗传性FSGS,约占非继发性FSGS的9%,迄今报道的FFSGS在成人多符合常染色体显性遗传(AD),提示单个基因突变是这些FFSGS的病因。通过对FSGS家系的连锁分析及定位克隆,先后证实NPHS1基因(编码nephrin蛋白),NPHS2基因(编码podocin蛋白),ACTN4基因(编码α-actinin 4蛋白),TRPC6基因(编码TRPC6通道蛋白),INF2基因(编码inverted formin-2蛋白),CD2AP基因(编码CD2AP蛋白)等参与FFSGS的发生,这些基因编码的产物分别与足细胞及裂隙膜结构及功能的维持密切相关[1]。原发性FSGS占我院原发性肾小球肾炎病理类型的14%[2],目前致病原因不明。近期有报道MYH9(编码non muscle myosin heavy chain 9)、APOL1[3]基因与非裔美国人FSGS的发生相关。Wittenhagen等[4]发现循环中可溶性尿激酶受体(suPAR)在FSGS患者血清中表达明显升高,但检测suPAR并不能区分原发性和继发性FSGS,其是否有助于区分FSGS与其他类型肾小球疾病还存在争议。因此对原发性FSGS发病机制的探索具有重要的临床和科研意义。
转录组广义上是指组织或细胞在某一生理条件下,细胞内所有转录产物的集合,主要包括信使RNA(mRNA) 和非编码RNA(ncRNA)[5],ncRNA主要包括微小RNA(MicroRNAs,miRNAs)和长链非编码RNA(LncRNA)。ncRNA通过阻断蛋白翻译和诱导mRNA降解,在转录后水平发挥基因表达调控的功能。转录组是动态的,持续应答于多变的生理和环境条件,是连接基因组遗传信息与功能蛋白质组的“纽带”,转录水平的调控是生物体内重要的调控方式,因此对转录组的高通量分析成为疾病研究的基石。
转录组学研究方法
基因的转录组学的研究方法目前较为常用的有微阵列,也叫生物芯片(Microarray)技术和RNA测序(RNA Seq)技术。转录组学研究提供了不同的细胞或组织类型转录本表达的差异,揭示了疾病发展的不同阶段,或不同的疾病表型间基因表达的差异,以及基因在物种内部或物种间表达的差异。另外,它还可以帮助我们研究ncRNA的作用机制。目前,转录组学研究方法已被广泛应用于发病机制的研究、帮助确定新的疾病亚型或药物作用机制研究等方面。
目前转录组学应用最广泛的是Microarray技术,是近年来常用于研究mRNA转录表达水平的技术手段。其原理为将与待测转录本互补的寡核苷酸探针集合固定于固相载体上,从组织或细胞中提取出的待测转录本,与探针集合杂交,与相应转录本互补的探针与其靶标结合,显示荧光信号。经激光扫描,荧光信号的强度代表探针与其互补转录本结合的密度,从而反映转录本的表达水平[6]。目前常用的表达谱芯片有Affymetrix、Agilent和illumina,其中Affymetrix探针数目多,且为短探针,短探针的优点在于特异度较高,检测结果较准确[7]。传统的Northern或Southern印记,局限于一个基因或一组基因,而Microarray技术以其微型化、快速、准确、灵敏度高的特点,在基因表达图谱的绘制、寻找目的基因和功能基因等研究方面已取得了显著的成绩[8]。美国国家生物技术信息中心(NCBI)管理的GEO(Gene Expression Omnibus) 数据库,收录了大于520 000次实验和21 000余项目提交的数据,绝大部分来源于Microarray[9],宏大的数据量为基因表达的数据分析和实验设计提供了有力的工具。然而该技术只限用于已知序列,无法检测未知的RNA;且受杂交技术灵敏度等限制,对低丰度的转录本(需要更多的样品量)和重复序列的检测存在困难,限制了其在新的分子靶标和新药研发中的应用[10]。
另一项较新的转录组学研究方法为RNA Seq。RNA Seq通过对样品中转录本的直接测序,将所得序列通过比对映射回基因组,确定转录本剪切情况、位置等更全面的遗传信息。通过该技术,可将所得序列de novo组装(无参考基因组)形成全基因组范围的转录谱,并且通过统计相关读段(reads)数计算出不同 RNA 的表达量,所以该技术不但能够在转录水平进行定量分析,而且可以帮助发现新的转录本[11];精确识别可变剪切位点及编码序列单核苷酸多态性(cSNP);并能反映疾病状态下转录本的改变,是目前深入研究转录组复杂性的有力工具[12]。RNA Seq已广泛应用于生物学医学研究、药物研发和临床研究等。miRNAs是一类在进化上高度保守的非编码小分子单链RNA(约21~24 nt),在基因转录后调控中发挥重要作用[13]。miRNAs 参与生长发育、细胞分化、增殖与凋亡、激素分泌、肿瘤形成等重要的生理和病理过程。LncRNA占ncRNA的70%(≥200 nt),无长阅读框架、但往往具有mRNA结构特征 (帽式结构和 polyA 尾)[14]。LncRNA通过参与表观遗传学、染色质修饰、调控转录因子的结合、可变剪切等,发挥重要的生物学功能;也可作为miRNA的前体,调控mRNA的表达。近年来飞速发展的新一代测序技术已广泛应用于miRNA和LncRNA的研究,帮助发现新的miRNA和LncRNA、研究其功能及调控机制,及检测其表达丰度、调控网络、作用通路和靶基因等。
Malone等[15]比较了Microarray和RNA Seq两种方法,提出Microarray和RNA Seq两种方法都是对转录本的高通量分析,而RNA Seq具有独特优势:可通过直接测序发现未知转录本[16],而不是依赖已知序列;可定量测定转录本的不同亚型、比较不同亚型间表达的差异[17]。因此,RNA Seq更适合于未知转录本的发现和亚型的鉴别。
FSGS的转录组学研究
FSGS是SRNS的主要病理类型之一,特别儿童SRNS多数病理表现FSGS。转录组广泛参与FSGS的病理生理过程,机制错综复杂,已有数项关于FSGS的Microarray分析,帮助从转录组学层面发现其潜在的致病机制。
FSGS患者肾小球转录本表达谱Bennett等[18]通过Affymetrix U133 plus 2.0 microarrays分析平台发现,FSGS患者肾小球(来自于肾穿刺后新鲜组织,经激光显微切割得到)与对照肾小球(来自于肾母细胞瘤旁未受累新鲜肾组织)相比,炎症与肿瘤相关基因[osteopontin、IL-8、Chemokine-1 (CXCL1)] ,趋化因子CD24,纤维化相关基因[Col4A3、Col1A1、Col1A2、SOX9、Thrombospondin、转化生长因子β(TGF-β)]高表达,而1型补体受体(CR1)低表达, 揭示炎症与肿瘤及纤维化通路可能参与FSGS的发生。
FSGS患者肾组织转录本表达谱Schwab等[19]通过Affymetrix human U133A microarrays分析平台发现,FSGS患者肾组织(来自于肾穿刺后新鲜组织)与对照肾组织(来自于肾母细胞瘤旁未受累新鲜肾组织)相比,参与细胞增生、细胞周期相关的基因(CDC34、CDKN2C),与DNA复制、细胞分裂相关的基因(ORC5L、PRC1)均高表达,部分解释了FSGS患者肾小球损伤与细胞增生及细胞周期异常有关。
FSGS患者石蜡组织中肾小球转录本表达谱Hodgin等[20]提取FSGS患者经甲醛固定、石蜡包埋(FFPE)肾组织中肾小球的RNA,通过Agilent 2100 Bioanalyzer分析平台发现,FSGS患者肾小球与对照肾小球(来自于肾母细胞瘤旁未受累肾组织)相比,未成熟足细胞的标志(PAX2),壁层上皮细胞特异性基因(CD24、CLDN1、KRT 18、KRT 19),转录因子基因(PAX8),与参与DNA转录的维生素A酸受体ɑ(RARA)高表达,而成熟足细胞的标志(podocalyxin、synaptopodin),足细胞胞质钙离子结合蛋白(AIF1),参与维持足细胞功能的MAFB基因等低表达,从足细胞层面揭示了FSGS的致病机制。
FSGS转录本表达谱的比较FSGS是足细胞病,Michael等[18]通过微切割得到FSGS患者肾小球,进而分析肾小球转录本表达的变化,实验方法较为合理,结果可信;Schwab等[19]直接分析患者肾组织转录本的表达,其中肾小管上皮细胞转录本的表达不同于肾小球细胞,使得实验结果存在一定偏差;Hodgin等[20]分析保存的患者石蜡肾组织转录本表达的变化,石蜡组织在固定、包埋、保存的过程中,RNA的降解难以避免,而获得高质量的RNA是Microarray顺利进行的基础,因此实验的难度较大。
FSGS的表达谱分析
通过Microarray分析发现,主要有炎症与肿瘤、信号通路、纤维化、细胞周期等相关基因参与FSGS的发病过程。其中Col1A1在上述三项研究中都呈高表达,但Col1A1在多种硬化性肾小球病中表达均上调,在FSGS中特异度不高。SOX9、CD24在上述2项研究中都呈高表达,而nephrin在上述2项研究中呈低表达(表1)[18,20]。
炎症及肿瘤相关基因FSGS患者肾小球骨桥蛋白(osteopontin)高表达,该基因在炎症与肿瘤状态下均高表达,同时,在儿童激素抵抗型NS尿液标本中(大部分经病理证实为FSGS),发现骨桥蛋白水平也升高[21]。在多种肾损伤动物模型中发现,肾脏osteopontin的高表达可激活核因子κB(NF-κB)信号通路,介导细胞炎症反应及损伤。 Endlich等[22]发现应激状态下体外培养的足细胞自身可高表达osteopontin,表明FSGS患者肾小球中高表达的osteopontin可能来源于应激状态下的足细胞,提示osteopontin可能参与肾小球硬化过程。Yoo等[23]在单侧输尿管梗阻小鼠肾组织中发现,osteopontin发挥抑制凋亡,促进间质纤维化的作用,同样提示其可能促进肾小球硬化的形成。Ma等[24]发现osteopontin在糖尿病肾病(DN)鼠中也呈高表达,经雷公藤内酯灌胃处理后,DN鼠osteopontin表达水平明显下降,尿蛋白减少,足细胞损伤减轻,提示osteopontin可能参与DN的进程。
白细胞介素8(IL-8)是介导炎症反应的趋化因子,在FSGS患者肾小球中高表达,已知足细胞可表达IL-8的受体CXCR1,在炎症状态下,足细胞可通过自分泌途径产生IL-8,与其自身受体结合,导致细胞损伤。而IL-8的特异性抗体可缓解急性肾小球肾炎小鼠的蛋白尿,足突消失等病变进展[25]。Preston等[26]在IgA肾病IgAN患者外周血白细胞中发现IL-8高表达,且表达水平与血清肌酐升高水平正相关,提示IL-8可能参与FSGS和IgAN的病变进程。
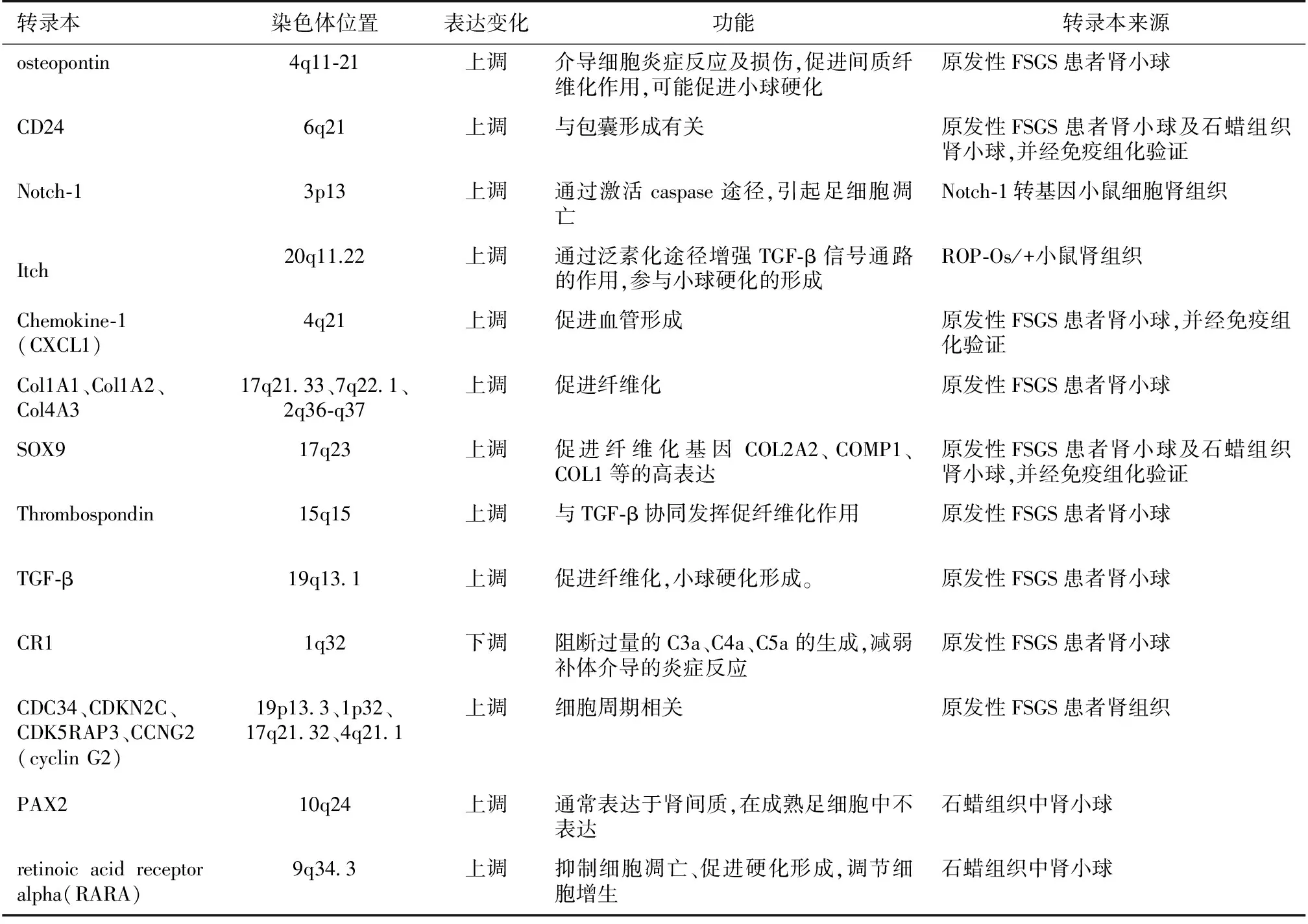
表1 局灶节段性肾小球硬化(FSGS)的表达谱分析[18]
CD24抗原表达产物CD24位于包囊的壁层上皮细胞,趋化因子1(CXCL1)参与血管形成,介导内皮前体细胞向血管损伤处迁移,CD24和CXCL1基因均在FSGS患者肾小球中高表达,Dekel等[27]通过免疫组化验证CD24、CXCL1基因编码蛋白在FSGS患者病变肾小球中表达明显增加,因此FSGS与肾小球损伤后细胞增生、组织重建有关。
信号通路相关基因Notch受体家族有四个成员,均以异二聚体的形式锚定在细胞膜上,Notch信号通路参与调控细胞增殖、分化和凋亡等重要的病理生理过程。此外,Notch信号通路参与肾间质纤维化、肾小球硬化的发生,与DN、FSGS等多种肾小球疾病有关[28]。Mertens等[29]报道在转基因小鼠细胞内表达活化的Notch-1,小鼠5d内即出现蛋白尿,伴系膜增生,节段性肾小球硬化和小管间质纤维化形成;进一步发现Notch-1通过激活caspase途径,引起足细胞凋亡。同时,在Lprdb/db小鼠(Ⅱ型糖尿病模型)和链脲霉素(streptozotocin)处理小鼠(Ⅰ型糖尿病模型)中,也观察到Notch-1和Notch-2的激活,Notch受体家族在FSGS发病过程中的特异性仍不明确。
El-Meanawy等[30]在ROP-Os/+小鼠(肾小球硬化倾向)中发现泛素化-蛋白酶体通路基因(Psmb5、Psma3、Fbxl12、Itch)高表达。Bai等[31]发现Itch通过泛素化途径增强TGF-β信号通路的作用,体外实验表明,Itch通过调节TGF-β信号通路,参与肾小球硬化的形成。经相关文献搜索,尚未发现Itch参与其他局灶硬化性肾小球疾病的发生。
纤维化相关基因胶原基因Col4A3,其编码产物为肾小球基膜的组成成分,在3例原发性FSGS患者肾小球中Col4A3表达均有下调,该基因突变,也可引起AD和常染色体隐形遗传(AR)的Alport综合征(AS)和薄基膜病(TBMD)。Voskarides等[32]报道,Col4A3杂合突变见于薄基膜肾病(TBMN)的家系,携带该突变的患者早期表现为镜下血尿,逐渐进展为FSGS并出现蛋白尿,肾功能可逐渐下降至终末期肾病,但Col4A3突变的TBMN患者进展为FSGS易感性增加 ,其机制尚不明确。但胶原基因在多种硬化性肾小球病中表达均上调,特异度不高。
此外,在患者肾小球中还发现转录因子SOX9表达上调,并经免疫组化证实SOX9在FSGS患者肾小球中高表达,且主要表达于足细胞中。SOX9体外表达还与多种致纤维化基因(如COL2A2,COMP1和COL1)相关,在肾炎动物模型中,SOX9的高表达与肾脏中Col4A2的高表达密切相关,说明SOX9可能在纤维化进程中发挥重要作用。有趣的是,在3例原发性FSGS患者肾小球中,观察到明显的Ⅰ型胶原(Col1A1和Col1A2)高表达,而Ⅰ型胶原可参与肾小球硬化的形成[33]。SOX9和Ⅰ型胶原的高表达,提示了二者在促进FSGS患者小球硬化,瘢痕形成中起促进作用。
除了上述基因,Bennett等[18]的研究还发现,FSGS患者肾小球中凝血酶敏感蛋白、TGF-β的表达均上调。TGF-β被分泌出胞后,作为一种无活性的生长因子,需在胞外与其受体结合并活化后,才能发挥其促纤维化作用,凝血酶敏感蛋白就是其激活物之一,两者共同参与纤维化进程。目前认为,TGF-β需要在胞外经凝血酶敏感蛋白激活,才能发挥其生物学作用;且TGF-β基因的表达反过来可诱导凝血酶敏感蛋白基因的表达[34],两者相互协同,在肾脏疾病中,共同发挥促纤维化作用。另外,TGF-β还可促进Notch-1受体及其配体Jagged1的表达[35],如前所述,Notch信号通路,可引起足细胞凋亡,肾小球节段性硬化形成。但TGF-β广泛参与纤维化进程,其在FSGS中的特异度不高。
FSGS患者肾小球中1型补体受体(CR1)表达下调,CR1可表达于多种细胞表面,包括足细胞,特异性地抑制C3及C5转化酶的形成,阻断过量C3a、C4a、C5a等的生成,从而减弱补体介导的炎症反应。CR1还可清除循环免疫复合物,从而减轻组织损伤[31]。Moll等[37]通过免疫组化发现在FSGS患者肾组织中CR1表达下调,推测CR1低表达可能降低其对补体激活的抑制作用,促使补体活化发动对肾小球细胞的免疫攻击,从而使肾小球损伤、硬化形成。
整合素β3结合蛋白共受体(ITB3BP)可下调纤溶酶原激活物受体的表达,抑制纤维蛋白降解,促进胶原形成和基质增生[38],在FSGS患者肾组织中表达升高。
细胞周期相关基因Schwab等[19]等通过Microarray分析原发性FSGS患者肾组织中转录本发现,参与细胞增殖,与细胞周期相关的CDC34、CDKN2C、CDK5RAP3、CCNG2 (cyclin G2),与DNA复制、细胞分裂相关的ORC5L、PRC1,与染色质分离相关的CETN3(centriole-associated centrin 3)表达均升高,提示 FSGS患者小球中存在损伤后细胞增殖。
而生长抑素受体2在患者肾组织中表达减少。生长抑素通过与受体结合抑制系膜细胞和肾小管上皮细胞增殖,还具有收缩肾血管的作用,可降低肾血流量,降低肾小球滤过率;通过抑制远曲小管对水的通透性,而发挥抗利尿作用;体内试验证明,生长抑素及其类似物可抑制实验动物血管生成[39]。Yoshida等[40]报道在用生长抑素类似物奥曲肽治疗垂体腺瘤时,可减少FSGS患者尿蛋白水平。Bhandari等[41]发现生长抑素受体2在IgAN患者肾组织中表达上调,提示小球损伤,特别是系膜细胞的异常增殖,可反应性引起生长抑素受体2表达上调。尚需进一步研究以探索生长抑素受体在FSGS和IgAN表达中的差异。
肾小球上皮细胞特异性基因在石蜡组织的肾小球中发现调控足细胞表型的基因——PAX2发生异常,其表达上调。PAX2通常表达于肾间质,是未成熟足细胞的标志物,而在成熟足细胞中不表达[42],足细胞特异性PAX2转基因鼠可表现为肾小球塌陷等病变,表明PAX2可能参与小球病变的进展;而成熟足细胞的标志物,podocalyxin、synaptopodin表达下调,表明FSGS患者肾小球中,存在足细胞表型异常。
壁层上皮细胞特异性基因CD24、CLDN1、KRT 18、KRT 19也显示高表达,Appel等[43]发现壁层上皮细胞可作为足细胞前体细胞的来源,在足细胞遭受损伤时,可重分化为足细胞,修补损伤的肾小球基膜屏障,Smeets等[44]已在塌陷型FSGS模型中验证了这一过程。
转录因子基因转录因子基因PAX8在肾脏早期形成中发挥重要作用,其在FSGS患者小球中的高表达,部分解释了FSGS患者小球细胞损伤后再生[45]。
参与DNA转录的基因维生素A酸受体ɑ(RARA)在塌陷型FSGS患者肾组织中明显高表达,其具有抗凋亡活性,可抑制体外培养的系膜细胞产生基质;还可通过环磷酸腺苷(cAMP)途径抑制HIV-1介导的足细胞增殖,使足细胞停留于G1期,在FSGS患者肾小球中发挥抑制细胞凋亡、促进硬化形成、调节细胞增殖的作用[46]。Woo等[47]通过Microarray分析发现IgAN患者外周血白细胞中RARA低表达,RARA激动剂可降低Shaier的小鼠(抗Thy1.1,抗体肾炎小鼠)(Thy-GN小鼠)[48](肾脏组织学表现为系膜增生,模拟人类IgAN)蛋白尿水平,使血压恢复正常。RARA在FSGS患者肾组织中的高表达,而在IgAN患者外周血白细胞中的低表达,提示其可能有助于区分两种疾病,但尚需统一组织来源以增加结果的准确性。
钙离子结合蛋白基因AIF1产物为一种钙离子结合蛋白,在患者肾组织中低表达,AIF1弥漫分布于足细胞胞质,并与肌动蛋白共定位,通过肌动蛋白的聚合作用,调节细胞迁移。对维持足细胞的细胞骨架的稳定性发挥重要作用。
足细胞功能相关基因MAFB在FSGS患者肾小球中低表达,该基因敲除的新生小鼠表现足突消失、蛋白尿、足细胞nephrin和podocin表达下调。
综上所述,炎症与肿瘤相关基因osteopontin参与FSGS肾小球硬化及DN的进程;IL-8参与FSGS肾小球损伤及IgAN的进程;CD24、CXCL1基因与FSGS肾小球细胞增殖、结构损伤有关。信号通路相关基因Notch受体家族参与FSGS及DN的进程;Itch通过调节TGF-β信号通路,参与FSGS肾小球硬化的形成。纤维化相关基因中胶原基因Col4A3、Col4A2参与多种硬化性肾小球疾病的发生。细胞周期相关基因生长抑素受体2在FSGS患者损伤肾组织中表达减少,在IgAN患者肾组织中反应性表达上调。足细胞特异性基因podocalyxin、synaptopodin、nephrin、podocin与足细胞及裂隙膜结构及功能维持相关,在FSGS中表达下调,已有大量研究报道相关基因突变参与FFSGS的发病。参与DNA转录的基因RARA有抗凋亡、抑制系膜基质产生的作用,其在塌陷型FSGS患者肾组织中高表达,在IgAN患者外周血白细胞中的低表达,尚需进一步研究生长抑素受体2、RARA在FSGS与IgAN患者中表达的差异,以发现FSGS发病中特有的分子过程和机制。
随着转录组学的发展,对转录本的高通量分析将对FSGS发病机制的探索提供越来越多的线索,但通过分离肾小球获取高质量的RNA仍有一定的难度,通过筛网、微切割、直接挑取等分离肾小球的方法虽然比较成熟,但操作过程中RNA的降解仍难以避免; Microarray得到的极端值的处理和验证率不高的问题,都是实际操作中需要解决的。
随着转录组学数据库的不断完善,将提供更全面的转录本表达信息,标志基因的差异表达与治疗反应相关联将成为可能,进一步为FSGS的诊断及新的治疗靶标的发现提供依据。
1de Mik SM,Hoogduijn MJ,de Bruin RW,et al.Pathophysiology and treatment of focal segmental glomerulosclerosis:the role of animal models.BMC Nephrol,2013,14:74.
2Xie J,Chen N.Primary glomerulonephritis in mainland China:an overview.Contrib Nephrol,2013,181:1-11.
3Freedman BI,Kopp JB,Langefeld CD,et al.The apolipoprotein L1 (APOL1) gene and nondiabetic nephropathy in African Americans.J Am Soc Nephrol,2010,21(9):1422-1426.
4Wittenhagen P,Andersen JB,Hansen A,et al.Plasma soluble urokinase plasminogen activator receptor in children with urinary tract infection,Biomark Insights,2011,6:79-82.
5Costa V,Angelini C,De Feis I,et al.Uncovering the complexity of transcriptomes with RNA-Seq.J Biomed Biotechnol,2010,2010:853916.
6Malone JH,Oliver B.Microarrays,deep sequencing and the true measure of the transcriptome.BMC Biol,2011,9:34.
7Mori A,Deola S,Xumerle L,et al.Next generation sequencing:new tools in immunology and hematology.Blood Res,2013,48(4):242-249.
8Garrido N,García-Herrero S,Meseguer M.Assessment of sperm using mRNA microarray technology.Fertil Steril,2013,99(4):1008-1022.
9Barrett T,Edgar R.Gene expression omnibus:microarray data storage,submission,retrieval,and analysis.Methods Enzymol,2006,411:352-369.
10 Fernandez-Silva I,Whitney J,Wainwright B,et al.Microsatellites for next-generation ecologists:a post-sequencing bioinformatics pipeline.PLoS One,2013,8(2):e55990.
11 Wang Z,Gerstein M,Snyder M.RNA-Seq:a revolutionary tool for transcriptomics.Nat Rev Genet,2009,10(1):57-63.
12 Fan X,Lobenhofer EK,Chen M,et al.Consistency of predictive signature genes and classifiers generated using different microarray platforms.Pharmacogenomics J,2010,10(4):247-257.
13 Lagos-Quintana M,Rauhut R,Lendeckel W,et al.Identification of novel genes coding for small expressed RNAs.Science,2001,294(5543):853-858.
14 McHale CM,Zhang L,Thomas R,et al.Analysis of the transcriptome in molecular epidemiology studies.Environ Mol Mutagen,2013,54(7):500-517.
15 Malone JH,Oliver B.Microarrays,deep sequencing and the true measure of the transcriptome.BMC Biol,2011,9:34.
16 Agarwal A,Koppstein D,Rozowsky J,et al.Comparison and calibration of transcriptome data from RNA-Seq and tiling arrays.BMC Genomics,2010,11:383.
17 Telonis-Scott M,Kopp A,Wayne ML,et al.Sex-specific splicing in Drosophila:widespread occurrence,tissue specificity and evolutionary conservation.Genetics,2009,181(2):421-434.
18 Bennett MR,Czech KA,Arend LJ,et al.Laser capture microdissection-microarray analysis of focal segmental glomerulosclerosis glomeruli.Nephron Exp Nephrol,2007,107(1):e30-40.
19 Schwab K,Witte DP,Aronow BJ,et al.Microarray analysis of focal segmental glomerulosclerosis.Am J Nephrol,2004,24(4):438-447.
20 Hodgin JB,Borczuk AC,Nasr SH,et al.A molecular profile of focal segmental glomerulosclerosis from formalin-fixed,paraffin-embedded tissue.Am J Pathol,2010,177(4):1674-1686.
21 Rangaswami H,Bulbule A,Kundu GC,et al.Osteopontin:role in cell signaling and cancer progression.Trends Cell Biol,2006,16(2):79-87.
22 Endlich N,Sunohara M,Nietfeld W,et al.Analysis of differential gene expression in stretched podocytes:osteopontin enhances adaptation of podocytes to mechanical stress.FASEB J,2002,16(13):1850-1852.
23 Yoo KH,Thornhill BA,Forbes MS,et al.Osteopontin regulates renal apoptosis and interstitial fibrosis in neonatal chronic unilateral ureteral obstruction.Kidney Int,2006,70(10):1735-1741.
24 Ma R,Liu L,Liu X,et al.Triptolide markedly attenuates albuminuria and podocyte injury in an animal model of diabetic nephropathy.Exp Ther Med,2013,6(3):649-656.
25 Wada T,Tomosugi N,Naito T,et al.Prevention of proteinuria by the administration of anti-interleukin 8 antibody in experimental acute immune complex-induced glomerulonephritis.Exp Med,1994,180(3):1135-1140.
26 Preston GA,Waga I,Alcorta DA,et al.Gene expression profiles of circulating leukocytes correlate with renal disease activity in IgA nephropathy.Kidney Int,2004,65(2):420-430.
27 Dekel B,Zangi L,Shezen E,et al.Isolation and characterization of nontubular sca-1+lin- multipotent stem/progenitor cells from adult mouse kidney.J Am Soc Nephrol,2006,17(12):3300-3314.
28 Barisoni L,Schnaper HW,Kopp JB.A proposed taxonomy for the podocytopathies:a reassessment of the primary nephrotic diseases.Clin J Am Soc Nephrol,2007,2(3):529-542.
29 Mertens PR,Raffetseder U,Rauen T.Notch receptors:a new target in glomerular diseases.Nephrol Dial Transplant,2008,23(9):2743-2745.
30 El-Meanawy A,Schelling JR,Iyengar SK,et al.Identification of nephropathy candidate genes by comparing sclerosis-prone and sclerosis-resistant mouse strain kidney transcriptomes.BMC Nephrol,2012,13:61.
31 Bai Y,Yang C,Hu K,et al.Itch E3 ligase-mediated regulation of TGF-beta signaling by modulating smad2 phosphorylation.Mol Cell,2004,15(5):825-831.
32 Voskarides K,Damianou L,Neocleous V,et al.COL4A3/COL4A4 mutations producing focal segmental glomerulosclerosis and renal failure in thin basement membrane nephropathy.J Am Soc Nephrol,2007,18(11):3004-3016.
33 Beirowski B,Weber M,Gross O.Chronic renal failure and shortened lifespan in COL4A3+/- mice:an animal model for thin basement membrane nephropathy.J Am Soc Nephrol,2006,17(7):1986-1994.
34 Casalena G,Daehn I,Bottinger E.Transforming growth factor-beta,bioenergetics,and mitochondria in renal disease.Semin Nephrol,2012,32(3):295-303.
35 Niranjan T,Bielesz B,Gruenwald A,et al.The Notch pathway in podocytes plays a role in the development of glomerular disease.Nat Med,2008,14(3):290-298.
36 Velosa J,Miller K,Michael AF.Immunopathology of the end-stage kidney.Immunoglobulin and complement component deposition in nonimmune disease.Am J Pathol,1976,84(1):149-162.
37 Moll S,Miot S,Sadallah S,et al.No complement receptor 1 stumps on podocytes in human glomerulopathies.Kidney Int,2001,59(1):160-168.
38 Hapke S,Gawaz M,Dehne K,et al.beta(3)A-integrin downregulates the urokinase-type plasminogen activator receptor (u-PAR) through a PEA3/ets transcriptional silencing element in the u-PAR promoter.Mol Cell Biol,2001,21(6):2118-2132.
39 Adams RL,Adams IP,Lindow SW,et al.Inhibition of endothelial proliferation by the somatostatin analogue SOM230.Clin Endocrinol (Oxf),2004,61(4):431-436.
40 Yoshida H,Akikusa B,Saeki N,et al.Effect of pituitary microsurgery on acromegaly complicated nephrotic syndrome with focal segmental glomerulosclerosis:report of a rare clinical case.Am J Kidney Dis,1999,33(6):1158-1163.
41 Bhandari S,Watson N,Long E,et al.Expression of Somatostatin and Somatostatin Receptor Subtypes 1-5 in Human Normal and Diseased Kidney.J Histochem Cytochem,2008,56(8):733-743.
42 Appel D, Kershaw DB, Smeets B, et al. Recruitment of podocytes from glomerular parietal epithelial cells. J Am Soc Nephrol, 2009, 20(2):333-343.
43 Wagner KD,Wagner N,Guo JK,et al.An inducible mouse model for PAX2-dependent glomerular disease:insights into a complex pathogenesis.Curr Biol,2006,16(8):793-800.
44 Smeets B,Dijkman HB,Wetzels JF,et al.Lessons from studies on focal segmental glomerulosclerosis:an important role for parietal epithelial cells? J Pathol,2006,210(3):263-272.
45 Alexiev BA,LeVea CM.Nephrogenic adenoma of the urinary tract:a review.Int J Surg Pathol,2012,20(2):123-131.
46 Liu X,Lü L,Tao BB,et al.All-trans retinoic acid inhibits the increases in fibronectin and PAI-1 induced by TGF-beta1 and Ang II in rat mesangial cells.Acta Pharmacol Sin,2008,29(9):1035-1041.
47 Woo KT,Lau YK,Zhao Y,et al.Urotensin 2 and retinoic acid receptor alpha (RARA) gene expression in IgA nephropathy.Ann Acad Med Singapore,2010,39(9):705-709.
48 Schaier M,Liebler S,Schade K,et al.Retinoic acid receptor alpha and retinoid X receptor specific agonists reduce renal injury in established chronic glomerulonephritis of the rat.J Mol Med (Berl),2004,82(2):116-125.
