谷胱甘肽S⁃转移酶M1、T1基因多态性及氧化应激与非小细胞肺癌易感性
2014-03-21张红艳吴绪伟肖谊陈梅李志东李艳丽唐开发
张红艳,吴绪伟,肖谊,陈梅,李志东,李艳丽,唐开发
(1.昆明医科大学附属延安医院呼吸一科,昆明650051;2.贵阳医学院医学科学研究所,贵阳550004)
谷胱甘肽S⁃转移酶M1、T1基因多态性及氧化应激与非小细胞肺癌易感性
张红艳1,吴绪伟1,肖谊1,陈梅1,李志东1,李艳丽1,唐开发2
(1.昆明医科大学附属延安医院呼吸一科,昆明650051;2.贵阳医学院医学科学研究所,贵阳550004)
目的探讨谷胱甘肽S-转移酶M1、T1(GSTM1、T1)基因多态性及氧化应激损伤对非小细胞肺癌易感性。方法本病例对照研究包括110名非小细胞肺癌患者(病例组)和100名正常健康对照者(对照组)。所有研究对象外周血基因组DNAGSTM1、T1基因型采用聚合酶链反应(PCR)技术进行检测;外周血清丙二醛(MDA)、一氧化氮(NO)浓度及总抗氧化能力(TAOC)采用分光光度计检测方法测定。结果GSTM1、T1基因缺失型及GSTM1/T1缺失型在病例组明显高于对照组(OR1= 2.071,P1=0.009;OR2=1.900,P2=0.024;OR3=3.258,P3=0.003)。MDA及NO水平在病例组显著高于对照组(P<0.001),而TAOC水平则在病例组明显低于对照组(P<0.001)。同时,病例组中GSTM1、T1基因缺失型及GSTM1/T1缺失型亚组MDA及NO浓度水平明显高于野生型亚组,而T-AOC水平明显低于野生型亚组(P均<0.001)。结论氧化损伤在非小细胞肺癌的发生发展过程中可能扮演着重要角色,而GSTM1、T1基因缺失型非小细胞肺癌患者更易受到氧化应激损伤。
谷胱甘肽S-转移酶;多态性;氧化应激;非小细胞肺癌
肺癌已成为美国、欧洲以及亚洲各国的癌症患者死亡的最主要原因之一,是对人群健康和生命威胁较大的恶性肿瘤之一,发病率和死亡率有逐年增加的趋势[1]。肺癌病理类型中非小细胞肺癌(nonsmall cell lung cancer,N-SCLC)约占80%。然而,由于早期诊断困难,不能及时治疗从而导致N-SCLC患者的预后较差[2]。由于肺表面积直接与空气接触,加上高氧张力,从而导致大量的活性氧(reactive oxygen species,ROS)产生[3]。自由基产生主要包括外源性[如环境中的刺激物和污染物(香烟烟雾、臭氧等)]及内源性因素(如炎性细胞的激活),既往研究认为氧化应激及自由基可能对多种癌症的易感性增加[4]。另外的研究结果表明,暴露于氧化应激可导致单一或聚集的细胞DNA损伤,从而致基因突变和基因重组,最终导致恶变[4,5]。Ito等[6]研究发现在从不吸烟者N-SCLC患者总抗氧化能力(total antioxidant capacity,T-AOC)明显降低,可能增加肺组织DNA对氧化应激的损伤。Peddireddy等[7]研究认为在N-SCLC发生发展中增加氧化应激导致氧化—抗氧化能力平衡失调,从而增加脂质过氧化对DNA的损伤。
谷胱甘肽S-转移酶(glutathione S-transferases,GST)是一个Ⅱ相代谢酶家族,其通过还原型谷胱甘肽共轭还原反应消除氧化应激产生的有毒的亲电子和产物[8]。GSTM1能解毒苯并芘二醇环氧化物,而GSTT1能清除共轭的氧化脂质和卤代化合物,既往有研究认为GSTM1及GSTT1基因缺失型可能与肺癌的发生发展存在易感性,然而也有研究表明两者之间无明显的相关性[9,10]。
然而,到目前未发现有关于GST基因多态性及氧化应激水平对N-SCLC患者易感性研究。本研究我们主要对云南地区的N-SCLC患者的GSTM1、T1基因多态性及氧化应激水平(MDA、NO及T-AOC)进行研究,以探讨两者之间的关系。
1 材料与方法
1.1 研究对象
该研究包括110例N-SCLC患者及100例匹配的正常健康对照。其性别、年龄、吸烟史及临床特征需详细记录。所有N-SCLC患者均为首次到医院就诊通过临床特征、体格检查、血清生化检查、X线、CT及经皮穿刺活检或手术标本病理证实为NSCLC,其中鳞癌62例,腺癌48例。临床根据TNM分期,Ⅰ期19例,Ⅱ期26例,Ⅲ期31例,Ⅳ期34例。所有患者之前未进行过任何治疗。对照组选自同时期、同地区的正常健康志愿者。对所有患者及对照者一般情况及既往史等均进行详细问卷调查。该研究得到昆明医科大学附属延安医院医学伦理学委员会批准。
1.2 引物设计和合成
根据基因序列,采用prime5软件设计PCR扩增引物GSTM1:Forward 5′-GAACTCCCTGAAAAGCTA AAGC-3′,Reverse 5′-GTTGGGCTCAAATATACGGT GG-3′;GSTT1:Forward 5′-TTCCTTACTGGTCCT CA CATCTC-3′,Reverse 5′-TCACCGGATCATGGC CAGCA-3′;并β-actin为内参照,引物序列为:Forward 5′-ACTCCCCATCCCAAGACC-3′,Reverse 5′-CCTTAATGTCACGCACGA T-3′。
1.3 外周血标本采集和基因组DNA提取
采取所有研究对象外周静脉血6 mL,其中3 mL以乙二胺四乙酸二钠(EDTA)作为抗凝剂混匀为抗凝血液,放置于-80℃低温冰箱备用。基因组DNA提取按照外周血微量基因组DNA提取试剂盒说明书操作;另外3 mL经1 000 r/min离心后对血清进行分离备用。
1.4GSTM1基因型PCR扩增
采用Biomltra梯度PCR仪对所有DNA标本进行GSTM1、T1基因型检测。反应体系为25 μL,反应条件为95℃预变性5 min;94℃变性30 s,60℃(63℃)退火30 s,72℃延伸30 s,共30个循环;72℃延伸7 min[11]。
1.5 电泳检测
PCR扩增产物用2%琼脂糖凝胶电泳,采用凝胶成像系统进行检测。GSTM1基因扩增产物为219 bp,GSTM1基因扩展产物为480 bp,β-actin扩增产物为400 bp,所有样本均重复3次PCR扩增及电泳检测。
1.6 氧化应激水平检测
主要检测血清中MDA、NO及T-AOC。检测方法按照试剂盒说明书进行。
1.7 统计学分析
2 结果
我们发现病例组和对照组在性别、年龄及吸烟史方面无统计学差异(P>0.05),见表1。
病例组GSTM1(-)比例显著高于对照组(OR= 2.071;95%CI 1.194~3.593;P=0.009);病例组GSTT1(-)比例显著高于对照组(P=0.024);病例组GSTM1/T1(-/-)比例显著高于对照组(P=0.003),见图1、表2。
在该研究中,病例组血清中MDA及NO水平显著高于对照组(P<0.001),而T-AOC水平显著低于对照组(P<0.001)。同时我们发现在病例组中,MDA和NO水平在GSTM1(-)、GSTT1(-)及GSTM1/ T1(-/-)亚组中分别显著高于GSTM1(+)、GSTT1(+)及GSTM1/T1(+/+)亚组(P均<0.001);而T-AOC水平则是GSTM1(-)、GSTT1(-)及GSTM1/T1(-/-)亚组分别显著低于GSTM1(+)、GSTT1(+)及GSTM1/T1(+/+)亚组(P均<0.001)。见表3。
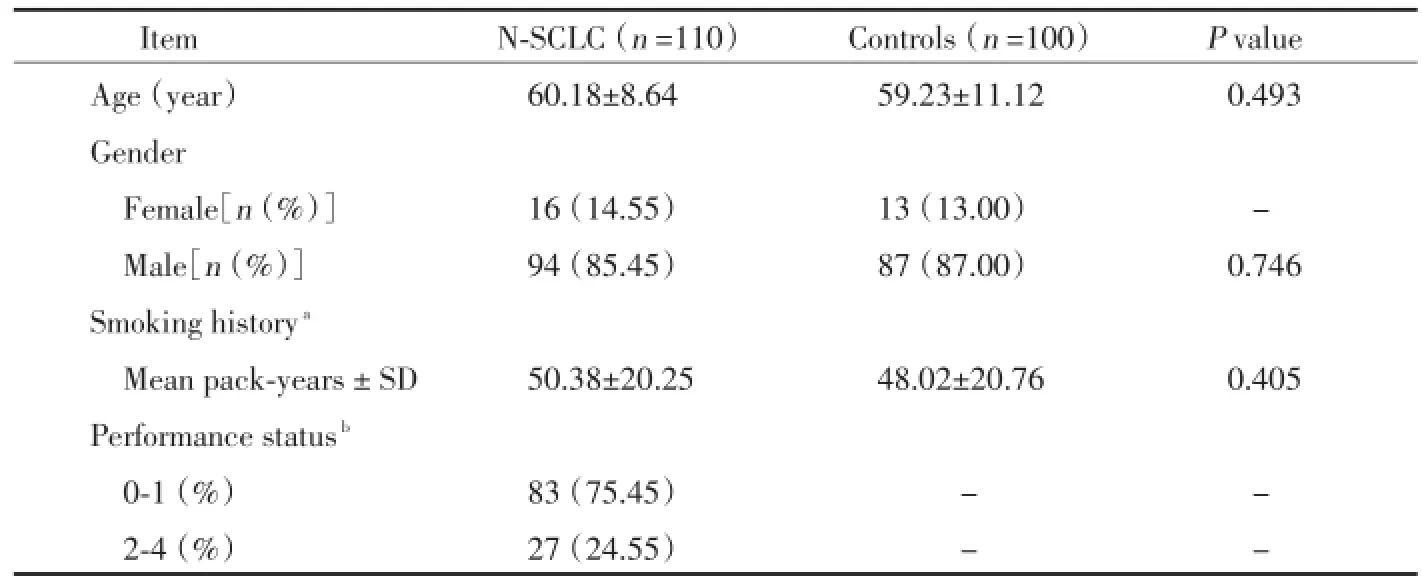
表1 所有研究对象人口数据及临床特征Tab.1 Demographic and clinical characteristics data of all subjects

表2 GSTM1、T1基因在病例组及对照各组频率分布Tab.2 The distribution of glutathione S⁃transferase M1and T1genotypes in study groups
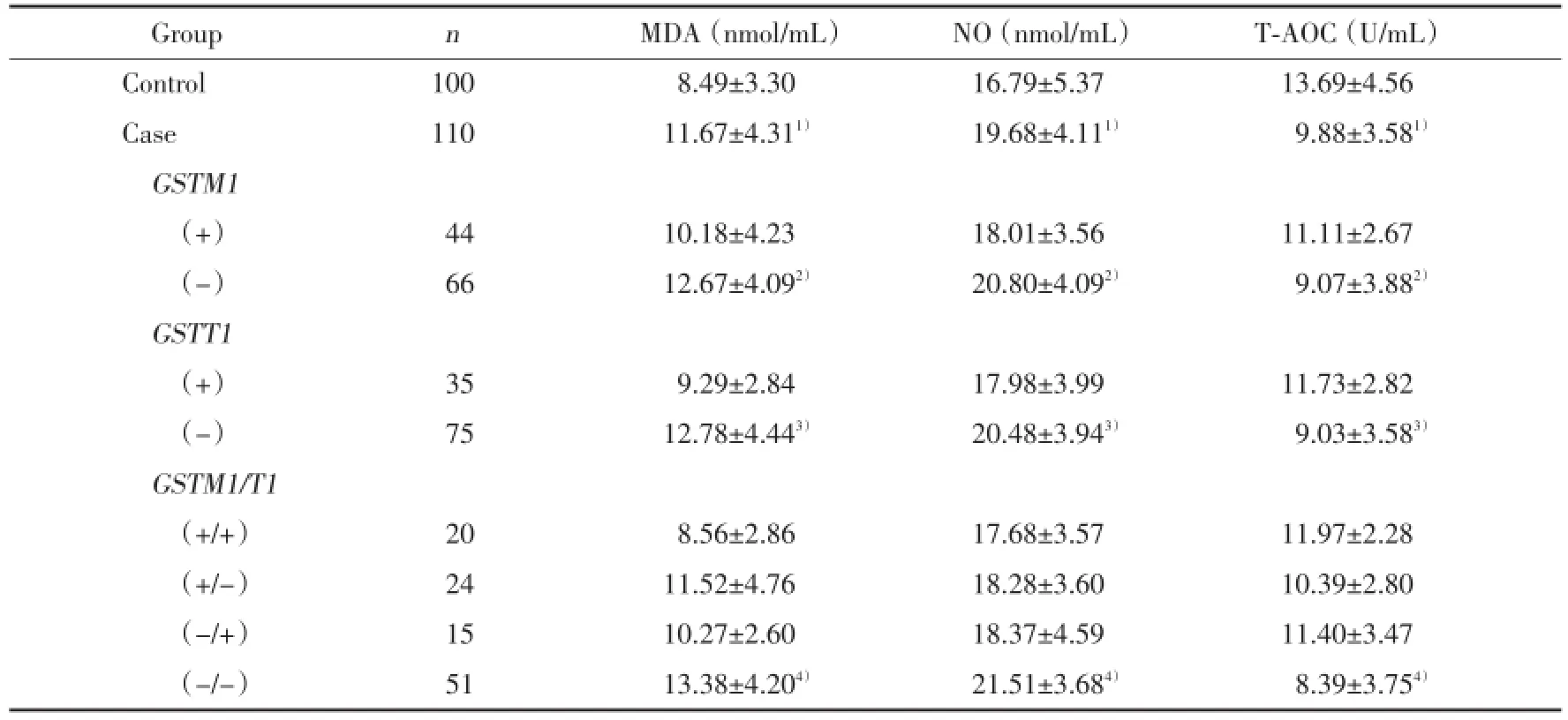
表3 GSTM1、T1基因多态性与血清MDA、NO及T⁃AOC相关性Tab.3 Genetic polymorphisms of glutathione S⁃transferase M1and T1in relation to plasma MDA,NO and T⁃AOC
3 讨论
氧化应激是指体内氧化与抗氧化作用失衡,倾向于氧化,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物,其产生的物质叫活性氧(reactive oxygen species,ROS)。同时,机体也存在着消除氧化应激的保护物质被称为抗氧化剂,两者之间的不平衡导致重要的分子和细胞损伤,从而对整个机体造成影响[12]。此外,肿瘤的发生和进展过程中也伴随着氧化应激导致增加DNA突变,诱导DNA损伤,相关基因组重组以及细胞增殖[13]。既往研究认为机体氧化应激水平增加在N-SCLC发生发展过程中扮演着重要的角色[6,7]。在该研究中,我们发现病例组血清中MDA及NO水平显著高于对照组,同时在病例组中,MDA及NO在GSTM1及T1基因缺失型组显著高于野生型组,T-AOC则低于野生型组。因此,我们认为血清中高水平的MDA及NO,低水平T-AOC是N-SCLC的危险因素。
作为机体抗氧化最重要的成员之一,谷胱甘肽S-转移酶属机体Ⅱ相代谢酶家族,包含α(A),μ(M),π(P),σ(σ),ζ(ζ),ω(ω)和θ(T)。其通过共轭反应催化多种内源和外源性化合物包括ROS、致癌物质以及其代谢产物。人胞浆GST基因具有遗传多态性,从而导致GST活性改变,这增加了机体对氧化损伤的易感性。既往研究表明,GSTM1和GSTT1基因缺失型可增加肺癌易感性[9,14]。但也有研究认为GSTM1和GSTT1基因缺失型与肺癌发生发展没有相关性[10]。本研究我们发现病例组GSTM1(-)、GSTT1(-)及GSTM1/T1(-/-)比例显著高于对照组。因此,GSTM1、GSTT1及GSTM1/T1缺失型可能为N-SCLC的危险因素。
同时,我们对N-SCLC患者GSTM1、T1基因多态性及血清氧化应激水平进行检测分析,发现GSTM1、GSTT1及GSTM1/T1基因缺失型患者血清中MDA及NO水平高于野生型组,而T-AOC水平则低于野生型组。因此,GSTM1及T1基因缺失型可能增加氧化应激对机体的易感性,增加N-SCLC的风险。
综上所述,氧化应激在N-SCLC发生发展过程中扮演着重要的角色,而GSTM1、GSTT1基因缺失型增加了机体对氧化应激的损伤。然而,本研究单中心及样本量较小,具有一定的局限性,需大样本及多中心研究进一步证实。
[1]Thun MJ,Hannan LM,Adams-Campbell LL,et al.Lung cancer occurrence in never-smokers:an analysis of 13 cohorts and 22 cancer registry studies[J].PLoS Med,2008,5(9):e185.
[2]Jemal A,Siegel R,Xu J,et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[3]Wu W,Platoshyn O,Firth AL,et al.Hypoxia divergently regulates production of reactive oxygen species in human pulmonary and coronary artery smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2007,293(4):L952-L959.
[4]Farinati F,Piciocchi M,Lavezzo E,et al.Oxidative stress and induc-ible nitric oxide synthase induction in carcinogenesis[J].Dig Dis,2010,28(4-5):579-584.
[5]Cadet J,Douki T,Ravanat JL.Oxidatively generated base damage to cellular DNA[J].Free Radic Biol Med,2010,49(1):9-21.
[6]Ito K,Yano T,Morodomi Y,et al.Serum antioxidant capacity and oxidative injury to pulmonary DNA in never-smokers with primary lung cancer[J].Anticancer Res,2012,32(3):1063-1067.
[7]Peddireddy V,Badabagni SP,Gundimeda SD,et al.Assessment of 8-oxo-7,8-dihydro-2′-deoxyguanosine and malondialdehyde levels as oxidative stress markers and antioxidant status in non-small cell lung cancer[J].Biomarkers,2012,35(9):1023-1028.
[8]Rezaei MK,Shobbar ZS,Shahbazi M,et al.Glutathione S-transferase(GST)family in barley:identification of members,enzyme activity,and gene expression pattern[J].J Plant Physiol,2013,170(14):1277-1284.
[9]Matakova T,Sivonova M,Halasova E,et al.Gene polymorphisms of biotransforming enzymes(GSTs)and their association with lung cancer in the Slovakian population[J].Eur J Med Res,2009,14 Suppl 4:275-279.
[10]Tamaki Y,Arai T,Sugimura H,et al.Association between cancer risk and drug-metabolizing enzyme gene(CYP2A6,CYP2A13,CYP4B1,SULT1A1,GSTM1,and GSTT1)polymorphisms in cases of lung cancer in Japan[J].Drug Metab Pharmacokinet,2011,26(5):516-522.
[11]Tang K,Xue W,Xing Y,et al.Genetic polymorphisms of glutathione s-transferase M1,T1,and P1,and the assessment of oxidative damage in infertile men with varicoceles from northwestern china[J].J Androl,2012,33(2):257-263.
[12]Durackova Z.Some current insights into oxidative stress[J].Physiol Res,2010,59(4):459-469.
[13]Visconti R,Grieco D.New insights on oxidative stress in cancer[J].Curr Opin Drug Discov Devel,2009,12(2):240-245.
[14]Kant SR,Kant S,Mittal B,et al.Comparative study of GST polymorphism in relation to age in COPD and lung cancer[J].Tuberk Toraks,2013,61(4):275-282.
(编辑 武玉欣)
Genetic Polymorphisms of Glutathione S-transferase M1and T1and Evaluation of Oxidative Stress in Patientswith Non-smallCellLung Cancer
ZHANGHong-yan1,WUXu-wei1,XIAOYi1,CHENMei1,LIZhi-dong1,LIYan-li1,TANGKai-fa2
(1.The First Department of Respiration,The Affiliated Yan’an Hospital,Kunming Medical University,Kunming 650051,China,2.Institute of Medical Science of Guiyang MedicalCollege,Guiyang 550004,China)
ObjectiveTo investigate the genetic polymorphisms ofthe glutathione S-transferase M1 and T1 genes(GSTM1andGSTT1),and evaluate the oxidative damage in patients with non-smalllung cancer(N-SCLC).MethodsA totalof110 patients with N-SCLC and 100 healthy individuals were recruited in this case-control study.Multiplex polymerase chain reaction(PCR)analysis was used to identify the genotypes.The activity of malondialdehyde(MDA),nitric oxide(NO),and the total antioxidant capacity(T-AOC)were detected by spectroscopic analysis using assay kits.ResultsThe frequencies of theGSTM1,T1,and GSTM1/T1 null genotypes in the patient group were significantly higher than those in control group(OR1=2.071,P1=0.009;OR2=1.900,P2=0.024;OR3=3.258,P3=0.003).The activity of MDA and NO were obviously higher in the patient group compared with the control group(P<0.001),and T-AOC was obviously lower in patient group than those in control group(P<0.001). The activity of MDA,and NO were higher but the T-AOC were lower in patients withGSTM1,T1andGSTM1/T1null genotypes than those in patients withGSTM1,T1andGSTM1/T1present genotypes(P<0.001).ConclusionOur results suggest that oxidative damage may play a importantrole in patients with N-SCLC,and the N-SCLC patientswithGSTM1andGSTT1deletion genotypesare more susceptible to oxidative damage.
glutathione S-transferases;polymorphism;oxidative stress;non-small lung cancer
R563
A
0258-4646(2014)05-0432-05
云南省应用基础研究基金(2010ZC198)
张红艳(1982-),女,主治医师,硕士.
唐开发,E-mail:doc.tangkf@hotmail.com
2013-12-15
网络出版时间:
