血管活性肠肽对哮喘气道重塑小鼠肺组织转化生长因子β1表达的影响
2014-03-21王娟尚云晓
王娟,尚云晓
(中国医科大学附属盛京医院小儿呼吸内科,沈阳110004)
血管活性肠肽对哮喘气道重塑小鼠肺组织转化生长因子β1表达的影响
王娟,尚云晓
(中国医科大学附属盛京医院小儿呼吸内科,沈阳110004)
目的探讨血管活性肠肽对哮喘气道重塑小鼠肺组织转化生长因子β1(TGF-β1)表达的影响。方法SPF级雌性Balb/c小鼠30只,随机分为正常对照组(A组)、哮喘模型组(B组)、血管活性肠肽组(C组),每组10只。B组、C组动物建立哮喘气道重塑模型。HE染色观察各组小鼠支气管及肺组织病理改变,以病理图像分析测量小鼠肺组织中支气管基底膜周长(Pbm)、支气管壁面积(WAi)和平滑肌层面积(WAm);实时定量PCR方法检测各组小鼠肺组织TGF-β1mRNA表达,Western blot方法检测各组小鼠肺组织TGF-β1蛋白表达。结果B组小鼠肺组织病理改变:胶原沉积和炎性细胞浸润,平滑肌层增厚,其WAi/Pbm及WAm/Pbm较A组明显增加(P<0.05);C组上述指标较A组增加,但较B组降低,差异有统计学意义(P<0.05)。B组TGF-β1mRNA和蛋白表达水平均高于A组,差异有统计学意义(P<0.05);C组TGF-β1mRNA和蛋白表达水平均低于B组,差异有统计学意义(P<0.05)。结论血管活性肠肽有抑制气道重塑作用,其机制可能与减少TGF-β1表达有关。
血管活性肠肽;支气管哮喘;气道重塑;转化生长因子β1
支气管哮喘(简称哮喘)是慢性气道炎症、气道高反应性及气道重塑长期作用的结果,目前的治疗药物包括糖皮质激素、支气管扩张剂等,侧重于缓解哮喘急性发作及减轻气道慢性炎症,但对治疗气道重塑的相关研究较少。转化生长因子β1(transforming growth factor-β1,TGF-β1)是哮喘气道重塑的重要调控因子,可以诱导气道平滑肌增生和胶原沉积,从而导致气道重塑。因此,减少气道TGF-β1表达可能减轻气道重塑,有益于哮喘的治疗。血管活性肠肽(vasoactive intestinal peptide,VIP)作为抑制性非肾上腺素能非胆碱能神经递质,具有强大的支气管舒张及减轻气道炎症作用。本实验通过卵蛋白致敏构建Balb/c小鼠气道重塑模型,探讨VIP对哮喘气道重塑小鼠肺组织TGF-β1表达的影响,为其应用于哮喘的治疗提供实验依据。
1 材料与方法
1.1 实验动物及主要仪器、试剂
6~8周龄SPF级雌性Balb/c小鼠30只,购于中国医科大学附属盛京医院动物室,体质量18~22 g。卵蛋白、VIP(美国Sigma公司),氢氧化铝粉末(上海美兴化工股份有限公司),RIPA裂解液、BCA蛋白浓度测定试剂盒(碧云天生物技术研究所),PVDF膜(美国Millipore公司),ECL发光液(美国Thermo公司),Trizol总RNA提取试剂盒、定量PCR试剂盒(大连TaKaRa公司),TGF-β1多克隆抗体(北京博奥森公司)。病理图像分析软件(NIS-Elements Br3.0),超声雾化器,凝胶电泳槽、凝胶成像分析系统(Gel-Pro-Analyzer),实时定量PCR仪(ABI 7500)。
1.2 动物分组及处理
将Balb/c小鼠随机分为3组:正常对照组(A组)、哮喘模型组(B组)、VIP治疗组(C组),每组10只。动物适应性喂养1周后开始实验,哮喘动物模型制作参照Temelkovski等[1]的方法并加以改良,即B、C组分别于第0、7和14天无菌条件下腹腔注射致敏液0.2 mL(含卵蛋白100 μg+氢氧化铝粉末1 mg)。第21天开始雾化激发,将B、C组小鼠置于自制雾化容器中(20 cm×20 cm×20 cm),雾化吸入2%卵蛋白溶液,每次30 min,隔日1次,共8周。A组分别于第0、7和14天无菌条件下腹腔注射PBS液0.2 mL,雾化时予生理盐水替代2%卵蛋白溶液,C组于每次激发前予VIP 150 μg/kg腹腔注射。
1.3 标本采集
在雾化激发结束后24 h内进行取材。予小鼠10%水合氯醛0.5 mL/kg腹腔注射进行麻醉,左心室取血处死小鼠,取小鼠左侧肺组织置4%多聚甲醛中固定,用于病理检查。剩余肺组织置于-80℃冰箱保存,用于实时定量PCR及Western blot检测。
1.4 小鼠肺组织病理改变
组织于4%多聚甲醛中固定72 h后进行石蜡包埋,制成组织切片,切片厚度5 μm,HE染色后显微镜下观察各组小鼠肺组织病理改变,应用病理图像分析鉴定气道重塑[2,3]:光镜下(×200)每张切片挑选3支有完整横断面的中小支气管,采用图像采集系统获取图像,再以图像分析软件NIS-Elements Br3.0测量基底膜周径(perimeter of basement membrane,Pbm)、内壁面积(internal wall area,WAi)、平滑肌面积(smooth muscle area,WAm),并用Pbm标准化,即分别以WAi/Pbm(μm2/μm)和WAm/Pbm(μm2/μm)来表示支气管壁厚度及平滑肌层厚度。
1.5 实时定量PCR方法检测小鼠肺组织中TGF-β1mRNA表达
根据GenBank中登录的TGF-β1(NM_011577.1)和内参β-actin(NM_007393)基因序列设计引物,序列如下:TGF-β1基因:上游:5′-GTGTGGAGCAACAT GTGGAACTCTA-3′,下游:5′-CGCTGAATCGAAAG CCCTGTA-3′;β-actin基因:上游:5′-CATCCGTAAA GACCTCTATGCCAAC-3′,下游:5′-ATGGAGCCA CCGATCCACA-3′,以上引物由大连TaKaRa生物工程有限公司合成。取100 mg冻存的肺组织,依据说明书,采用Trizol试剂盒提取总RNA,依据TaKaRa反转录试剂盒说明书合成cDNA,反转录体系为20 μL,以合成的cDNA为模板,进行扩增,反应体系为20 μL,反应条件:95℃变性30 s;95℃5 s,60℃30 s,共40个循环。结果以Ct值表示,即PCR反应指数增长初期荧光信号跨越阈值时的反应循环数。相对定量采用比较Ct法,根据等式RQ=2-△△Ct来计算实验组目的基因TGF-β1的相对表达量。△Ct值表示同一样本中目的基因和内参基因的Ct值差异,△△Ct值表示实验组和对照组间的△Ct值差异。
1.6 Western blot方法检测肺组织TGF-β1蛋白表达
取50 mg肺组织,加入RIPA裂解液,置于冰上,用剪刀尽量将其剪碎并用匀浆机将其制成组织匀浆,14 000 r/min、4℃离心15 min,收集上清,用BCA蛋白浓度测定试剂盒测定蛋白浓度,蛋白变性,上样量为20 μL,电泳时5%浓缩胶80 V,12%分离胶120 V,分离后转移至PVDF膜上,以5%脱脂牛奶室温封闭1 h;加入兔抗鼠TGF-β1抗体(1∶200),4℃孵育过夜;TBST洗膜,加入HRP标记的山羊抗兔IgG(1∶5 000),37℃孵育45 min;TBST洗膜,ECL发光。以β-actin作为内参,用凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.7 统计学分析
2 结果
2.1 各组小鼠肺组织病理变化
A组小鼠的气道上皮完整平滑,未见炎性细胞,气道黏液分泌正常,未见气道增厚情况和胶原沉积;B组小鼠气道上皮中见黏膜脱落,并伴有大量的炎性细胞和黏液分泌,气道壁增厚,胶原沉积;C组较A组病理改变重,较B组病理改变轻(图1)。图像分析测量各组小鼠支气管壁厚度及平滑肌层厚度,C组病理改变较A组重(P<0.05),但较B组明显减轻(P<0.05)。见表1。

表1 各组小鼠气道WAi/Pbm、WAm/Pbm及肺组织中TGF⁃β1mRNA和蛋白表达的比较Tab.1 Comparison of WAi/Pbm and WAm/Pbm and TGF⁃β1mRNA and protein expressions in lung among different group
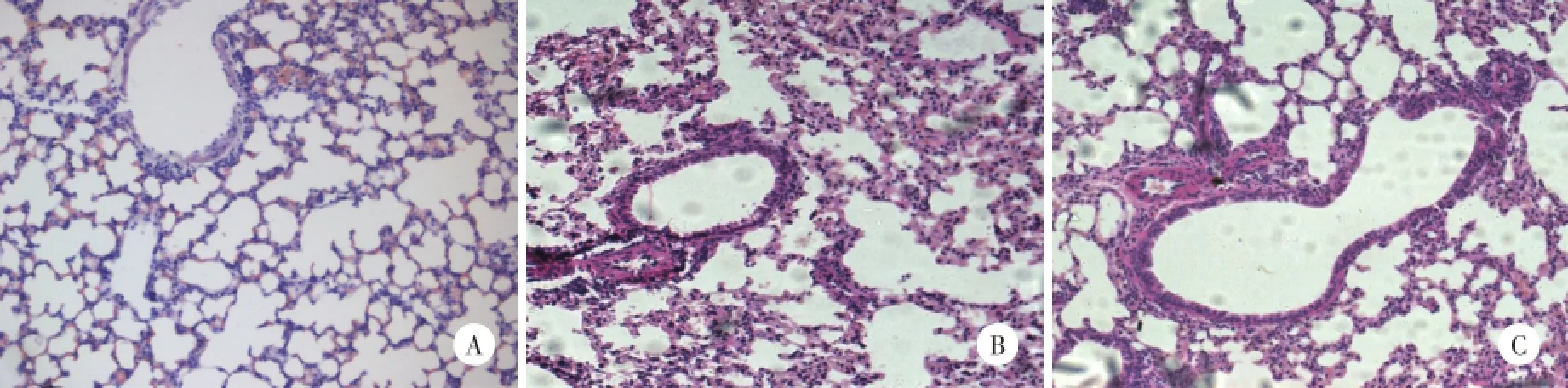
图1 各组小鼠肺组织HE染色×200Fig.1 HE staining of lung tissue×200
2.2 各组小鼠肺组织中TGF-β1mRNA表达
实时定量PCR结果显示,B组及C组小鼠肺组织TGF-β1mRNA水平显著高于A组,差异有统计学意义(P<0.05),C组较B组显著降低(P<0.05)。见表1。
2.3 各组小鼠肺组织中TGF-β1蛋白表达
Western blot结果显示,B组及C组小鼠肺组织中TGF-β1蛋白表达水平显著高于A组,差异有统计学意义(P<0.05),C组较B组显著降低(P<0.05)。见表1。
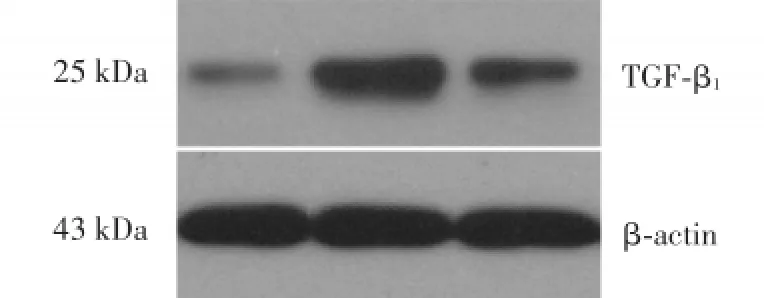
图2 各组小鼠肺组织中TGF⁃β1蛋白表达Fig.2 Expression of TGF⁃β1determined by Western blot
3 讨论
气道重塑作为难治性哮喘的重要病理特点,包括上皮损伤、上皮下纤维化、杯状细胞增生、气道平滑肌细胞增殖和肥大、以及炎性细胞浸润和支气管新生血管形成[4],从而导致气道痉挛可逆性的减弱或消失、气道高反应性、肺功能指标持续性降低和对糖皮质激素治疗不敏感,因此预防及减轻气道重塑是哮喘研究的热点及难点。
TGF-β家族包括TGF-β的3个亚型(TGF-β1、TGF-β2和TGF-β3),其中TGF-β1是调节多种细胞生长、分化和细胞周围基质环境的多功能细胞因子,存在于气道上皮、黏膜下层和平滑肌层。近年的研究认为TGF-β1在气道重塑中起重要作用[5],是气道重塑中的重要细胞因子[6,7],可促进其发生及发展[8,9],从而参与哮喘的发病机制,且TGF-β1基因多态性与儿童及成人哮喘严重性相关[10]。
目前糖皮质激素被应用于哮喘气道重塑的相关研究,但其周身应用时存在着不可忽视的不良反应[11]。VIP作为抑制性非肾上腺素能非胆碱能神经递质,目前研究认为具有减轻气道炎症及舒张气管功能,但对哮喘气道重塑的影响研究较少。本实验中B组小鼠致敏后雾化激发时出现烦躁不安、抓耳挠腮、呼吸加快、前肢缩抬、弓背等哮喘发作表现,肺组织石蜡切片病理改变及图像分析证实哮喘气道重塑模型构建成功;C组给予VIP治疗后,上述改变较B组减轻,提示VIP具有抑制哮喘气道重塑作用。本实验还通过实时PCR及Western blot方法检测各组小鼠肺组织TGF-β1mRNA及蛋白表达,得出C组较B组表达水平显著降低(P<0.05),证实VIP可使哮喘小鼠肺组织TGF-β1mRNA及蛋白表达减少。因此,VIP可减轻哮喘小鼠气道重塑,其机制可能是通过降低TGF-β1mRNA及蛋白表达实现,为VIP用于哮喘气道重塑的治疗提供实验依据。
[1]Temelkovski J,Hogan SP,Shepherd DP,et al.An improved murine model of asthma:selective airway inflammation,epithelial lesions and increased methacholine responsiveness following chronic exposure to aerosolised allergen[J].Thorax,1998,53(10):849-856.
[2]Miller M,Cho JY,McElwain K,et al.Corticosteroids prevent myofibroblast accumulation and airway remodeling in mice[J].Am J Physiol Lung Cell Mol Physiol,2006,290(1):L162-L169.
[3]章晓初,姚婉贞,何其华,等.哮喘豚鼠气道重塑与气道高反应性的图像分析[J].中华结核和呼吸杂志,2001,24(2):87-89.
[4]Royce SG,Lim C,Muljadi RC,et al.Trefoil factor 2 regulates airway remodeling in animal models of asthma[J].J Asthma,2011,48(7):653-659.
[5]Xie S,Sukkar MB,Issa R,et al.Mechanisms of induction of airway smooth muscle hyperplasia by transforming growth factor-beta[J]. Am J Physiol Lung Cell Mol Physiol,2007,293(1):L245-L253.
[6]Halwani R,Al-Muhsen S,Al-Jahdali H,et al.Role of transforming growth factor-β in airway remodeling in asthma[J].Am J Respir Cell Mol Biol,2011,44(2):127-133.
[7]Ghanei M,Ghalejooghi NA,Nourani MR,et al.Effect of TGFβ1 and TIMP2 on disease activity in asthma and COPD[J].Iran J Allergy Asthma Immunol,2010,9(2):79-86.
[8]Brown SD,Baxter KM,Stephenson ST,et al.Airway TGF-β1and oxidant stress in children with severe asthma:association with airflow limitation[J].J Allergy Clin Immunol,2012,129(2):388-396.
[9]Yadav UC,Naura AS,Aguilera-Aguirre L,et al.Aldose reductase inhibition prevents allergic airway remodeling through PI3K/AKT/ GSK3β pathway in mice[J].PLoS One,2013,8(2):e57442.
[10]de Faria IC,de Faria EJ,Toro AA,et al.Association of TGF-beta1,CD14,IL-4,IL-4R and ADAM33 gene polymorphisms with asthma severity in children and adolescents[J].J Pediatr(Rio J),2008,84(3):203-210.
[11]de Diego Damiá A,Vega Chicote JM.Therapeutic approach to the distal airways in asthma[J].Arch Bronconeumol,2011,47(Suppl 2):27-31.
(编辑 陈姜)
Effects of Vasoactive IntestinalPeptide on Transforming Growth Factor-β1Expression in Lung Tissue of Asthmatic Mice with Airway Remodeling
WANGJuan,SHANGYun-xiao
(DepartmentofPediatrics,Shengjing Hospital,China MedicalUniversity,Shenyang 110004,China)
ObjectiveTo investigate the effects of vasoactive intestinal peptide on transforming growth factor-β1(TGF-β1)expression in lung tissue of asthmatic mice with airway remodeling.MethodsA total of 30 SPF grade female Balb/c mice were randomly divided into three groups:control(group A),asthmatic(group B),and vasoactive intestinal peptide treatment(group C).Aerosolized ovalbumin was used to establish the asthmatic mice model.Pathological changes of bronchial and lung tissues were observed by HE,the perimeter of basement membrane(Pbm),internal wallarea(WAi)and smooth muscle area(WAm)in bronchiallung tissue were analyzed using the pathologicalimage.The expression levels ofTGF-β1mRNA and protein in lung tissue were detected by real-time PCR and Western blot.ResultsPathologic changes including collagen deposition,infiltration of inflammatory cells and smooth muscle layer thickness were found in group B.In addition,the WAi/Pbm and WAm/Pbm were significantly higherin group Bthan those ofthe group A(P<0.05),and lowerin group C than in group B(P<0.05).The expression levelsofTGF-β1mRNA and protein in group B were higher than both group A(P<0.05)and group C(P<0.05).ConclusionVasoactive intestinal peptide may inhibit airway remodeling,which may be associated with reduced expression ofTGF-β1.
vasoactive intestinal peptide;bronchial asthma;airway remodeling;transforming growth factor-β1
R725.6
A
0258-4646(2014)05-0422-04
辽宁省教育厅高校科研计划(L2011128)
王娟(1983-),女,医师,硕士.
尚云晓,E-mail:shangyunx@sina.com
2014-03-12
网络出版时间:
