石灰石在转炉中与铁水相互作用研究
2014-03-20李晨晓张文军张倩倩
冯 佳,年 武,李晨晓,康 乐,张文军,张倩倩,李 宏
(北京科技大学 冶金与生态工程学院,北京 100083)
石灰石在转炉中与铁水相互作用研究
冯 佳,年 武,李晨晓,康 乐,张文军,张倩倩,李 宏
(北京科技大学 冶金与生态工程学院,北京 100083)
根据热力学基础理论研究了CO2-CO气体与Fe-C-Si-Mn体系之间反应以及铁水中[C]对CaCO3分解温度的影响.结果表明,在气氛组成变化很宽的范围内,CO2与[C]、[Si]、[Mn]、Fe(l)反应的ΔG小于零,石灰石分解产生的部分CO2可以替代氧气参与熔池的氧化.气氛组成影响CO2对铁水中元素的氧化顺序.CO2浓度高CO浓度低时,CO2优先氧化[C];CO2浓度低CO浓度高时,CO2优先氧化[Si].在w[C]= 2%~4.5%的范围内,石灰石分解温度T与w[C]%的关系为T=2.40w[C]2%-35.91w[C]%+1129.1.将石灰石煅烧过程从传统石灰窑中转移到转炉可显著降低石灰石分解温度.CaCO3的分解反应和CO2对熔池的氧化反应互相促进,有利于石灰石的分解和铁水中杂质元素的氧化去除.
转炉炼钢;石灰石;造渣;分解;二氧化碳
传统的“石灰煅烧→转炉炼钢”这一工业链上,存在着出窑石灰所携带的物理热的浪费、CO2和粉尘过度排放等环境问题.以全国年产钢8亿t、吨钢消耗石灰50 kg计算,共消耗石灰4 000万t.石灰在窑内煅烧到1 100℃左右,携带的物理热达3.97×1013kJ,折合135.6万t标准煤,这些能量大多白白浪费.为改善这种状况,北京科技大学提出了用石灰石代替石灰造渣炼钢的方法[1].该方法自提出以来,其降低成本和节能环保等方面的效应受到了广泛的关注,鞍钢、武钢、包钢、湘钢、本钢和石钢等企业纷纷采用该工艺,证明了其可行性及其带来巨大的经济效益[2~6].
把石灰石的煅烧地点从石灰窑转移到转炉中,将对转炉吹炼和石灰石的分解都产生影响.石灰石分解生成大量的 CO2,以吨钢消耗CaO 50 kg,将生成约40 kg CO2.如果一部分CO2可以参与熔池的氧化反应,将强化转炉前期供氧,减排CO2气体,并降低氧气消耗量.因此,石灰石在铁水表面的分解产生的CO2与铁水中元素反应的研究具有重要意义.
转炉直接用石灰石造渣工艺中,石灰石入炉后位于渣铁界面,与高碳铁水相接触.而在传统的石灰窑生产过程中,与石灰石接触的介质为CO2浓度较高的气相.接触介质的不同会对石灰石的分解反应产生怎样的影响,石灰石与铁水之间有怎样的相互作用,本文将对此进行探讨.
1 研究方法
本文根据转炉实际吹炼过程中铁水成分和温度变化的大致规律,选取特定的成分和温度范围,在此条件下根据已有的热力学数据计算CO2与铁水中的[C]、[Si]、[Mn]、Fe(l)等元素反应的ΔG,来判断石灰石分解产生的CO2能否与铁水中组元反应.根据ΔG和与其相关的各参数之间的关系,在实际的可能范围内适当选取各参数的值,以计算ΔG的上限值.若ΔG的上限值仍小于零,则从热力学上证明了CO2可以与该元素反应.
以铁水中的[C]为例,研究CO2与铁水中元素反应对CaCO3分解温度的影响.考虑CaCO3分解反应与CO2-[C]反应之间的耦合关系,从热力学上推导出CaCO3分解温度与铁水中[C]含量的关系,并采用回归分析的方法将其简化.结合文献中的实验现象和数据,对理论计算结果加以验证.
2 结果与讨论
2.1 CO2与铁水中元素反应的可能性
石灰石加入转炉后会在铁水表面分解并生成大量CO2.CO2是一种弱氧化性气体.由已发表的数据可以计算出CO2与铁水中各元素反应生成简单氧化物的标准吉布斯自由能变化与温度的关系,如式(1)~(4)所示.
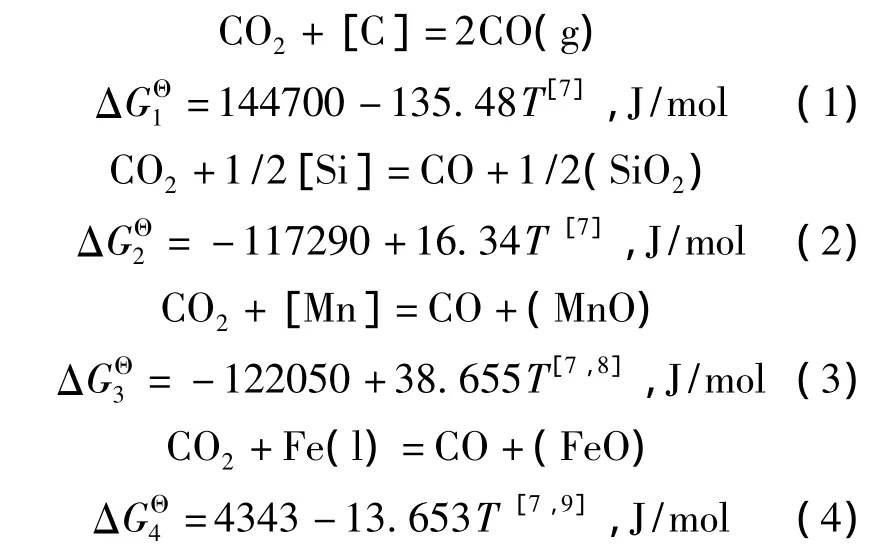
由等温方程式得到反应(1)~(4)的吉布斯自能变化分别如式(5)~(8)所示.
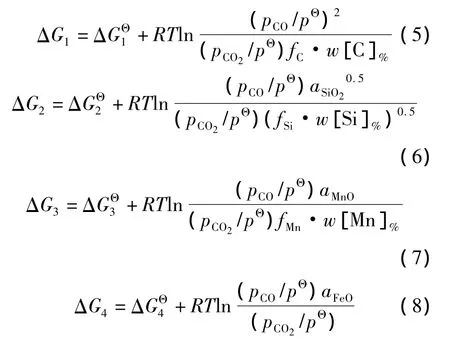
为了证明转炉炼钢前期上述各反应可以往右边进行,只须证明该条件下各反应的ΔG上限小于零.为此,将生成物的活度在实际可能的范围内取上限,而将反应物的活度取下限.由于氧化产物SiO2、MnO、FeO可能进入渣中形成复杂氧化物,它们的活度值aSiO2、aMnO、aFeO实际小于或等于1,现取其上限aSiO2=aMnO=aFeO=1,代表简单氧化物刚生成的一瞬间、尚未与其他物质结合生成复杂氧化物的情况.石灰石分解刚产生的CO2气泡不含CO,在总压为ρΘ的条件下pCO=0,pCO2=pΘ,要得到各反应ΔG的上限,计算时应该在pCO>0、pCO2<pΘ的范围内取值.为了体现CO2可能发生的反应使气泡中pCO逐渐升高、pCO2逐渐降低的过程,将气氛组成取 3个水平:pCO=0.1pΘ、pCO2=0.9pΘ和 pCO=0.5pΘ、pCO2=0.5pΘ以及pCO=0.9pΘ,pCO2=0.1pΘ.
常见转炉入炉铁水w[C]约为4.2%,w[Si]约为0.5%,w[Mn]约为0.5%.转炉铁水入炉温度约为1300℃,如果加入10%的废钢,可使铁水温度降低150℃左右[10],再考虑石灰石部分替代石灰进入转炉吸热,可能使铁水温度降低至1 100℃左右.当吹炼到5 min左右,石灰石基本化渣,w[C]略高于3%,[Si]几乎全部被氧化,[Mn]也大部分被氧化,此时温度约为1 400℃.因此铁水成分取两个水平:w[C]%=4.2,w[Si]%=0.5,w[Mn]%=0.5以及 w[C]%= 3%,w[Si]%=0.001,w[Mn]%=0.05.温度取1 100~1 400℃,即1 373~1 673 K.
铁水中[C]、[Si]、[Mn]的活度系数根据Wagner模型计算,如式(9)~(11)所示.
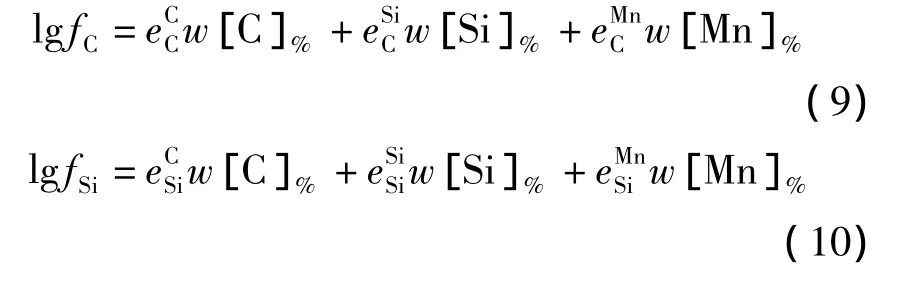
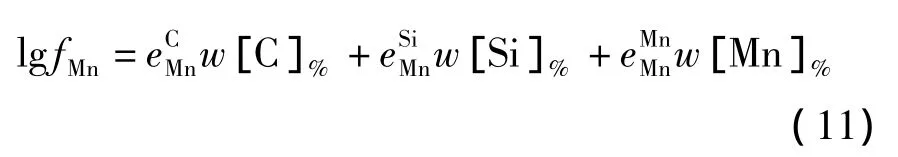
表1中给出的是1 873 K下铁液中各元素之间的相互作用系数[8].由于高碳范围内热力学数据的缺乏,[C]对其他组分的相互作用系数沿用低碳领域的研究结果.相互作用系数缺乏低温范围内的数据,近似采用正规溶液的规律[11],如式(12)所示.
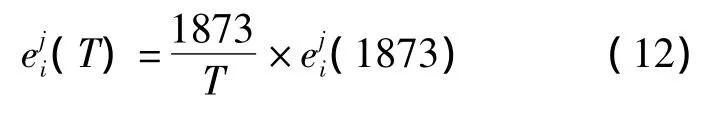
表1 溶于铁水中各元素在1 873 K下的相互作用系数Table 1 Interaction coefficient in hot metal at 1 873 K
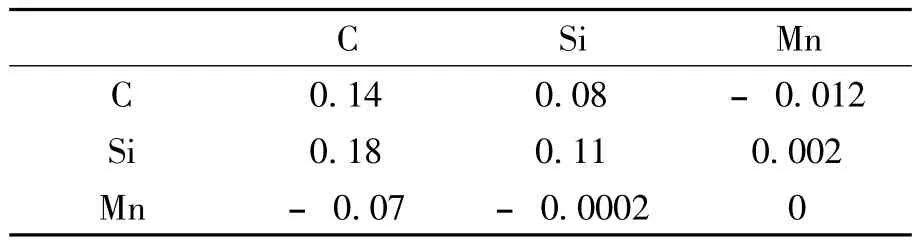
表1 溶于铁水中各元素在1 873 K下的相互作用系数Table 1 Interaction coefficient in hot metal at 1 873 K
0.012 Si 0.18 0.11 0.002 Mn –0.07 –Si Mn C 0.14 0.08 –C 0.0002 0
根据式(12)和表1中的数据,得到不同温度下铁水中各元素的相互作用系数,再由式(9)~ (11)式求出[C]、[Si]、[Mn]在不同温度和成分条件下的活度系数.将温度、CO和CO2的分压、[C]、[Si]、[Mn]的质量分数(%)和活度系数以及SiO2、MnO、FeO的活度代入式(5)~(8)式,可求出上述条件下CO2与铁水中[C]、[Si]、[Mn]、Fe(l)反应的ΔG,计算时选取的条件和计算结果分别如表2和图1所示.
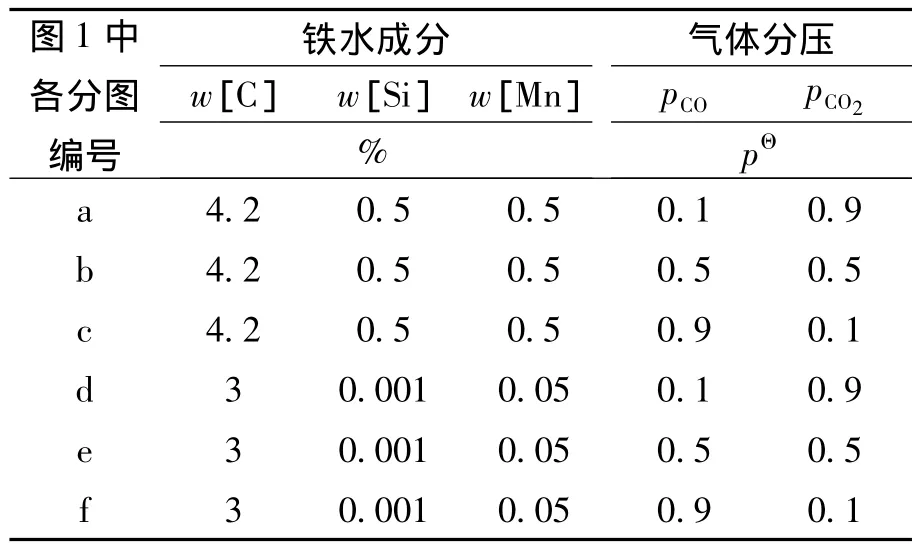
表2 各反应热力学计算所选取的条件Table 2 Conditions of the thermodynamic analysis for the reactions

图1 不同条件下(参见表2)CO2与铁水中元素反应的ΔG计算结果Fig.1 ΔG values of reactions between CO2and elements in hot metal
由图1(a)、(b)、(d)、(e)知在pCO=0.1pΘ、pCO2=0.9pΘ以及 pCO=0.5pΘ、pCO2=0.5pΘ两种气氛条件下,对于这两种不同成分的铁水,CO2与[C]、[Si]、[Mn]、Fe(l)反应的ΔG全部均小于零.在图1(c)、(f)中,pCO=0.9pΘ、pCO2=0.1pΘ的气氛条件下,CO2与这两种成分铁水中[C]和[Si]反应的ΔG仍小于零;对于w[Mn]%=0.5的铁水(图1(c)),CO2与[Mn]反应的ΔG也小于零,但对于w[Mn]%=0.05的铁水(图1(f)),CO2与[Mn]反应的ΔG已上升到大于零;在该气氛下,无论对于哪一种成分的铁水,CO2与Fe(l)反应的ΔG都大于零.
因此CO2在铁水中的反应过程可以这样描述:石灰石分解产生的气泡在其生成的一瞬间为纯CO2,它可以与铁水中的[C]、[Si]、[Mn]、Fe(l)反应生成CO.随着反应的进行,气泡中CO2逐渐消耗,CO浓度升高,到两种气体的浓度各占50%时CO2对各元素的氧化反应仍然可以继续.当CO体积分数上升到90%、CO2体积分数降低到10%,绝大部分CO2已经被利用,气氛的氧化能力已明显减弱,CO2对[Mn]的氧化反应只能在w[Mn]较高的条件下进行,而对Fe的氧化反应已经完全不能进行.但此时即使[C]和[Si]的质量分数已分别降低至3%和0.001%,CO2对[C]和[Si]的氧化在热力学上仍然具有非常大的驱动力.
转炉前期石灰石分解出的CO2在铁水表面与[C]、[Si]、[Mn]、Fe(l)反应,相当于在对熔池扰动很小的条件下强化供氧,将起到一种软吹的效果.根据转炉用石灰石造渣工业试验研究的文献记载,用石灰石造渣的炉次开吹后2 min的渣样中,(TFe)浓度明显高于用石灰造渣的炉次,吹炼3 min左右有泡沫渣从炉口溢出[5],这与CO2对Fe(l)的氧化作用有关.工业试验数据的多元回归分析发现,耗氧量随石灰石加入量的增加而减少,这是因为CO2取代了部分氧气,且随着石灰石替代石灰比例的增加,转炉煤气中CO的浓度逐渐升高[6].工业试验数据也验证了本文的计算结果.
2.2 气氛对CO2氧化铁水中元素优先顺序的影响
比较图1(a)、(b)、(c)可以发现,对于刚入炉的铁水,CO2对[C]和[Si]的热力学优先氧化顺序与气氛组成有关.当CO浓度较低而CO2浓度较高时,在所讨论的温度范围内CO2都优先氧化[C],如图1(a)所示.当气泡内该反应的进行使得CO浓度升高、CO2浓度降低到一定程度时,出现一个氧化顺序的临界温度,如图1(b)所示.低于该温度时[Si]优先氧化,高于该温度时[C]优先氧化.当CO浓度继续升高、CO2浓度继续降低,临界温度会逐渐升高,[Si]的优先氧化温度范围扩大,如图1(c)所示.
分析该现象的原因,CO2与[C]反应的自由能变化ΔG1受pCO二次方影响,如式(5)所示.CO2与[Si]反应的自由能变化ΔG2受pCO一次方影响,如式(6)所示.当pCO升高同样的幅度,ΔG1的升高幅度远大于ΔG2的升高幅度,这使它们的优先氧化顺序发生改变.图1(d)、(e)、(f)未出现[C]、[Si]优先氧化顺序的转变,因为此时w[C]比w[Si]高出太多,但氧化顺序已经出现了转变的趋势.随着CO浓度继续升高,在讨论的温度范围内也可能出现氧化顺序转变的临界温度.
因此,石灰石分解产生的CO2气泡在与铁水反应的前阶段CO2浓度高而CO浓度低,此时优先氧化[C];在后阶段CO2浓度低而CO浓度高,优先氧化[Si].但由于偏离平衡态,实际过程并不会严格遵守这种热力学上的氧化顺序,而更可能多个氧化反应同时发生.
2.3 铁水碳含量对CaCO3分解反应的影响
石灰石在高温下分解为CaO和CO2,如式(13)所示.

石灰石分解产生的CO2可与铁水中的[C]、[Si]、[Mn]、Fe(l)反应.以CO2与Fe-C-O三元系中[C]的反应为例,将(1)与(13)叠加,得:
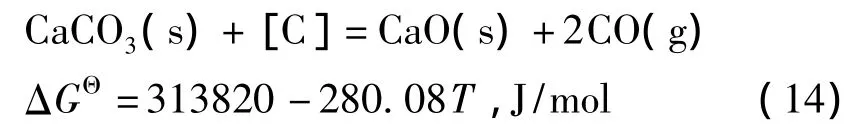
在水泥熟料煅烧中人们发现,CaCO3在高温下可以直接与煤粉反应生成CaO和CO,常称为“郝氏反应”[12],但CaCO3直接与铁液中溶解态[C]的反应尚未研究.由等温方程式△GΘ=-RTlnK得到反应(14)的平衡常数:

CaO和CaCO3均为固体,因此aCaO=aCaCO3=1.文献表明[13],Fe-C-O熔体中和(CO+CO2)气体反应平衡时,只有当w[C]低于1%,气相中的CO2体积分数才可能达到1%以上.随着铁水中碳含量的升高,气相中CO2的浓度继续降低,而CO浓度则会升高.进一步的研究[14]表明,与炼钢前期高碳低温铁水平衡的气相中CO2的分压低于0.005pΘ,因此可认为pCO/pΘ≈1,将式(15)简化为:

其中的fC,%为以质量分数1%为标准态时碳的活度系数.高碳区域中碳的热力学行为不遵守亨利定律,不能简单地采用低碳区域里令fC,%为1的做法.为了避免低碳领域有关碳的相互作用系数用于高碳领域以及式(12)正规溶液模型与实际铁液之间的误差,这里暂不采用相互作用系数的方法计算fC,%.考虑到Fe-C-O三元系中高碳区域内氧含量很低,氧对碳的活度系数影响可以忽略,因此可以套用Fe-C二元系中碳的活度系数.文献[15]中记载了Chipman关于以假想纯物质为标准态时Fe-C二元系中碳的活度系数fC,X的研究结果:

其中铁的摩尔分数xFe=1-xC,碳的摩尔分数xC=1.27w[C]%/(w[C]%+27.37).根据假想纯物质为标准态时的活度系数fC,X与以质量分数1%为标准态时的活度系数fC,%之间的关系进行换算[16]:

其中,AFe和AC分别为铁和碳的相对原子质量.把碳和铁的相对原子质量代入式(18)化简并转换形式,可以得到式(19):

两边取对数整理可得式(20):

将式(17)代入式(20)中整理后可以得到fC,%与温度和碳质量分数的关系式:
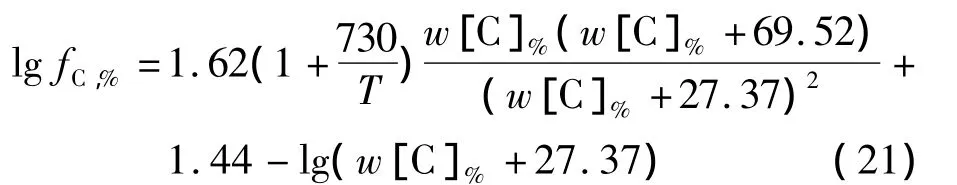
将式(21)代入式(16)并变形、简化得到CaCO3分解温度T与w[C]%之间关系的表达式:

在式(22)中给w[C]%赋不同的值,得到CaCO3的分解温度随铁水碳含量(质量分数)变化的曲线,如图2所示.

图2 CaCO3的分解温度随铁水碳含量变化的关系Fig.2 Relationship between CaCO3decomposition temperature and[C]content
由图2可见,随着铁水碳含量的升高,CaCO3的分解温度逐渐降低.吹炼初期 w[C]约为4.2%,此时对应的 CaCO3的分解温度为1 020.6 K.随着吹炼的进行,约5 min时石灰石基本化渣,w[C]约为3.0%,此时对应的CaCO3分解温度升高到1 042.9 K.
2.4 CaCO3分解温度与铁水碳含量关系式再回归
由于式(22)比较复杂,使用起来很不方便,故采用回归分析的方法对其简化.在w[C]=2~4.5%的范围内,每隔0.01%取一个数据点,一共得到251组数据进行二次多项式拟合,结果如式(23)所示.

相关系数R2十分接近于1,表明回归结果可靠,式(23)相当精确地表达了高碳区域CaCO3的分解温度与铁水碳含量之间的关系.
2.5 石灰石在不同条件下分解的热力学条件对比
由式(13)可得到CaCO3的分解温度与气氛中CO2分压的关系如式(24)所示:

标准状态下,pCO2/pΘ=1由式(24)可求出此时CaCO3的分解温度为1 169.6 K.这比CaCO3在转炉前期高碳铁水中的分解温度1 020.6~1 042.9 K高出了126.7~149.0 K.
在石灰窑中,石灰石的分解及燃料的燃烧都将产生大量CO2,石灰窑炉气中CO2的体积分数一般为30% ~40%,即pCO2/pΘ=0.3~0.4,用式(24)计算石灰窑内 CaCO3开始分解温度为1 093.9~1 111.0 K,低于标准状态下的分解温度,但仍显著高于转炉中的分解温度(1 020.6~1 042.9 K).
由此可见,铁水中[C]的存在可以降低CaCO3的分解温度.将石灰石的煅烧由石灰窑中转移到转炉中,石灰石的开始分解温度会显著降低.转炉前期高碳铁水的条件对石灰石的分解十分有利.
3 结论
(1)本研究从另一角度确认,转炉炼钢前期石灰石分解出的CO2可以参与铁水中[C]、[Si]、[Mn]、Fe(l)的氧化反应,部分CO2可以替代氧气参与熔池的氧化反应.
(2)气氛影响CO2对铁水中元素的氧化顺序.在CO2浓度高CO浓度低时,CO2优先氧化[C];在CO2浓度低CO浓度高,CO2优先氧化[Si].
(3)铁水中[C]可降低石灰石的分解温度,二者关系为T分解=2.40w[C]2%-35.91w[C]%+ 1129.1.石灰石在转炉铁水表面分解温度比在石灰窑中显著降低.
(4)CaCO3的分解反应和 CO2与铁水中[C]、[Si]、[Mn]、Fe(l)的氧化反应互相促进,有利于石灰石的分解和转炉铁水中杂质元素的氧化去除.
[1]李宏,曲英.一种在氧气顶吹转炉中用石灰石代替石灰造渣炼钢的方法:中国,ZL 200910082071.X[P].2011-01-19.
(Li H,Qu Y.A technique on limestone instead of lime for slagging in BOF steelmaking process: China, ZL 200910082071.X[P].2011-01-19.)
[2]刘宇,王文科,王鹏,等.转炉采用石灰石部分替代石灰的冶炼实践[J].鞍钢技术,2011(5):41-44.
(Liu Yu,Wang Wenke,Wang Peng,et al.Steel-making operations by substituting limestone for some limes in converter[J].Angang Technology,2011(5):41-44.)
[3]朱志鹏,沈钱,钱高伟.转炉使用石灰石代替石灰炼钢对转炉煤气回收的影响[C]//第十七届全国炼钢学术会议论文集.杭州:2013:1475-1479.
(Zhu Zhipeng,Shen Qian,Qian Gaowei.Effect on coal gas recovery of converter by using limestone instead of lime[C]// Proceedings of the 17th CSM Annual Steelmaking Conference.Hangzhou:2013:1475-1479.)
[4]田志国,汤伟,潘锡泉.转炉采用石灰石替代部分石灰冶炼的应用分析[J].中国冶金,2012,22(7):47-51.
(Tian Zhiguo,Tang Wei,Pan Xiquan.Application analysis of substituting limestone for some limes in BOF[J].China Metallurgy,2012,22(7):47-51.)
[5]Hong Li,Luofang Guo,Yongqing Li,et al.Industrial experiments of using limestone instead of lime for slagging during LD -steelmaking process[J].Advanced Materials Research,2010,233-235:2644-2647.
[6]Li H,Guo L F,Li Z Q.Research of low-carbon mode and on limestone addition instead of lime in the BOF steelmaking[J].Journal of Iron and Steel Research International,2010,17(2):23-28.
[7]萬谷志郎著,李宏译.钢铁冶炼[M].北京:冶金工业出版社,2001.
(Banya Shiro, LI Hong translation. Ironmaking and Steelmaking.Beijing:Metallurgical Industry Press,2001.)
[8]日本鉄鋼協會編,鉄鋼便覽(第3版).Ⅰ基礎,丸善株式會社,1981:14.
(Iron and Steel Institute Japan edition.Steel least(ed.3).Ⅰbasis,Pill good corporation,1981:14.)
[9]赫桑·巴伦主编.程乃良,牛四通,徐桂英,等译.纯物质热化学数据手册.北京:科学出版社,2003:313.
(Iraq,Ed.Barron mulberry Hector.Cheng N L,Niu S T,Xu G Y,et translation.Pure material thermal and chemical data handbook.Beijing:Science press,2003:313.)
[10]崔国亮.鞍钢100吨转炉的冶炼操作[D].鞍山:辽宁科技大学,2011.
(Cui Guoliang.The practice of steel-making of 100t converter in Ansteel[D].Anshan:University of Science and Technology Liaoning,2011.)
[11]黄希祜.钢铁冶金原理(第4版)[M].北京:冶金工业出版社,2013:183.
(Huang Xihu.Principle of Ferrous Metallurgy(ed.4)[M].Beijing:Metallurgical Industry Press,2013:183.)
[12]刘孝定.等球径煅烧技术对立窑熟料烧成的影响探讨[J].水泥,2006(6):40-43.
(Liu Xiaoding.Effect on operation of shaft kiln fed with same diameter of pellets[J].Cement,2006(6):40-43.)
[13]王新华.钢铁冶金——炼钢学[M].北京:高等教育出版社,2007:14.
(Wang Xinhua.Ferrous Metallurgy—Steelmaking study[M].Beijing:High Education Press,2007:14.)
[14]李宏,冯佳,李永卿,等.转炉炼钢前期石灰石分解及CO2热力学氧化作用的分析[J].北京科技大学学报.2011,33
(S1):83-87.(Li Hong,Feng Jia,Li Yongqing,et al.The thermodynamic analysis of limestone decomposition and oxidation effect by CO2in the early stage of BOF steelmaking[J].2011,33 (S1):83-87.)
[15]Elliott,John F.Thermochemistry for Steelmaking Vol.II: thermodynamic and transport properties[M].MA:Addison-Wesley Inc,1963:496.
[16]郭汉杰.冶金物理化学教程(第二版)[M].北京:冶金工业出版社,2006:38.
(Guo.Metallurgical physical chemistry tutorial(ed.2).Beijing:Metallurgical Industry Press,2006:38.)
Interaction between limestone and hot metal in the early stage of BOF steelmaking
Feng Jia,Nian Wu,Li Chenxiao,Kang Le,Zhang Wenjun,Zhang Qianqian,Li Hong
(School of Metallurgical and Ecological Engineering,University of Science and Technology Beijing,Beijing 100083,China)
Reactions between CO2-CO gas and Fe-C-Si– Mn melt as well as influence of[C]on decomposition temperature of limestone were studied by thermodynamic analysis.The results showed that ΔG of reactions among CO2and[C],[Si],[Mn],Fe(l)are less than zero when gas composition varies in a wide range,indicating part of CO2from limestone is able to replace oxygen for bath oxidation.The oxidation order of elements in hot metal by CO2varies with gas composition.[Si]oxidation is prior when CO2concentration is low while[C]oxidation is prior when CO2concentration is high.Relation between limestone decomposition temperature and w[C]%can be represented as T=2.40 w[C]2%-35.91w[C]%+1129.1 when w[C]=2% ~4.5%.If the decomposition process of limestone is transferred from the limekiln to BOF,the decomposition temperature of limestone will drop notably.Interaction between CaCO3decomposition and bath oxidation by CO2promotes each other and is beneficial to both decomposition of CaCO3and removal of impurities from the bath.
BOF steelmaking;limestone;slag;decomposition;carbon dioxide
TF 721
A
1671-6620(2014)02-0119-06
2013-08-15.
国家科技支撑计划项目 (2012BAC27B02).
冯佳 (1986—),男,北京科技大学,博士研究生,E-mail:fj8@163.com.
