菲律宾蛤仔(Ruditapes philippinarum)金属硫蛋白基因克隆及Cd2+胁迫下的表达分析
2014-03-19林晓玲袁泽轶吴惠丰赵建民
林晓玲 王 清 袁泽轶 于 倩 吴惠丰① 丛 明 李 斐 赵建民①
(1. 中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室 烟台 264003;2. 国家海洋信息中心 天津 300171; 3. 中国科学院大学 北京 100049)
金属硫蛋白(Metallothionein, MT)是一类富含半胱氨酸(Cys)的低分子量蛋白质, 常含有Cys-Cys、Cys-Xn-Cys等结构, 其Cys残基中的巯基(SH)能够螯合金属离子, 通过降低其它功能蛋白关键靶位的金属浓度, 减轻金属的毒性作用(Amiard-Triquetet al,1998; Silvestreet al, 2005)。研究发现, MT可被重金属、氧化损伤和免疫刺激等多种环境因素诱导产生;且受到重金属暴露时, 机体内重金属含量与MT表达水平之间存在着显著相关性(Bebiannoet al, 1998;Moragaet al, 2002; Conget al, 2012)。早在1979年,Ridlington等(1979)在美洲牡蛎Crassostrea virginica中报道了软体动物的首个MT序列, 此后陆续在贻贝Mytilus edulis(Lemoineet al, 2003)、巨牡蛎Crassostrea rhizophorae(Rebeloet al, 2003)、海湾扇贝Argopecten irradians(Wanget al, 2009)和文蛤Meretrix meretrix(Wanget al, 2010)等多种软体动物体中发现了MT的存在。目前, MT已被联合国环境规划署遴选为海洋环境监测的生物标志物之一(UNEP/RAMOGE)。
镉(Cd)是一种有毒的非必需金属元素, 具有易富集、难降解、半衰期长等特点。近年来, 随着工矿企业排污量的增加, Cd已成为海洋环境重金属污染的主要种类之一。例如, 渤海湾的大沽口、秦口河河口沉积物中Cd浓度达到1.01—1.82mg/kg, 造成了较高的生态风险(Menget al, 2008)。研究表明, Cd不但能够影响海洋生物的摄食、生长发育和繁殖等生理活动(曾艳艺等, 2010; 廖永岩等, 2007; Ringwoodet al,2004), 还可通过食物链的富集作用对人类健康构成潜在威胁(Galayet al, 2001; Seebaughet al, 2005)。
双壳贝类分布广泛, 滤食的特性使其对环境污染物具有较强的富集能力, 常被用来指示海区的水质状况(Blascoet al, 1999; Jiet al, 2006; Parket al,2008)。菲律宾蛤仔Ruditapes philippinarum是一种广泛分布于我国沿海区域的经济贝类, 已被列为我国“贻贝监测计划”的目标监测生物。在前期研究中, 我们发现不同壳色菲律宾蛤仔(白蛤、斑马蛤、两道红)对Hg等重金属暴露的代谢响应途径存在显著差异(Liuet al, 2011a, b)。本研究以菲律宾蛤仔为实验对象,克隆获得了MT基因的全长cDNA序列, 并比较了Cd2+暴露对白蛤和斑马蛤两种壳色菲律宾蛤仔MT基因表达模式的影响, 研究结果可为探讨菲律宾蛤仔MT的解毒作用及其重金属污染指示功能提供参考资料。
1 材料与方法
1.1 实验动物及镉暴露实验设置
实验所用菲律宾蛤仔购自当地水产市场, 选取壳长2.0—2.5cm的个体进行暴露实验。正式实验前,分别选择白蛤和斑马蛤各60只, 在40L充气过滤海水中(20±2)°C驯养5d。正式实验和驯养期间, 每24h换水一次, 定时投喂小球藻和三角褐指藻, 滤食3h后换水。暴露实验包括急性暴露和亚慢性暴露两部分,每个实验均设有暴露组和对照组, 各处理组均设置3个重复。根据前期实验结果, 采用Cd2+暴露48h半致死浓度(白蛤11.854mg/L, 斑马蛤10.597mg/L)的2%,即200µg/L Cd2+(CdCl2)作为48h急性暴露浓度。亚慢性暴露浓度的最高值通常设置为96h半致死浓度的5%—20%, 因此, 本研究采用80µg/L Cd2+暴露实验动物30d (96h半致死浓度分别为白蛤1.362mg/L, 斑马蛤0.633mg/L)。暴露结束后, 分别采集白蛤和斑马蛤各6只, 解剖并采集消化腺和鳃组织, 置于-80°C超低温冰箱中备用。
1.2 总RNA提取及cDNA制备
总RNA提取采用Trizol试剂(美国Invitrogen公司), 并按说明书操作。cDNA反转录按照M-MLV(美国Promega公司)操作手册操作。制备获得的cDNA置于-80°C超低温冰箱中备用。
1.3 基因克隆
根据实验室已有金属硫蛋白EST序列, 设计基因特异性引物P1(5′-GCTCCGATTGCAGGTGTC-3′),与接头引物oligo dT进行3′末端扩增。PCR反应条件如下: 94°C预变性5min, 然后进入35个循环: 94°C变性30s, 59°C退火30s, 72°C延伸60s; 最后72°C延伸10min。PCR产物经琼脂糖凝胶电泳检测后, 采用凝胶回收试剂盒纯化, 与pMD18-T载体连接, 转化感受态细胞Escherichia coliTop10F′; 经蓝白斑筛选和PCR检测, 挑选5个阳性克隆送北京诺赛基因公司进行测序, 所得结果与原始EST序列拼接后获得全长序列。
1.4 生物信息学分析
采用BLAST在线程序进行RpMT序列的同源性比对和相似性分析; 氨基酸序列的特征结构分析采用Expasy网站在线软件分析; 信号肽分析采用SignalP 4.1 Server在线分析; 多重比对采用ClustalX软件。
1.5 基因表达分析
采用美国应用生物系统公司7500Fast实时荧光定量PCR仪, 检测Cd2+暴露前后白蛤、斑马蛤消化腺和鳃组织中金属硫蛋白基因RpMT表达量的变化。针对RpMT的cDNA序列, 设计基因特异性引物MF(5′-GAAAGGTTGTACTCGGGAAGG-3′)和MR(5′-GGCGAATCTAGGCAAGTGG-3′); 同时, 选取β-actin作为内参基因用于模板的校正, 设计引物信息如下:F1(5′-GTCCTGTCACTTTACGCTTCCG-3′)和R1(5′-AACAAGAAATGGAGACGGCTGC-3′)。反应条件为:95°C 预变性10min, 然后进入40个循环: 95°C 变性5s, 55°C 退火15s, 72°C 延伸30s。每次PCR反应结束, 通过溶解曲线分析确定PCR产物扩增和检测的特异性。基因的相对表达水平用2−ΔΔCT法计算(Livaket al, 2001), 所得结果以“平均值±标准偏差”表示。对所得数据进行双因子及单因子方差分析(ANOVA),P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 序列分析
将扩增获得的PCR片段与已知EST序列拼接,获得了菲律宾蛤仔RpMT的全长cDNA序列。经验证发现, RpMT序列在白蛤和斑马蛤中不存在差异。将RpMT的全长cDNA序列提交GenBank注册(KF214789), 其核苷酸序列及推导的氨基酸序列如图1所示。RpMT的全长cDNA包括570bp, 3′端具有多聚腺苷酸加尾信号AATAAA和polyA尾巴; 开放阅读框(open reading frame, ORF)包括228bp, 编码75个氨基酸。RpMT推导的氨基酸序列中含有21个Cys残基, 占全部氨基酸总量的28%; 编码蛋白预测分子量为7.35kDa, 理论等电点为7.75。经SignalP 4.1软件预测, RpMT编码蛋白不存在信号肽, 为胞内蛋白。

图1 RpMT的cDNA全长及推导出的氨基酸序列Fig.1 The full-length cDNA and deduced amino acid of RpMT
2.2 同源性分析
经BLAST比对分析, RpMT编码蛋白与其它双壳贝类的MT蛋白具有较高的相似性。例如, 与硬壳蛤(Mercenaria mercenaria) MT蛋白的相似性为82%,与丽文蛤(Meretrix lusoria)和长牡蛎(Crassostrea gigas) MT蛋白的相似度为70%, 与其它双壳贝类也有较高的同源性。采用ClustalX软件, 将菲律宾蛤仔RpMT氨基酸序列与其他双壳贝类MT蛋白进行多序列比对。结果发现, 双壳贝类MT蛋白Cys残基的分布呈高度保守性, Cys与邻近氨基酸组成若干Cys-Xn-Cys结构, 具有典型的软体动物MT保守序列CKCXXXCXCX(图2)。

图2 菲律宾蛤仔RpMT与双壳贝类MT蛋白的多序列比对结果Fig.2 Multiple alignment of RpMT with metallothioneins from bivalves.
2.3 急性Cd2+暴露后RpMT基因的组织表达
以β-actin为内参基因, 利用实时荧光定量PCR方法检测了Cd2+(200µg/L)暴露48h后, 白蛤和斑马蛤消化腺和鳃组织中RpMT基因的表达情况。本实验样本存在壳色与Cd2+暴露双因子, 首先对RpMT基因表达量进行了双因子方差分析。结果表明: 消化腺组织RpMT基因表达量对急性Cd2+暴露存在显著响应, 但壳色间无显著差异, 且壳色与Cd2+暴露之间不存在相互作用; 而在鳃组织中, RpMT基因表达量对急性Cd2+暴露存在显著响应, 且不同壳色间存在显著差异,双因子的交互作用对RpMT基因的表达也具有显著影响(表1)。进一步的单因子方差分析结果显示, 急性Cd2+暴露导致两种壳色菲律宾蛤仔RpMT基因表达量在消化腺和鳃组织中均显著增加(P<0.05); 其中,鳃组织中RpMT的表达量变化幅度较消化腺组织更为明显。在白蛤中, 消化腺组织RpMT基因表达量在暴露后升高3.2倍, 而鳃组织中RpMT的表达量则为对照组的18.4倍; 对斑马蛤而言, Cd2+暴露导致消化腺组织RpMT表达量达到对照组的6.5倍, 鳃组织中RpMT的表达量较对照组升高18.0倍(图3)。
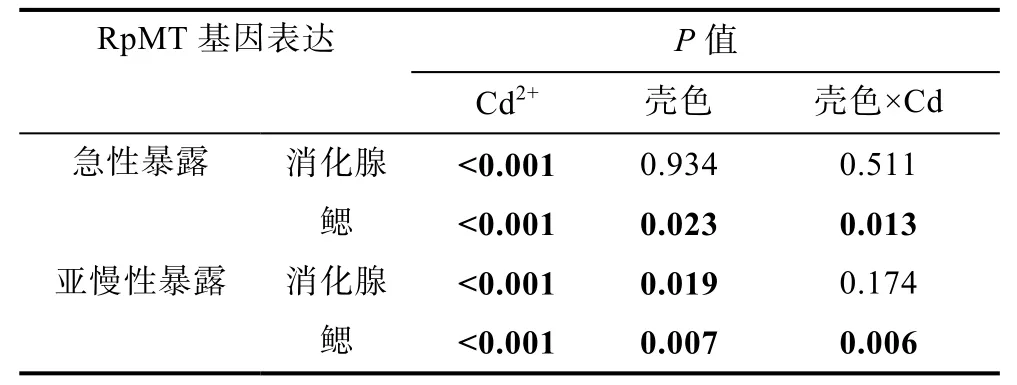
表1 消化腺和鳃组织RpMT基因表达量的双因子方差分析Tab.1 Two-way analysis of variance (ANOVA) on the expression of RpMT gene in digestive gland and gills under cadmium exposure
2.4 亚慢性Cd2+暴露后RpMT基因的组织表达
80µg/L Cd2+暴露30d后, 白蛤与斑马蛤消化腺和鳃组织中RpMT基因表达情况如图4所示。双因子方差分析结果表明: 在消化腺组织中, RpMT基因表达量对Cd2+暴露存在显著响应, 两种壳色蛤仔的RpMT基因表达也差异显著, 但壳色与Cd2+暴露双因子间不存在相互作用; 而在鳃组织中, RpMT基因的表达结果与急性Cd2+暴露的结果类似, 对Cd2+暴露存在显著响应, 不同壳色间存在显著差异, 且双因子的交互作用对RpMT基因的表达也具有显著影响(表1)。进一步单因子方差分析结果显示, 亚慢性Cd2+暴露可导致RpMT基因在两种壳色菲律宾蛤仔消化腺和鳃组织中的表达量显著增加(P<0.05); 其中, 鳃组织RpMT表达量的变化幅度较消化腺组织更为明显。在白蛤中, 消化腺组织RpMT基因的表达量较对照组升高3.8倍, 鳃组织中的表达量达到对照组的23.7倍;对斑马蛤而言, 消化腺组织RpMT基因的表达水平较对照组增加4.2倍, 鳃组织中的表达量为对照组的6.7倍(图4)。
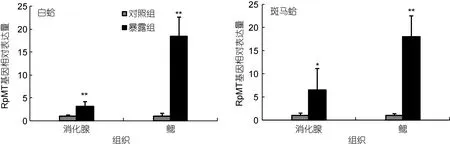
图3 200µg/L Cd2+暴露48h后RpMT基因在两种壳色菲律宾蛤仔中的组织表达Fig.3 The relative expression of RpMT mRNA in two pedigrees of Ruditapes philippinarum exposed to 200µg/L Cd2+ for 48h
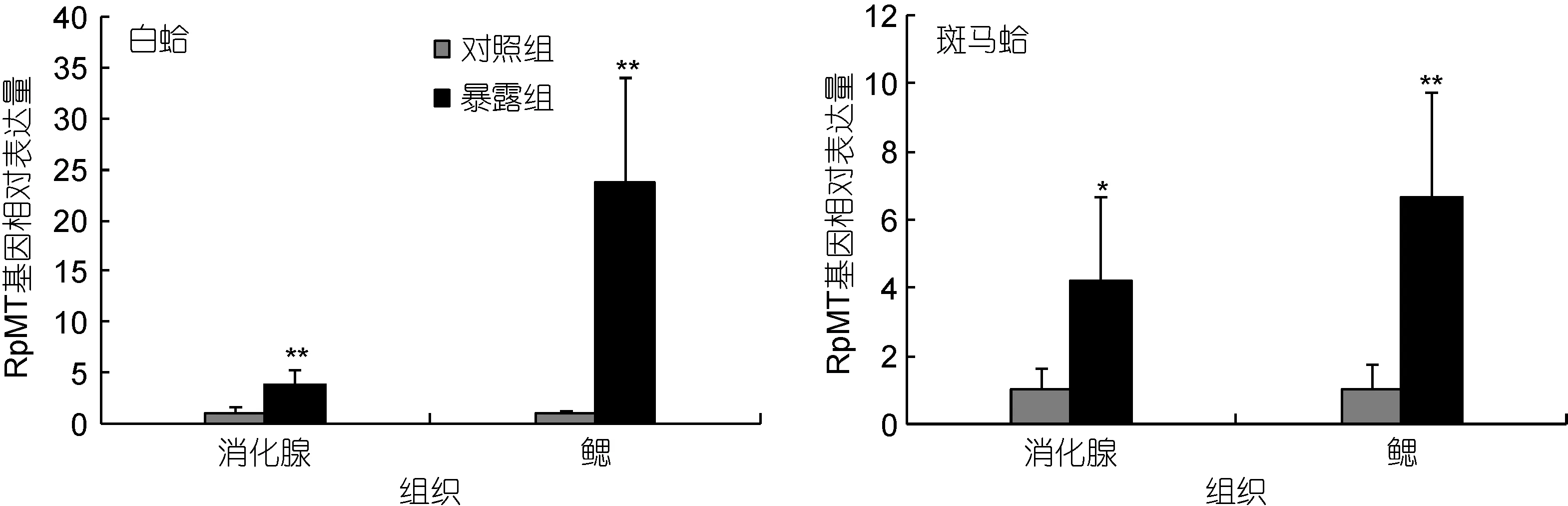
图4 80µg/L Cd2+暴露30d后RpMT基因的组织表达Fig.4 The relative expression of RpMT mRNA in two pedigrees of Ruditapes philippinarum treated with 80µg/L Cd2+ for 30 days.
3 讨论
MT是一类广泛存在于生物体内的金属结合蛋白,参与机体的重金属解毒、微量元素调节、自由基清除以及应激反应等生理过程(Vasaket al, 2000)。本研究通过RACE技术, 克隆获得了菲律宾蛤仔RpMT的全长cDNA序列; RpMT编码蛋白富含半胱氨酸, 且Cys残基分布高度保守。此外, RpMT编码蛋白含有15个MT特有的Cys-Xn-Cy结构, 并且具有软体动物MT蛋白的签名序列CKCXXXCXCX。与其它双壳贝类MT序列比较, RpMT具有软体动物MT的基本特征。
在生物体遭受重金属暴露后, MT被认为是最先参与重金属解毒和代谢的生物大分子(Amiard-Triquetet al, 1998)。已有研究发现, MT基因的表达量与生物体内重金属浓度具有明显的正相关性。例如, 随Cd2+暴露浓度增大, 长牡蛎Crassostrea gigas消化腺和鳃组织中MT转录本的表达量显著升高(Choiet al,2008)。然而, 有学者认为, MT基因的表达量与生物体内重金属浓度之间存在倒“U”型关系(Butleret al,2001; Wuet al, 2006), 即在一定暴露浓度范围内, MT基因的表达量随暴露浓度的增大而升高, 而当超过某一阈值时, 重金属就会对生物体的细胞功能造成损害, MT基因的表达水平则随重金属浓度的增大而降低。例如, 当Cd2+暴露剂量为100µg/kg鱼体重时,瘤棘鲆Scophthalmus maximus肝脏中MT基因的表达量显著升高, 但当暴露剂量大于200µg/kg鱼体重时,其表达量随浓度的增大而逐渐降低(Georgeet al,1996)。本研究根据前期实验获得的急性毒性数据, 分别选择200µg/L和80µg/L Cd2+作为急性和亚慢性暴露浓度。结果发现, 急性和亚慢性Cd2+暴露均可导致菲律宾蛤仔消化腺和鳃组织中RpMT基因表达量的显著升高, 表明RpMT在降低Cd2+对机体的毒性损害过程中发挥了重要作用。类似的实验结果在紫贻贝Mytilus galloprovincialis(Zoritaet al, 2007)、斑马纹贻贝Dreissena polymorpha(Fariaet al, 2009)、丽文蛤Meretrix lusoria(Changet al, 2007)和海湾扇贝A.irradians(Wanget al, 2009)等双壳贝类中亦有报道。
作为滤食性动物, 软体动物的鳃组织被认为在重金属的吸收和储存过程中发挥了重要作用(Smaoui-Damaket al, 2004)。在本研究中, Cd2+暴露导致两种壳色蛤仔鳃组织RpMT基因表达量的增加幅度均显著高于消化腺组织, 这可能与鳃组织对水相Cd2+暴露具有较强的富集能力有关(季向山等, 2006)。Bebianno等(1993, 1994)和Romeo等(1995)研究发现,十字蛤Ruditapes decussata经Cd2+暴露后, 鳃组织中MT含量也较其它组织增加更显著; 而紫贻贝M.galloprovincialis和贻贝M. edulis经Cd2+暴露后, 消化腺MT基因表达量或MT蛋白含量高于鳃组织(Rasporet al, 2004; Geffardet al, 2005)。造成上述差异的原因主要在于MT的表达量受到生物种类、暴露途径(水相和食物相)及其它环境因素的影响。
研究发现, 不同壳色菲律宾蛤仔的生长速率、存活率及免疫学指标等方面存在差异(闫喜武等, 2005;丁鉴锋等, 2012)。Liu等(2011a, b)研究了三种壳色菲律宾蛤仔(白蛤、斑马蛤、两道红)对Hg暴露的代谢响应, 发现不同壳色蛤仔的响应途径存在显著差异;其中, 白蛤的鳃组织和两道红的消化腺组织在指示重金属污染方面具有更高的灵敏性。在本研究中, 选取白蛤和斑马蛤两种壳色菲律宾蛤仔为研究对象,比较了Cd2+暴露后RpMT基因表达量变化的差异。结果发现, 急性和亚慢性Cd2+暴露后, 白蛤消化腺组织RpMT基因的上调幅度低于斑马蛤, 而鳃组织RpMT基因的上调幅度则超过斑马蛤。上述结果表明, 在指示水相Cd2+污染方面, 两种壳色蛤仔不同组织的灵敏度存在差异, 其中以白蛤鳃组织的敏感度较高。
丁鉴锋, 杨 霏, 闫喜武等, 2012. 不同壳色菲律宾蛤仔免疫机能的比较研究. 大连海洋大学学报, 27(5): 411—416
闫喜武, 张国范, 杨 凤等, 2005. 菲律宾蛤仔莆田群体两个壳色品系生长发育的比较. 大连水产学院学报, 20(4):266—269
季向山, 赵 燕, 丁 雷等, 2006. 贝海湾扇贝对海水中镉的富集规律研究. 水产学报, 30(6): 801—805
曾艳艺, 黄小平, 2010. 重金属对海洋桡足类的影响研究进展.生态学报, 30(4): 1042—1049
廖永岩, 陈润锋, 2007. Cu、Pb、Cd、Hg亚致死浓度对三疣梭子蟹幼体的影响. 环境科学学报, 27(8): 1347—1358
Amiard-Triquet C, Rainglet F, Larroux Cet al, 1998.Metallothioneins in Arctic bivalves. Ecotoxicology and Environmental Safety, 41(1): 96—102
Bebianno M J, Nott J A, Langston W J, 1993. Cadmium metabolism in the clamRuditapes decussata: the role of metallothioneins. Aquatic Toxicology, 27(3—4): 315—334
Bebianno M J, Serafim M A, Rita M F, 1994. Involvement of metallothionein in cadmium accumulation and elimination in the clamRuditapes decussate. Bulletin of Environmental Contamination and Toxicology, 53(5): 726—732
Bebianno M J, Serafim M A, 1998. Comparison of metallothionein induction in response to cadmium in the gills of the bivalve mollusksMytilus galloprovincialisandRuditapes decussates.The Science of the Total Environment, 214(1—3): 123—131
Blasco J, Puppo J, 1999. Effect of heavy metals (Cu, Cd and Pb)on aspartate and alanine aminotransferase inRuditapes philippinarum(Mollusca: bivalvia). Comparative Biochemistry and Physiology, Part C, 122(2): 253—263
Butler R A, Roesijadi G, 2001. Disruption of metallothionein expression with antisense oligonucleotides abolishes protection against cadmium cytotoxicity in molluscan hemocytes.Toxicological Sciences, 59(1): 101—107
Chang Y T, Jong K J, Liao B Ket al, 2007. Cloning and expression of metallothionein cDNA in the hard clam (Meretrix lusoria)upon cadmium exposure. Aquaculture, 262(2—4): 504—513
Choi Y K, Jo P G, Choi C Y, 2008. Cadmium affects the expression of heat shock protein 90 and metallothionein mRNA in the Pacific oyster,Crassostrea gigas. Comparative Biochemistry and Physiology, Part C, 147(3): 286—292
Cong M, Wu H F, Liu X Let al, 2012. Effects of heavy metals on the expression of a zinc-inducible metallothionein-III gene and antioxidant enzyme activities inCrassostrea gigas.Ecotoxicology, 21(7): 1928—1936
Faria M, Carrasco L, Diez Set al, 2009. Multi-biomarker responses in the freshwater musselDreissena polymorphaexposed to polychlorobiphenyls and metals. Comparative Biochemistry and Physiology, Part C, 149(3): 281—288
Galay B M, Rainbow P S, 2001.Availability of cadmium and zinc from sewage sludge to the flounder,Platichthys flesus, via a marine food chain. Marine Environmental Research, 51(5):417—439
Geffard A, Amiard-Triquet C, Amiard J C, 2005. Do seasonal changes affect metallothionein induction by metals in mussels,Mytilus edulis? Ecotoxicology and Environmental Safety, 61(2): 209—220
George S G, Todd K, Wright J, 1996. Regulation of metallothionein in teleosts: induction of MTmRNA and protein by cadmium in hepatic and extrahepatic tissues of a marine flatfish, the turbot (Scophthalmus maximus). Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 113(2): 109—115
Ji J, Choi H J, Ahn I Y, 2006. Evaluation of Manila clamRuditapes philippinarumas a sentinel species for metal pollution monitoring in estuarine tidal flats of Korea: effects of size,sex, and spawning on baseline accumulation. Marine Pollution Bulletin, 52(4): 447—468
Lemoine S, Laulier M, 2003. Potential use of the levels of the mRNA of a specific metallothionein isoform (MT220) in mussel(Mytilus edulis) as a biomarker of cadmium contamination.Marine Pollution Bulletin, 46(11): 1450—1455
Liu X L, Zhang L B, You L Pet al, 2011a. Assessment of clamRuditapes philippinarumas heavy metal bioindicators using NMR-based metabolomics. Clean-Soil, Air, Water, 39(8):759—766
Liu X L, Zhang L B, You L Pet al, 2011b. Differential toxicological effects induced by mercury in gills from three pedigrees of Manila clamRuditapes philippinarumby NMR-based metabolomics. Ecotoxicology, 20(1): 177—186
Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod. Methods, 25(4): 402—408
Moraga D, Mdelgi-Lasram E, Romdhane M Set al, 2002.Genetic responses to metal contamination in two clams:Ruditapes decussatusandRuditapes philippinarum. Marine Environmental Research, 54(3—5): 521—525
Meng W, Qin Y W, Zheng B Het al, 2008. Heavy metal pollution in Tianjin Bohai Bay, China. Journal of Environmental Sciences, 20(7): 814—819
Park K I, Tsutsumi H, Hong J Set al, 2008. Pathology survey of the short-neck clamRuditapes philippinarumoccurring on sandy tidal flats along the coast of Ariake Bay, Kyushu,Japan. Journal of Invertebrate Pathology, 99(2): 212—219
Raspor B, Dragun Z, Erk Met al, 2004. Is the digestive gland ofMytilus galloprovincialisa tissue of choice for estimating cadmium exposure by means of metallothioneins? Science of the Total Environment, 333(1—3): 99—108
Rebelo M, Pfeiffe W, Silva Het al, 2003. Cloning and detection of metallothionein mRNA by RT-PCR in mangrove oysters(Crassostrea rhizophorae). Aquatic Toxicology, 64(3):359—362
Ridlington J W, Fowler B A, 1979. Isolation and partial characterization of a cadmium-binding protein from the American oyster (Crassostrea virginica). Chemico-Biological Interactions, 25(2—3): 127—138
Ringwood A H, Hoguet J, Keppler Cet al, 2004. Linkages between cellular biomarker responses and reproductive success in oystersCrassostrea virginica. Marine Environmental Research, 58(2—5): 151—156
Romeo M, Gnassia-Barelli M, 1995. Metal distribution in different tissues and in clam subcellular fractions of the Mediterranean clamRuditapes decussatustreated with cadmium, copper or zinc. Comparative Biochemistry and Physiology, Part C,111(3): 457—463
Seebaugh D R, Goto D, Wallace W G, 2005. Bioenhancement of cadmium transfer along a multi-level food chain. Marine Environmental Research, 59(5): 473—491
Silvestre F, Duchene C, Trausch Get al, 2005. Tissue-specific cadmium accumulation and metallothionein-like protein levels during acclimation process in the Chinese crabEriocheir sinensis. Comparative Biochemistry and Physiology, Part C,140(1): 39—45
Smaoui-Damak W, Hamza-Chaffai A, Bebianno M Jet al, 2004.Variation of metallothioneins in gills of the clamRuditapes decussatesfrom the Gulf Gabès (Tunisia). Comparative Biochemistry and Physiology, Part C, 139(4): 181—188
UNEP/RAMOGE, 1999. Manual on the biomarkers recommended for the MED POL biomonitoring programme. UNEP, Athens:1—92
Vasak M, Hasler D W, 2000. Metallothionein: new functional and structural insights. Current Opinion in Chemical Biology,4(2): 177—183
Wang L L, Song L S, Ni D Jet al, 2009. Alteration of metallothionein mRNA in bay scallopArgopecten irradiansunder cadmium exposure and bacteria challenge. Comparative Biochemistry and Physiology, Part C, 149(1): 50—57
Wang Q, Wang X, Wang Xet al, 2010. Analysis of metallotionein expression and antioxidant enzyme activities inMeretrix meretrixlarvae under sublethal cadmium exposure. Aquatic Toxicology, 100(4): 321—328
Wu S M, Jong K J, Lee Y J, 2006. Relationships among metallothionein, cadmium accumulation, and cadmium tolerance in three species of fish. Bulletin of Environmental Contamination and Toxicology, 76(4): 595—600
Zorita I, Bilbao E, Schad Aet al, 2007. Tissue- and cell-specific expression of metallothionein genes in cadmium- and copper-exposed mussels analyzed by in situ hybridization and RT-PCR. Toxicology and Applied Pharmacology, 220(2):186—196
