三疣梭子蟹(Portunus trituberculatus)CYP2基因的cDNA克隆及表达分析*
2014-03-19冯艳艳张德宁葛倩倩吕建建高保全
冯艳艳 李 健① 张德宁 刘 萍 葛倩倩 吕建建 高保全
(1. 上海海洋大学 上海 201306; 2. 中国水产科学研究院黄海水产研究所 青岛 266071)
细胞色素CYP450 (cytochrome CYP450, CYP450)酶系是一类亚铁血红素蛋白的超家族酶系, 主要是参与多种内源物质(保幼激素及其类似物、蜕皮甾酮、脂肪酸和信息素等)和外源物质(药物、环境毒物等)(Danielson, 2002; Matthiaset al, 2008; 刘晨晖等,2010)的代谢。自1958年首个CYP450蛋白在大鼠肝微粒体中被发现以来(Jensenet al, 1958), CYP450酶系的研究已经有五十多年的历史(Estabrook, 1996)。20世纪80年代, 随着分子生物学技术的应用, Fujii-Kuriyama等(1982)克隆和测序了老鼠肝CYP450基因(Chenet al, 1982), 这标志着 CYP450研究由生物化学、生物物理学特征的鉴定及酶学功能的研究转变为基因表达的调控机制和结构与功能的对应关系上(朱磊等, 2011)。生物体CYP450 酶系活性受到遗传、机体状态、营养、疾病等多种因素的影响, 尤其是许多药物外源化合物可诱导或抑制CYP450酶的活性, 从而影响药物的代谢(夏伟, 2000)。目前, 国内外对水产品动物CYP450酶研究较少, 但随着对CYP450酶分子水平的认识和体外研究技术的进步, 可以通过研究外源物质对CYP450酶的诱导和抑制情况, 预测或评估水产动物体内可能发生的药物相互作用, 指导药物的安全联用(胡晓, 2010)。CYP450酶系在药物代谢中起主要作用的有四个家族: CYPs1—4, 其中CYP1、CYP2和CYP3家族酶承担着人体三分之二药物的代谢(Guengerich, 2008; 樊慧蓉等, 2006), 而在甲壳动物中目前只发现了CYP2和CYP4家族基因。CYP2家族是目前已知的CYP450同工酶中最大、最复杂的家族(周园等, 2002), 它是CYP450中的重要成分, 主要参与许多低分子有机化合物及药物在体内的代谢。有关海洋甲壳类CYP2基因的研究报道十分有限, 现只在佛罗里达龙虾Panulirus argus(Boyleet al, 1998)和岸蟹Carcinus maenas(Rewitzet al, 2003)中有报道, 三疣梭子蟹Portunus trituberculatus尚未见报道。本实验主要克隆了三疣梭子蟹CYP2基因的cDNA全长序列, 并对序列进行比较分析; 利用Real time RT-PCR方法分析该基因的组织表达情况及其在外源药物(磺胺嘧啶)作用下表达量的变化, 以期为进一步了解甲壳类动物CYP450的功能和作用机制, 探讨CYP450与药物之间的相互作用奠定基础。
1 材料与方法
1.1 实验材料
实验动物 实验于2012年在山东省潍坊市昌邑海丰水产养殖有限责任公司进行。实验所用材料为三疣梭子蟹“黄选1号”80日龄幼蟹, 体重(32.66±6.27)g。健康个体暂养于半径3m 的室内水泥养殖池中, 每池80只。水温22—25°C, pH 7.8—8.4,盐度25—27, 持续充氧, 每天换水1/3, 投喂蓝蛤。暂养一周。
实验试剂 Trizol Reagent购自美国Invitrogen公司; TaKaRa TaqTM、PMD18-T 载体、Top 10感受态细胞、SMARTTMRACE Amplification Kit和Advantage 2 PCR Kit购自日本TaKaRa公司; 其他试剂为国产分析纯。
1.2 总RNA的提取与第一链cDNA及3′、5′RACE cDNA的合成
取健康三疣梭子蟹个体的肝胰腺于液氮中研磨,Trizol法提取总RNA, 按照Invitrogen说明书进行;并用紫外分光光度计与1%凝胶电泳检测其质量与完整性。核酸蛋白测定仪(Thermo, NANO DROP-2000)测定RNA浓度。用PrimerScript RT reagent Kit with gDNA Eraser产品去除基因组DNA后合成第一链cDNA; 按照SMARTTMRACE Amplification Kit试剂盒的使用说明, 合成用于3′和5′RACE扩增的cDNA。反转录产物于-40°C冰箱保存备用。
1.3 三疣梭子蟹CYP2基因cDNA中间片段的克隆
从美国国立生物技术信息中心(NCBI)数据库中搜寻佛罗里达龙虾P. argus、斑马鱼Danio rerio和虹鳟Oncorhynchus mykiss的CYP2基因, 利用ClustalX软件对以上序列进行同源性对比以确定其保守区域,并设计兼并引物CYP2-F1和CYP2-R1。以三疣梭子蟹肝胰腺cDNA为模板, 以CYP2-F1和CYP2-R1为引物, 扩增三疣梭子蟹CYP2基因中间片段。PCR扩增反应体系为100μL, 扩增反应条件为: 94°C 5min预变性, 94°C 30s变性, 52°C 30s退火, 72°C 1min延伸,30个循环, 最后72°C 10min延伸, 4°C保存。PCR扩增产物用2%琼脂糖凝胶电泳检测扩增片段大小。用SanPrep柱式DNA胶回收试剂盒(上海生工)回收目的片段并进行纯化, 纯化产物与pMD18-T载体(日本TaKaRa公司)连接, 并将重组质粒转化到大肠杆菌TOP 10感受态细胞(日本TaKaRa公司)中, 涂平板、进行蓝白斑筛选, 阳性克隆经菌落 PCR 鉴定后送上海生物工程技术有限公司测序。
1.4 CYP2基因3′和5′末端扩增
中间片段经NCBI比对(http: //www.ncbi.nlm.nih.gov)后, 可证实所得三疣梭子蟹CYP2基因部分序列与其他物种的CYP2基因同源。利用Primer Premier 5.0软件设计特异性引物: CYP2-RACE3′和CYP2- RACE5′。两条引物用于RACE扩增cDNA全长序列, 3′-RACE和5′-RACE PCR扩增使用Advantage 2 PCR Kit试剂盒(日本TaKaRa公司), PCR产物的分离、纯化和测序等方法同中间片段克隆。引物序列见表1。
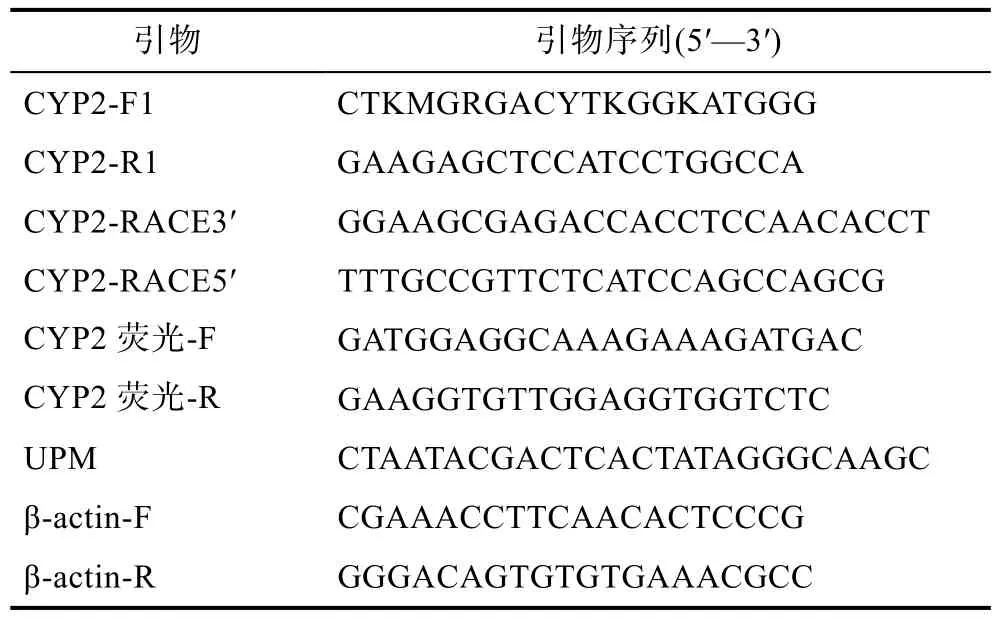
表1 三疣梭子蟹CYP2基因全长克隆及定量RT-PCR表达所用引物Tab.1 Primers used for P. trituberculatus CYP2 gene cloning and mRNA expression analysis
1.5 CYP2基因的生物信息学分析
使用DNAStar软件中的SeqMan程序对测序结果进行载体序列去除和序列拼接, 使用 EditSeq程序预测开放阅读框(ORF)、翻译氨基酸和蛋白质理化性质的预测。使用NCBI网站(http: ∥www.ncbi.nlm.nih.gov/blast)的BLASTN和BLASTX软件对CYP2基因进行同源性分析。使用PredictProtein服务器进行蛋白序列功能位点分析(PROSITE motif search)。使用Signal P3.0 (http: // www.cbs.dtu.dk/services/SignalP/)预测蛋白信号肽。使用 ClustalX软件对三疣梭子蟹与其他物种的 CYP2基因氨基酸序列进行多序列比对, 在此基础上采用MEGA 4.0 软件, 以邻接法(Neighbor-joining)构建系统进化树。
1.6 三疣梭子蟹本体表达及肌注磺胺嘧啶对CYP2基因表达的影响
1.6.1 实验设计
给药方法: 根据《新编渔药手册》的推荐剂量和预实验结果, 把暂养了一周的三疣梭子蟹随机分为4组, 每组50只个体, 分别为对照组(0.7%生理盐, C)、磺胺嘧啶低剂量(15mg/kg, SD-L)、磺胺嘧啶中剂量(30mg/kg, SD-M)和磺胺嘧啶高剂量(60mg/kg,SD-H)。按照各处理组给药剂量, 通过三疣梭子蟹第四步足与体壁关节膜处肌肉注射给药(吴光红等,2008), 注射前和注射后用酒精棉对注射部位进行消毒处理。各处理组每天注射一次, 连续5天。
取样方法: 于末次给药24h后1、3、6、12、18、24、48、72h取样, 每组取肝胰腺组织样品, 每个时间点随机取3只, 液氮保存。另取3只健康无注射药物的三疣梭子蟹的肝胰腺、鳃、肌肉、血淋巴、眼柄和心脏进行RNA提取, 以检测三疣梭子蟹CYP2基因在不同组织中的表达水平。
1.6.2 CYP2基因mRNA Real Time RT-PCR定量检测
将各组反转录好的三疣梭子蟹肝胰腺的cDNA用DEPC水稀释3倍, 配制10μL体系反应液。分别加入SYBR Premix Ex TaqTM II (2×) 5μL, PCR正反引物(10μmol/L)各0.4μL, ROX Reference Dye II 0.2μL,cDNA稀释模板1μL, 灭菌水3μL。三疣梭子蟹CYP2基因荧光定量引物: CYP2荧光-F和CYP2荧光-R(见表1), 以三疣梭子蟹β-actin为内参基因(见表1)。荧光定量PCR反应条件: 95°C 30s, 95°C 5s, 60°C 34s,40个循环。不同时间点同一样品的目的基因和内参基因均在同一个96孔板上进行, 每个样品采取三个平行。实验仪器为Applied Biosystems 7500 Real-Time PCR荧光定量PCR仪, 采用2-ΔΔCt法分析数据。
1.7 数据统计分析
实验结果用SPSS17.0软件进行单因素方差分析(P<0.05时表示差异显著, 用*表示;P<0.01时表示差异极显著, 用**表示), 并进行Duncan 氏多重比较(当P<0.05时差异显著)。
2 结果
2.1 CYP2基因的全长cDNA序列分析
采用RACE方法扩增获得三疣梭子蟹CYP2基因cDNA全长为1660bp(GenBank登录号: KF781516),包含1479bp的开放阅读框(ORF)、93bp的5′非编码区和88bp 的3′非编码区, 编码一个由492个氨基酸组成的多肽, 预测理论等电点PI为6.348, 分子量大小为56.68kD。有一个终止子, 并含有一个多腺苷酸信号ATTAAA和一个poly(A)尾巴。起始密码子ATG位于94—96位核苷酸。
用SignalP 3.0程序分析该基因的推导理论氨基酸发现CYP2的1—21氨基酸区域具有一个信号肽。利用PredictProtein服务器对三疣梭子蟹CYP2蛋白序列进行功能位点分析, 发现该蛋白序列具有多个功能位点(图1), 包括: 1个cAMP和cGMP依赖性蛋白激酶磷酸化位点: 118—121; 5个酪蛋白磷酸化位点:83—86, 97—100, 280—283, 337—340, 488—491; 7个N-肉蔻酰基化位点: 24—29, 105—110, 129—134,153—158, 297—302, 333—338, 383—388; 5个蛋白激酶K磷酸化位点: 41—43, 121—123, 202—204, 282—284, 488—491; 1个酰胺化位点: 430—433; 1个CYP450家族特有的亚铁血红素结合区: 428—437。
蛋白质的磷酸化、酰基化和酰胺化都属于化学修饰, 通过对这些位点的鉴定有助于进一步研究蛋白质主要定位、可能的稳定性结构以及功能作用的发现等, 具有非常重要的生物学意义。
2.2 CYP2基因多序列比对及系统进化树分析
使用DNAMAN软件对三疣梭子蟹CYP2氨基酸序列与其他物种的CYP2氨基酸序列进行同源比对分析, 结果如图2。三疣梭子蟹CYP2基因与甲壳动物中的岸蟹C. maenas的同源性最高, 达到75%, 与佛罗里达龙虾P. argus同源性为39%, 与脊椎动物底鳉Fundulus heteroclitus、黑点青锵Oryzias melastigma、红尾蝴蝶鱼Chaetodon xanthurus、默氏蝴蝶鱼Chaetodon mertensii、斑马鱼Danio rerio、食蟹猴Macaca fascicularis、褐家鼠Rattus norvegicus的同源性分别为36%、35%、36%、35%、33%、35%、32%。利用MEGA4.0软件构建系统进化树并分析, 结果表明: 三疣梭子蟹CYP2基因与甲壳动物中的岸蟹C.maenas紧密聚为一支, 之后又与佛罗里达龙虾P.argus聚为一支(图3)。
2.3 CYP2基因在三疣梭子蟹各组织中的表达
利用Real Time RT-PCR检测三疣梭子蟹在组织中的CYP2基因转录表达量, 结果表明, CYP2基因在肝胰腺、鳃、心脏、肌肉、眼柄和血淋巴中都有表达。以血淋巴中表达量为基准, 在肝胰腺中表达量最高(P<0.01), 其次是鳃(P<0.01), 在血淋巴中表达最少(图4)。

图1 三疣梭子蟹CYP2基因cDNA的核苷酸序列及其推导的氨基酸序列Fig.1 Nucleotide sequence and deduced amino acid sequence of CYP2
2.4 不同剂量及作用时间的磺胺嘧啶对CYP2基因在肝胰腺中表达变化量的影响
利用Real Time RT-PCR检测三疣梭子蟹在注射不同剂量的磺胺嘧啶在不同时间点肝胰腺中CYP2基因转录表达量的变化情况(图5)。结果显示, 连续注射磺胺嘧啶5d后, 各实验组均有CYP2 mRNA的表达, 三个剂量组较对照组均出现不同程度的上调。其中, 低剂量组在给药后的1、12、18和24h表达量显著高于对照组(P<0.05), 且表达量逐渐降低趋于对照组; 中剂量组和高剂量组在各取样点表达量均显著高于对照组(P<0.05)。对于同一测定时间, 磺胺嘧啶低中高剂量组的CYP2基因的表达量6h后呈现高剂量组>中剂量组>低剂量组。
3 讨论
目前有关海洋无脊椎动物细胞色素CYP450的研究主要集中在基因克隆及功能分析方面, 但与脊椎动物相比, 有关海洋甲壳类CYP450基因的研究报道十分有限(张喆等, 2011)。1996年, James (1984)首次从甲壳动物佛罗里达龙虾P. argus中克隆出了CYP2家族的CYP2L1 基因, 随后, Boyle 等(1998)在P. argus肝胰腺中又克隆出多条 CYP2L 基因,预示海洋甲壳动物CYP2 基因具有多态性。2003 年,同样属于第二家族的 CYP330A1 序列在岸蟹C.maenas肝胰腺中被分离出来(Rewitzet al, 2003)。此外, 研究人员在岸蟹C. maenas(Rewitzet al, 2003)、中国对虾Fenneropenaeus chinensis(张喆等, 2011)和利莫斯螯虾Orconectes limosus(Dauphin-Villemantet al, 1999)等海洋甲壳动物中发现了CYP4基因, 并研究了其参与苯并芘、多氯联苯、多环芳烃等环境污染物和水产药物诺氟沙星等外源化合物和蜕皮激素等内源性物质的代谢(Snyder, 1998; 张喆等, 2011)。虽然CYP450包括很多家族, 各家族参与催化的底物种类和反应类型之间具有差异性, 但是在结构上仍然保留着一些共同的保守区域, 即CYP基因家族所特有的K螺旋保守序列(ExxR)和血红素结合区(FxxGxxxCxG) (冷欣夫等, 2001)。K螺旋保守区可能是与 CYP450 的电子供体相作用, 血红素结合区中绝对保守的半胱氨酸与催化活性中心亚铁血红素中的铁元素形成硫醇盐离子键, 从而成为铁的一个配体, 这正是蛋白能够与氧结合的关键结构, 同时也是作用于底物的酶活性中心(Anzenbacher, 2001)。本研究首次克隆了三疣梭子蟹CYP2基因cDNA全序列,该基因的氨基酸序列含有CYP450蛋白保守区域, 此区域包括血红素结合区(FxxGxxxCxG)、绝对保守的半胱氨酸(Cys)和位于K螺旋保守区中的序列(ExxR)。将三疣梭子蟹CYP2氨基酸序列与其他物种进行同源比对分析发现, 三疣梭子蟹与岸蟹C. maenas同源性为75%; 进行系统进化分析发现三疣梭子蟹CYP2基因与与甲壳动物的亲缘关系最近, 与岸蟹C. maenas紧密分为一支, 由此更证明了本实验克隆的CYP2基因为三疣梭子蟹CYP2基因。

图2 三疣梭子蟹CYP2氨基酸序列与其他动物CYP2的氨基酸序列比对Fig.2 Multiple alignment of CYP2 amino acid sequence with other CYP2 animals相同的氨基酸用暗色背景表示, 缺失的氨基酸用“.”表示
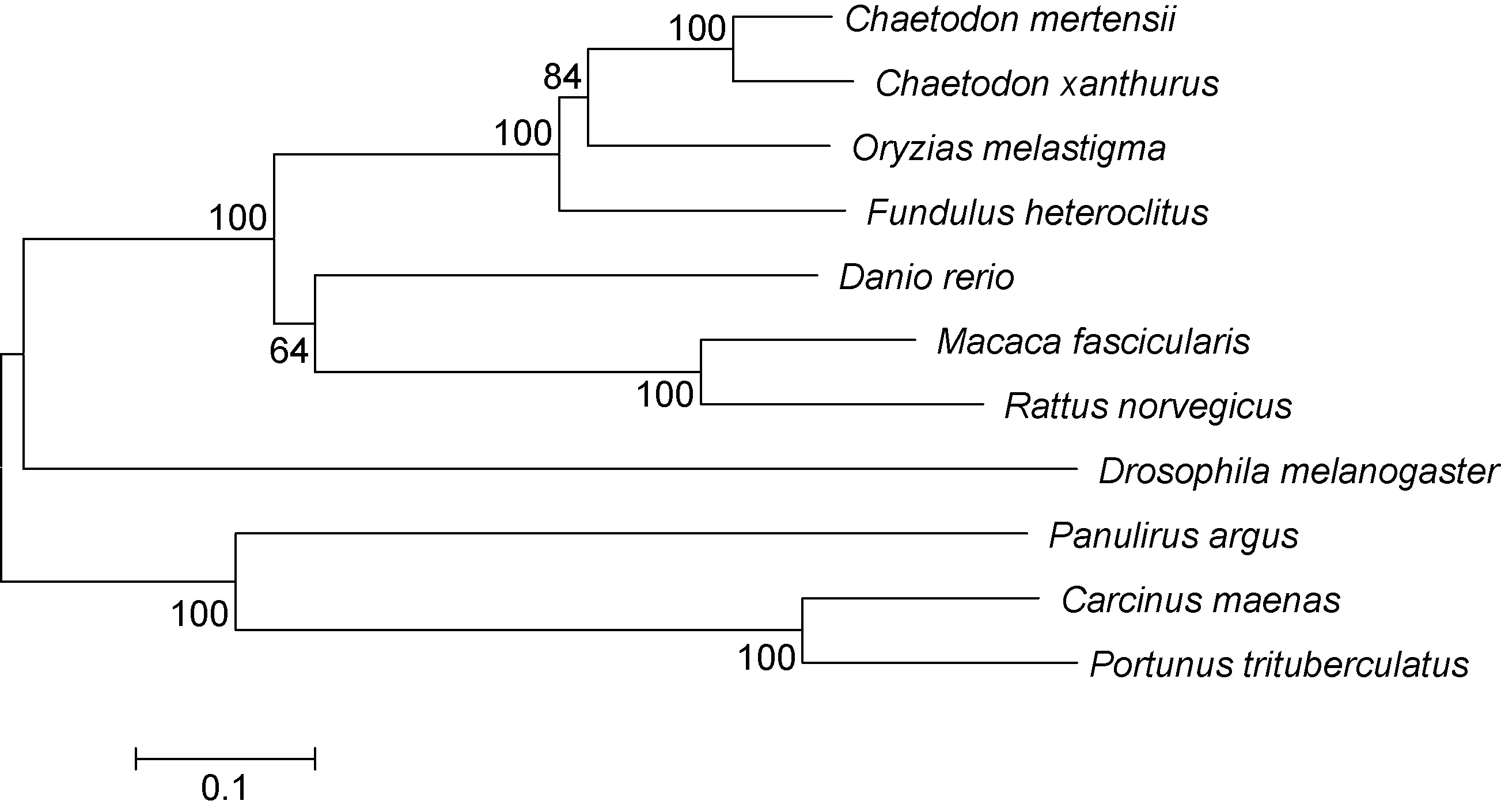
图3 不同物种的CYP2基因系统进化树Fig.3 CYP2 phylogenetic tree of different species
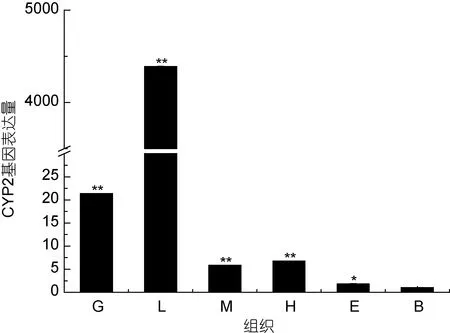
图4 三疣梭子蟹CYP2基因在组织中表达量Fig.4 Distribution of CYP2 transcript in different tissues of P.trituberculatus
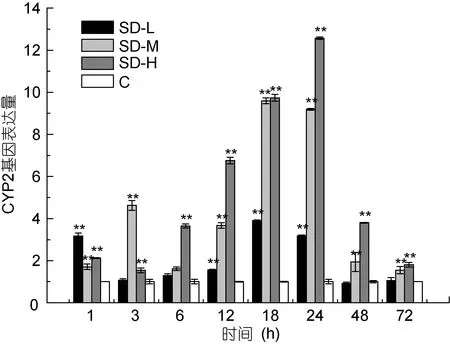
图5 不同浓度磺胺嘧啶对三疣梭子蟹肝胰腺CYP2基因表达的影响Fig.5 Variation of CYP2 gene in P. trituberculatus hepatopancreas after sulfadiazine treatment at different time
通过Real Time RT-PCR方法对三疣梭子蟹CYP2本体表达进行研究发现: CYP2基因在机体中分布广泛, 在肝胰腺、鳃、肌肉、心脏、眼柄和血淋巴中均有表达。其表达强度最高为肝胰腺, 其次是鳃, 最后在肌肉、心脏、眼柄和血淋巴中表达量最少。之所以在肝胰腺中表达最多, 是因为肝胰腺是对外来物质(包括药物或有毒物质)进行代谢反应的主要部位。Gonzalez(1993)在研究CYP450的生物学功能时发现,虽然CYP450基因表达比较广泛, 但其表达还是有选择性的, 在哺乳动物中CYP2A1只在肝脏中表达, 这与肝脏的解毒功能有关。Brown研究证明鱼类的CYP450主要在脾、肝、心、头肾、肾、鳃中表达, 其中在脾和肾中表达水平较高(Brown, 1998; 郭小泽,2009)。Solé等(2005)在对一系列海洋无脊椎动物CYP450的组织分布进行研究时发现, CYP450在环节动物的肠中表达水平最高, 在软体动物的消化腺中表达量最大, 在甲壳动物的肝胰腺中表达最多, 此研究结果与在岸蟹C. maenas中的研究类似(Damet al,2008)。Matsuo等(2008)利用荧光定量PCR和蛋白质印迹法方法对银大马哈鱼(Oncorhynchus kisutch)CYP1A、CYP2K1、CYP2M1 和CYP3A27基因进行了研究, 发现 CYP1A、CYP2M1 和 CYP3A27 在研究的所有组织中均有表达, 且CYP3A27在各组织的表达量均最高, 而 CYP2K1 只在肝脏和嗅觉器官中表达。
生物体在生活环境中会接触到许多外来物质,对外来物质的清除主要通过肝脏系统CYP450基因表达进行, 这些基因的酶产物催化外来物质极性化, 促使外来物质易于从体内排出(范岚等, 2009)。同时CYP450转录表达容易受到外来物质的影响, 外来物质可以诱导或者抑制CYP450从而影响治疗效果或产生毒副作用。外来物质主要通过影响CYP450 mRNA的转录水平、CYP450的翻译过程或者CYP450酶的活性等对CYP450产生影响。CYP2是CYP450中一种重要的药物代谢酶, 在甲壳动物中主要存在于肝胰腺, 参与许多低分子有机化合物及药物在体内的代谢。在哺乳动物, CYP2活性已被用于指示外源性化合物引起的肝脏疾病。2006年, 刘树民等(2006)发现黄药子可诱导大鼠肝脏中CYP2E1基因的表达, 黄药子和当归配伍后CYP2E1基因的表达下降, 说明黄药子和当归在CYP2E1基因的转录水平发挥作用。2007年, 陈大健等(2007a, b)研究发现氟苯尼考和乙醇对鲫鱼 CYP2E1酶均具有抑制作用, 说明氟苯尼考和乙醇在 CYP2E1酶的活性上发挥作用。2003年,Rewitz等(2003)发现岸蟹C. maenas肝胰腺中CYP330A1 (属于CYP2基因家族)的表达能够被聚丁二烯、苯并[a]芘诱导, 说明聚丁二烯、苯并[a]芘在CYP330A1基因的转录水平发挥作用。本实验用不同浓度磺胺嘧啶刺激三疣梭子蟹CYP2基因的表达, 发现磺胺嘧啶在CYP2 mRNA转录水平上有影响。各浓度磺胺嘧啶均可诱导肝胰腺中CYP2基因的表达, 并且给药剂量越大, CYP2基因上调水平越高, 且出现的峰值越晚, 这说明三疣梭子蟹CYP2基因与磺胺嘧啶的代谢有关, 并且给药浓度影响CYP2的表达程度,其原因可能是给药浓度越高, 肝胰腺CYP2基因表达量越多且持续时间越长, 代谢药物的能力就越强, 以使机体尽快将药物代谢到正常水平。这是机体细胞的一种自我保护机制, 通过这样的机制, 细胞增强了对外源性物质解毒的能力。随着给药时间的推移CYP2 mRNA转录水平逐渐降低, 其原因可能是随着给药时间的推进, 药物在机体的浓度不断减少, 药物代谢量也不断降低, 导致CYP2基因的表达慢慢降低最终回到原来的水平。磺胺嘧啶可使CYP2 mRNA表达升高, 说明其对CYP2有诱导作用, 揭示了磺胺嘧啶与CYP2酶的底物药物合用时, 很可能会发生药物的相互作用, 应适当调整用量, 避免发生不良反应。
本文主要围绕三疣梭子蟹药物代谢酶CYP2基因克隆及磺胺嘧啶对其mRNA表达水平影响进行研究, 为进一步充分了解CYP450 家族的生理功能及生理、生化反应过程, 还需要更深入的研究三疣梭子蟹CYP2 基因表达的组织特异性、蛋白表达及酶活性的影响。对于三疣梭子蟹CYP2基因的克隆、序列分析以及其表达情况的研究, 有利于进一步深入研究三疣梭子蟹CYP2基因在其生长发育和药物代谢中的作用, 同时为深入研究其他物种的CYP2基因功能奠定了理论基础。
朱 磊, 胡 晓, 房文红等, 2011. 异育银鲫P450家族CYP3A136基因的克隆与表达. 水产学报, 35(10):1450—1457
刘树民, 张 琳, 李 颖等, 2006. 黄药子与当归配伍对大鼠肝脏CYP1A2、CYP2E1基因mRNA表达的影响. 中药药理与临床, 22(3): 75—76
刘晨晖, 乐 江, 2010. 细胞色素P450 CYP2E1酶构型特征及其表达调控机制的研究进展. 中国药理学与毒理学杂志,24(2): 155—160
吴光红, 张静波, 孟 勇等, 2008. 不同水温下恩诺沙星在中华绒螯蟹体内的药代动力学. 南京农业大学学报, 31(2):105—110
冷欣夫, 邱星辉, 2001. 细胞色素P450酶系的结构、功能与应用前景. 北京: 科学出版社, 2
张 喆, 李 健, 王 芸等, 2011. 中国对虾细胞色素P450基因CYP4原核表达条件优化. 海洋科学, 35(9): 49—55
陈大健, 王加才, 张 萍等, 2007a. 氟苯尼考对鲫鱼CYP2E1活性影响的药代动力学评价. 中国兽医科学, 37(03):269—273
陈大健, 杨海峰, 覃少华等, 2007b. 乙醇对鲫鱼CYP2E1活性的影响. 西北农林科技大学学报(自然科学版), 35(8):269—273
范 岚, 谢海棠, 李 智等, 2009. 黄芩苷对Chang Liver细胞CYP3A4、CYP2C9和CYP2C19表达的影响. 中国现代医学杂志, 19(23): 3546—3550
周 园, 胡艳丽, 李丽燕等, 2002. 细胞色素P450酶的研究进展. 农垦医学, 24(3): 224—226
胡 晓, 2010. 喹诺酮药物对异育银鲫P450酶系的影响及3A亚型克隆. 四川: 四川农业大学硕士学位论文, 1—16
夏 伟, 2000. 细胞色素P450的研究进展. 国外医学: 卫生学分册, 27(1): 41—45
郭小泽, 2009. 三角帆蚌细胞色素P450基因的克隆与表达. 湖南: 湖南农业大学硕士论文, 11—36
樊慧蓉, 和 凡, 刘昌孝, 2006. Cocktail探针药物法用于评价细胞色素P450同工酶影响的研究进展. 中国药学杂志,41(14): 1045—1048
Anzenbacher P, Anzenbacherova E, 2001. Cytochromes P450 and metabolism of xenobiotics. Cellularand Molecular Life Sciences CMLS, 58(5—6): 737—747
Boyle S M, Greenberg R M, James M O, 1998. Isolation of CYP2L2 and two other cytochrome P450 sequences from a spiny lobster,Panulirus argus, hepatopancreas cDNA library. Marine Environmental Research, 46(1—5): 21—24
Brown D J, Clark G C, Van Beneden R J, 1998. A new cytochrome P450 (CYP30) family identified in the clamMercenaria mercenaria. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology,121(1): 351—360
Chen Y T, Negishi M, 1982. Expression and subcellular distribution of mouse cytochrome P450 mRNA as determined by molecular hybridization with cloned P1-450 DNA. Biochemical and Biophysical Research Communications, 104(2):641—648
Dam E, Rewitz K F, Styrishave Bet al, 2008. Cytochrome P450 expression is moult stage specific and regulated by ecdysteroids and xenobiotics in the crabCarcinus maenas. Biochemical and Biophysical Research Communications, 377(4): 1135—1140
Danielson P B, 2002. The cytochrome P450 superfamily:biochemistry, evolution and drug metabolism in humans.Current Drug Metabolism, 3(6): 561—597
Dauphin-Villemant C, Bocking D, Tom Met al, 1999. Cloning of a novel cytochrome P450(CYP4C15) differentially expressed in the steroidogenic glands of an arthropod. Biochemical and Biophysical Research Communications, 264(2): 413—418
Estabrook R W, 1996. The remarkable P450s: A historical overview of the versatile heme protein catalysts. Federation of American Societies for Experimental Biology Journal, 10:202—204
Fujii-Kuriyama Y, Mizukami Y, Kawajiri Ket al, 1982. Primary structure of a cytochrome P450: coding nucleotide sequence of phenobarbital inducible cytochrome P450 cDNA from rat liver. Proceeding of the National Academy of Science USA,79(9): 2793—2797
Gonzalez F J, 1993. Cytochrome P450 Evolution and Nomenclature.In: Sehenkman J B, Greim H eds. Handbook of Experimental Pharmacology. Springer, Berlin: 211—219
Guengerich F P, 2008. Cytochrome P450 and chemical toxicology. Chemical Research in Toxicology, 21(l): 70—83
James M O, 1984. Catalytic properties of cytochrome P450 in hepatopancreas of the spiny lobster,Panulirus argus.Marine Environmental Research, 14: 1—11
Jensen S L, Cohen-Bazire G, Nakayama T Oet al, 1958. The path of carotenoid synthesis in aphotosynthetic bacterium.Biochimica et Biophysica Acta, 29(3): 477—498
Matsuo A Y O, Gallagher E P, Trute Met al, 2008, Characterization of Phase I biotransformation enzymes in coho salmon(Oncorhynchus kisutch). Comparative Biochemistry and Physiology Part C: Toxicology and Endocrinology, 147(1):78—84
Matthias D, Sabine E, Chimene Aet al, 2008. Cloning, expression and characterization of CYP102A7, a self-sufficient P450 monooxygenase fromBacillus licheniformis. Applied Microbiology Biotechnology, 79: 931—940
Rewitz K, Styrishave B, Andersen O, 2003. CYP330A1 and CYP4C39 enzymes in the shore crabCarcinus maenas:sequence and expression regulation by ecdysteroids and xenobiotics. Biochemical and Biophysical Research Communications, 310(2): 252—260
Snyder M J, 1998. Cytochrome P450 enzymes belonging to the CYP4 family from marine invertebrates. Biochemical and Biophysical Research Communications, 249(1): 187—190
Solé M, Livingstone D R, 2005. Components of the cytochrome P450-dependent monooxygenase system and ‘NADPH- independent benzo [a] pyrene hydroxylase’activity in a wide range of marine invertebrate species. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 141(1):20—31
