高考常考的化学“小实验”知识梳理
2014-03-18江丹虹衷明华
江丹虹 衷明华
(韩山师范学院化学系,广东 潮州 521041)
实验作为每年必考的知识点之一,考查的方式是灵活多变,但主要以文字型、图象型或图表型的形式出现,这些题目往往是来源于课本中的某一部分知识,但也有些来源于课外的积累,在命题时进行了组合。
一、考纲对实验的要求
1.了解化学实验是科学探究过程中的一种重要方法。
2.了解化学实验室常用仪器的主要用途和使用方法。
3.掌握化学实验的基本操作,能识别化学品安全使用标识,了解实验室一般事故的预防和处理方法。
4.掌握常见气体的实验室制法(包括所用试剂、仪器,反应原理和收集方法)。
5.能对常见的物质进行检验、分离和提纯,能根据要求配制溶液。
6.能根据实验试题要求,做到:
(1)设计、评价或改进实验方案;
(2)了解控制实验条件的方法;
(3)分析或处理实验数据,得出合理结论;
(4)绘制和识别典型的实验仪器装置图。
二、知识梳理
(一)仪器、药品的放置位置
1.实验室制氨气:Ca(OH)2(s)与NH4Cl(s)(药品都为粉末状),其中Ca(OH)2不能换成NaOH,因为NaOH碱性较强,会腐蚀玻璃。试管略向下倾斜;向下排空气法;且收集试管口塞一团棉花(KMnO4制取O2发生装置试管口也要塞一团棉花)。
2.温度计放置位置:①测蒸汽(分馏.蒸馏)水银球与支管口下端相平;②测反应液(用浓硫酸、乙醇制取乙烯)水银球浸没反应液;③测水浴:放于水中。
3.冷凝水:下口进,上口出。
4.注意原电池的正负极,电解池的阴阳极是否相反。
5.浓硫酸的稀释:沿玻璃棒将浓硫酸注入水中并不断搅拌。
6.萃取:看萃取剂选择是否正确(如萃取碘水中碘用酒精,这是错误的)。
7.酸式滴定管(下端有玻璃塞):只盛酸或强氧化性物质;碱式滴定管(下端有乳胶管):只盛碱,不能盛酸和强氧化性物质。
分液漏斗看分层后溶液所属层是否描述正确(密度比水小的,在上层的一般有苯,甲苯或烃;密度比水大的,在下层的有除甲苯以外苯的取代物或四氯化碳等);分液时,下层溶液从下口出,上层溶液从上口出。
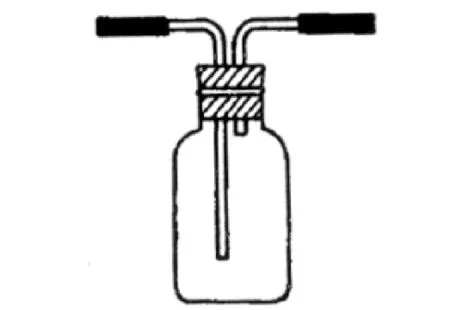
图 气体收集装置
8.此装置可用于收集H2、NH3、HCl、NO2等气体(因为此时没有规定从那一边进从那一边出)。
(二)与压强有关相关知识点
1.收集气体:物质的摩尔质量M大于29时,长进短出;M小于29时,短进长出。
2.防倒吸[原因:压强会骤减]:①吸收NH3,HCl气体时用倒扣漏斗贴在水面,若导管伸入液面,须在水下层;②加四氯化碳等密度比水大的有机溶剂,注意此时导管要伸入有机层;③*制乙酸乙酯实验:导管不能伸入液面,否则会倒吸,溶液用饱和NaCO3或饱和NaHCO3溶液,不能用NaOH溶液。
3.装置气密性:先处理为密闭体系,使体系中的压强以一定形式呈现出来。
4.吸氧腐蚀,使体系压强降低;析氢腐蚀,使体系压强增大。
5.简易启普发生器(以制H2为例,打开活塞,容器内压强与外界大气压相同,球形漏斗内的稀硫酸在重力作用下流到容器中,与锌粒接触,产生H2;关上活塞后,由于酸液继续与锌粒接触,H2依然生成,此时容器内部压强大于外界大气压,压力将酸液压回球形漏斗,使酸液与锌粒脱离接触,H2不再产生。)
(三)“漏”仪器相关知识点
1.测中和热:看是否漏“环形玻璃搅拌棒”。
2.溶液转移:看是否漏“玻璃棒”。
3.铝热反应:看下端是否漏“盛细沙的蒸发皿”。
(四)课本小实验
1.Fe(OH)2的制取:胶头滴管伸入液面(正常情况下胶头滴管垂直于试管正上方),且在试管上方封一层有机层。
2.Fe(OH)3胶体:往沸水中滴加氯化铁,不能往氢氧化钠加氯化铁。
3.亚铁盐保存,加Fe粉和对应的酸。
4.银氨溶液配制:往AgNO3溶液加氨水至沉淀恰好完全溶解。
5.新制Cu(OH)2悬浊液配制时,碱须过量,否则与含-CHO有机物反应看不到砖红色沉淀,如蔗糖在酸性条件下水解,加新制Cu(OH)2悬浊液共热观察不到现象(无用氢氧化钠,调节至碱性)。
6.实验制硝基苯时,应先将硝酸与浓硫酸混合后再加入到苯中。
7.容量瓶的查漏:在容量瓶内装入半瓶水,塞紧瓶塞,用右手食指顶住瓶塞,另一只手五指托住容量瓶底,将其倒立(瓶口朝下),观察容量瓶是否漏水。若不漏水,将瓶正立且将瓶塞旋转180°后,再次倒立,检查是否漏水,若两次操作,容量瓶瓶塞周围皆无水漏出,即表明容量瓶不漏水。经检查不漏水的容量瓶才能使用。(加水→倒立→观察→正立,瓶塞旋转180°→倒立→观察)。
8.pH试纸:测气体时,先润湿;测液体时,不能先润湿。
9.坩埚灼烧时,盖子要打开。
10.一般情况下读取量筒中溶液的体积时,视线应与溶液的凹液面相切的刻度相平,但读取水银的体积较特殊,视线与水银凸液面相切的刻度相平。
11.制取溴苯无需加热装置,而制取硝基苯需要加热装置。
12.Cl2和石灰乳反应制得漂粉精,而不是跟澄清石灰水反应制得。
13.浓硫酸和浓硝酸在常温下可以使Al、Fe、Cr钝化,原理都是生成致密的氧化膜,阻隔了进一步的反应。
(五)干燥剂的选择
碱石灰、氢氧化钠:碱性干燥剂,只能干燥碱性或中性气体。
浓硫酸、五氧化二磷、硅酸:酸性干燥剂。
氯化钙:中性干燥剂,但不能干燥氨气,因为CaCl2会与NH3反应生成CaCl2·8NH3。
洗气瓶放液体干燥剂,U型管放固体干燥剂。
(六)数据记录
1.pH试纸读数时读到整数。
2.滴定管读到小数点后两位。
3.量筒读到小数点后一位。
4.托盘天平读到小数点后一位。
5.电子分析天平读到小数点后四位。
(七)药品的存放
1.液体存放在细口瓶中,固体存放在广口瓶中。
2.酸式滴定管(有玻璃塞):只用于盛放酸或强氧化物质;碱式滴定管(有乳胶管):只盛碱。
3.NaHCO3与NaCO3
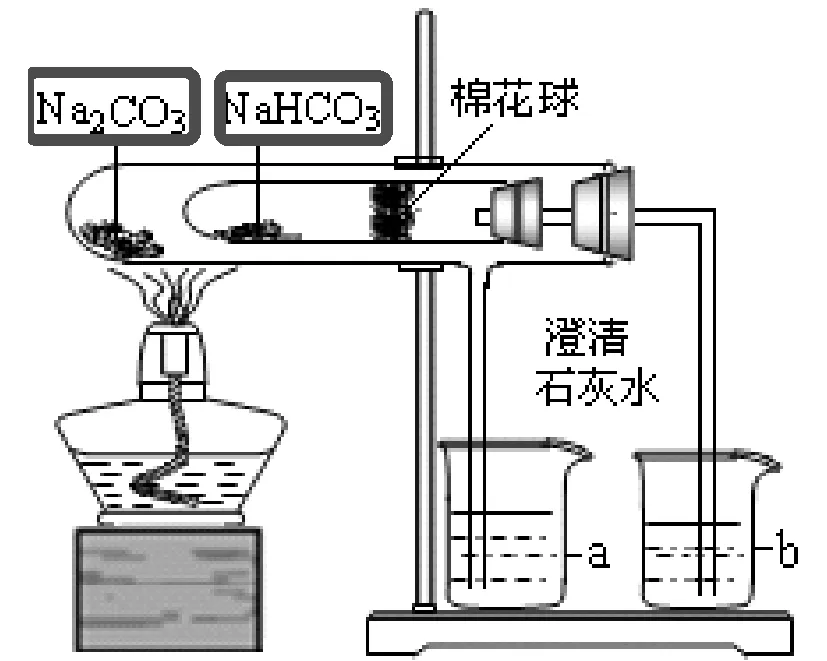
图 药品的存放
这样做是为了防止碳酸氢钠发生分解生成的水回流到试管底部,造成试管破裂。
4.简易启普发生器
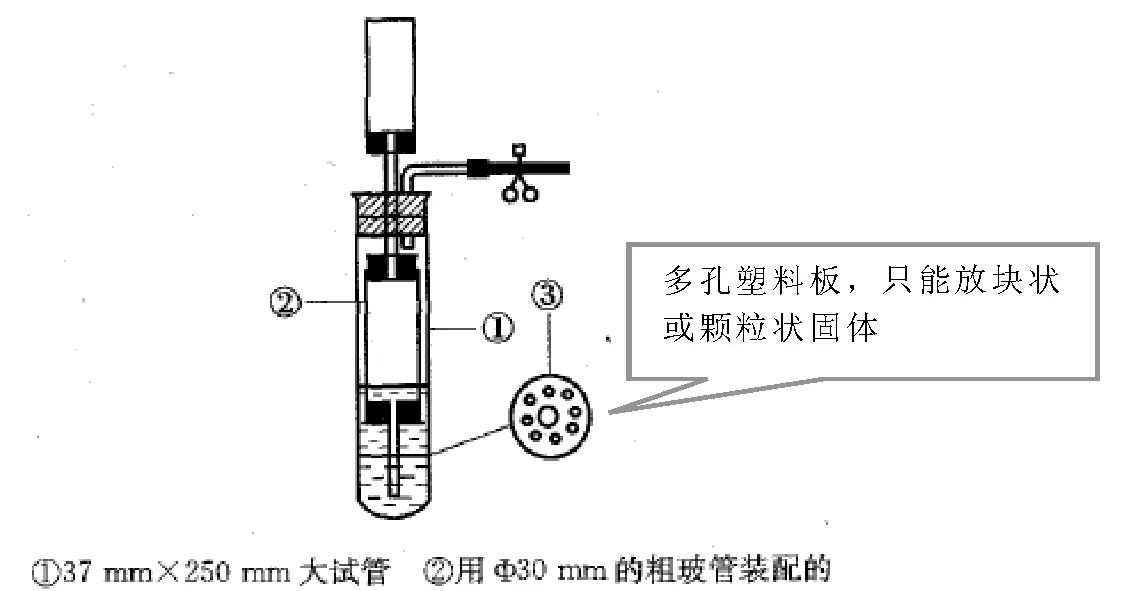
图 简易启普发生器
使用的四个条件:
①多孔塑料板上只能放块状或颗粒状固体;
②反应生成的气体溶解性小;
③反应无强热放出;
④旋转导气管活塞控制反应进行或停止。
三、习题探究
1.(江苏卷6)下列装置或操作能达到实验目的的是( )。
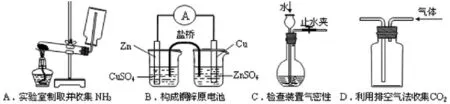
图 实验装置
解析:A中收集NH3装置无棉花,(棉花的目的是防止气体对流,在较短的时间内收集满NH3);B中右边烧杯中电解质溶液应是CuSO4,C是实验中常见检查气密性的装置,长颈漏斗的下端有伸入液面以下,用止水夹夹住导管,处理为密闭体系,通过长颈漏斗向密闭容器里加水,看是否在漏斗的下端形成一段稳定的液柱,从而得知气密性如何,C对;收集比空气重的气体应该是长进短出故D错。答案:C。
2.(09年广东化学3)下列有关实验操作的说法正确的是( )。
A.可用25ml碱式滴定管量取20.00ml KMnO4溶液;
B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸;
C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干;
D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全。
解析:碱式滴定管不能装酸性和强氧化性溶液,KMnO4为强氧化性的物质,此时量取KMnO4应该用酸式滴定管,所以A错。pH试纸测定溶液时,不能用蒸馏水湿润使用,会使测得的数值偏小,当测定气体时,pH试纸才需要先用蒸馏水润湿,所以B错。钠若磨成粉末,会使得反应速率加快,与水反应更加剧烈,不安全,D错。答案:C。
