点击广东高考对元素周期律(表)的考查
2014-03-18曾子茹衷明华
曾子茹 衷明华
(韩山师范学院化学系,广东 潮州 521041)
首先我们先来看看广东高考自2010年改革以来对元素周期表(律)考查的情况。
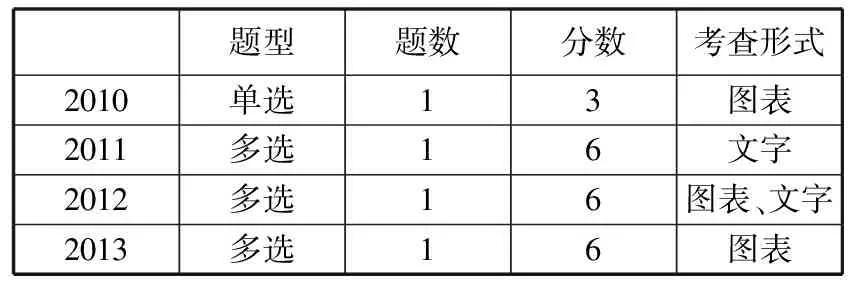
表 近四年高考题
通过分析近四年高考题,元素周期律的题型主要为选择题,考查的主要知识点为:元素推断、“位、构、性”的应用、原子半径大小的比较、元素及其化合物的性质。基本模式为"推断元素种类——推断元素性质递变规律”,因此同学们除了梳理元素递变规律的核心内容外,还要学会如何利用题干信息,快速推断元素的种类。由于本部分内容是对元素化合物知识的概括和总结,同时对元素化合物性质的学习和归纳又具有积极的指导意义,所以我们在复习本部分知识时一定要注意总结规律,找出特例,明确失分点及其产生的原因,有目的、有针对性地进行复习。
一、元素周期律(表)的考查模式
1.推断未知元素的题型与方法
(1)通过文字描述,推断未知元素
例1(2011广东化学22)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )。
A.原子半径:丙>丁>乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
分析:通过文字信息可知,甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶性呈碱性,乙位于第ⅤA族,可推知甲为氢元素,乙为氦元素,甲和丙同主族,可知丙为钠元素,丁的最外层电子数和电子层数相等,可知丁为铝元素。由元素周期律可知,同周期原子半径从左往右逐渐变小,同主族元素原子半径从上往下逐渐增大,可知丙(钠)>丁(铝)>乙(氦),A正确;单质还原性,钠强于铝,B错误;钠的氧化物为离子化合物,C错误;硝酸,氢氧化钠、氢氧化铝能互相反应,D正确。
这类题目,重点在于推断元素,在推知元素的基础上,结合元素周期律原子结构、元素性质、化合物的性质的递变规律,通常能较为轻松地解决。但如何快速推断,同学们除了要熟知1~20号元素外,同时应了解1~20号元素的常见特殊性质,以便快速找到解题突破口。
(2)通过元素周期表的片段,推断未知元素。
例2 (2013广东化学22)元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )。
A.非金属性:Z
B.R与Q的电子数相差26
C.气态氢化物稳定性:R
D.最高价氧化物的水化物的酸性:T>Q
表元素R、X、T、Z、Q在元素周期表中的相对位置
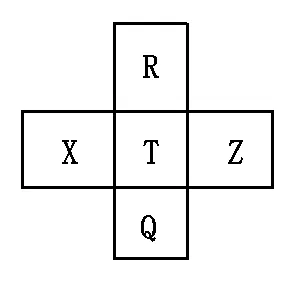
分析:由R单质在暗处与氢气剧烈化合并发生爆炸,可知R为F,由周期表的相对位置可以确定X为S、T为Cl、Z为Ar、Q为Br。非金属性氯强于硫,A错误;R的电子数为9,Q的电子数为35,35-9=26,B正确;F、Cl、Br、三种元素位于同主族,同主族元素从上到下非金属性依次减弱,氢化物的稳定性依次减弱,最高价氧化物对应的水化物酸性依次减弱,C错误,D正确。
例3(2010广东化学10)短周期金属元素甲~戊在元素周期表中的相对位置如下表所示,下面判断正确的是
A.原子半径: 丙<丁<戊 B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
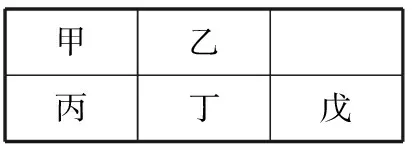
表 短周期金属元素甲~戊在元素周期表中的相对位置
分析:由周期表1~3周期特征可知,第一周期有左右两个角(氢和氦),而上表不符合第一周期的特征,因此可以快速判断该片段处于第二、第三周期。再推断C正确。
这类题型主要考查同学们对元素周期表的掌握,由元素在周期表中的位置推断元素的性质。做此类题型同学们对元素周期律应有较为熟悉的掌握。
(3)通过半径、化合价的数据推断位置元素。
例4(2012广东化学22)下图是部分周期元素化合价与原子序数的关系图,下列说法正确的是:
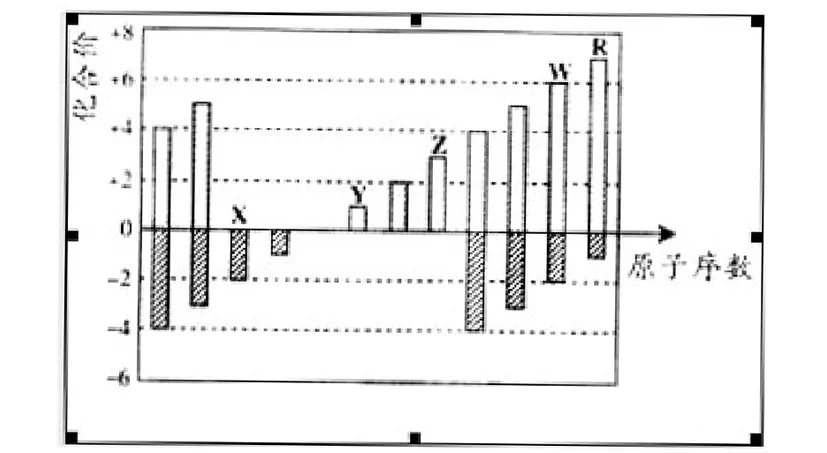
图 部分周期元素化合价与原子序数的关系
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
解析:由图可知,X为O,Y为Na,Z为Al,W为S,R为Cl。A选项应该是Y>Z>X。C选项硫酸为公价化合物,正确答案为BD。
这类题型的突破口是通过元素的最高正价或最低负价确定元素的主族序数,再通过同主族元素的半径大小判断元素所处的周期,达到确定元素种类的目的,再推断性质的规律。
二、广东高考常考点及复习要点小结
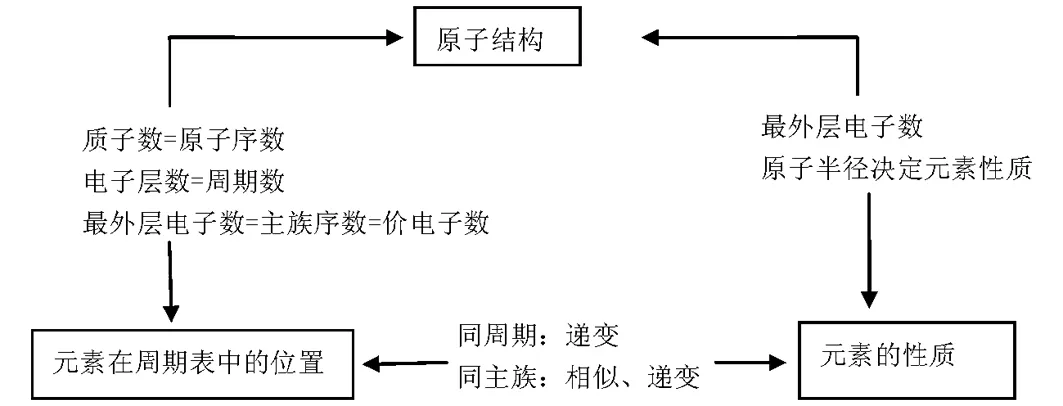
考点1:原子结构与素周期表的关系
考点解读:此考点主要考查原子构成、表示方法及核外排布。
电子层数=周期数
最外层电子数=主族序数=最高正价数=价电子数
核内质子数=原子序数
负化合价=主族序数-8
考点2:元素周期律
考点解读:此考点主要考查元素的化合价变化、原子半径或离子半径的大小、金属性与非金属性的强弱、最高价氧化物对应水化物的酸碱性的强弱、气态氢化物的稳定性等递变规律。
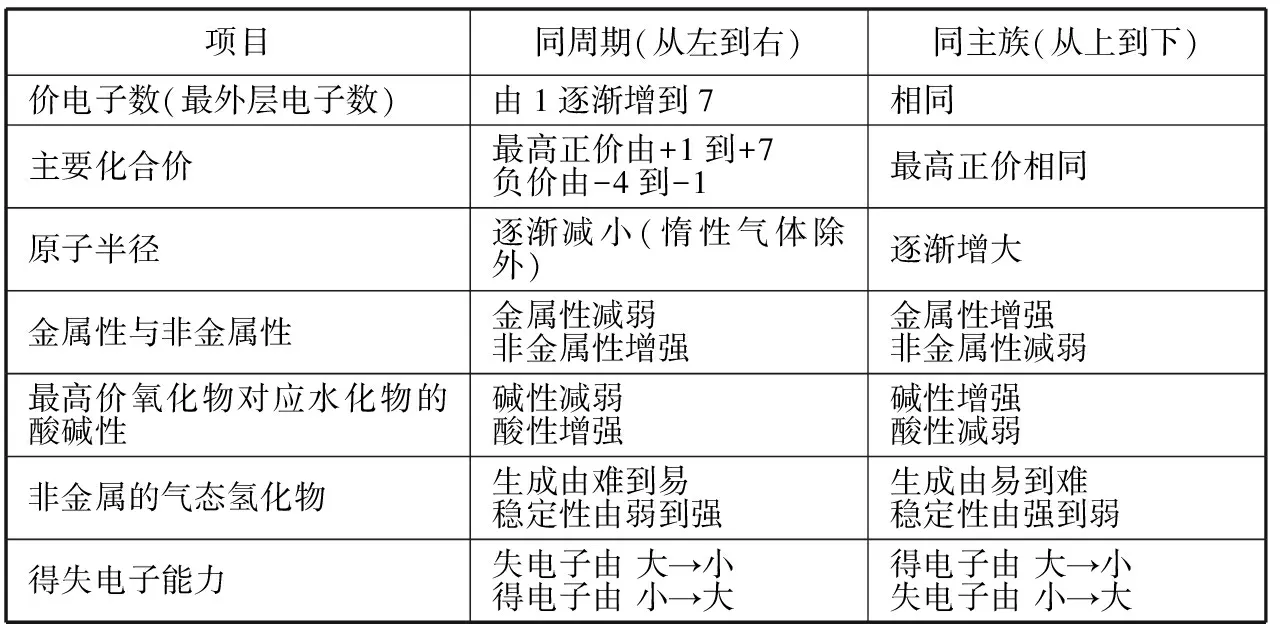
表 元素周期律
考点3:元素周期表
考点解读:此考点主要考查元素周期表的结构、主族元素、短周期元素的原子结构特点,要求能掌握短周期元素的名称、元素符号、核外电子排布、元素在周期表中的位置及确定方法,并能据此确定一些未知元素的位置。
考点4:“位、构、性”的应用
考点解读:此考点主要考查短周期元素的位置、结构、性质之间的关系。