广东高考化学“位”“构”“性”关系考点解析
2014-03-18邱莲勤衷明华
邱莲勤 衷明华
(韩山师范学院化学系,广东 潮州 521041)
一、“位”“构”“性”的关系及图表说明表
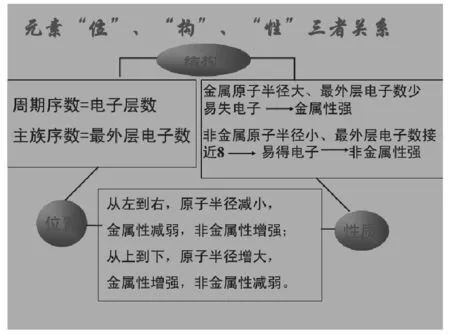
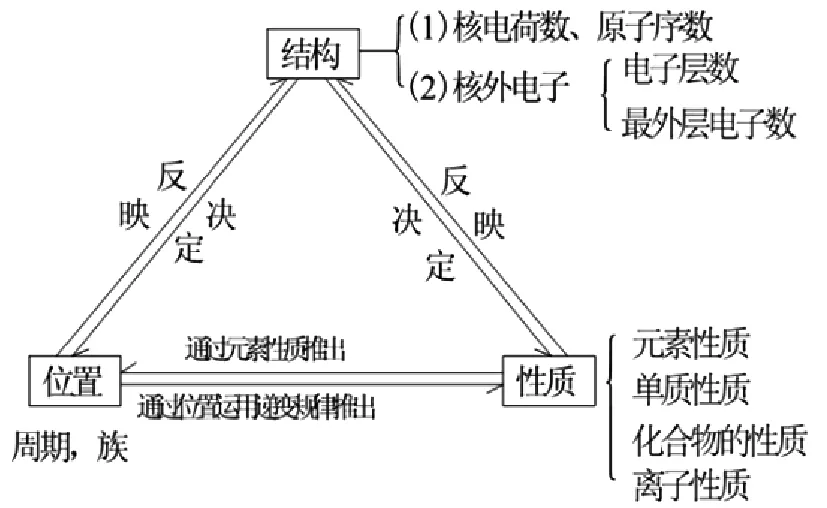
元素的原子结构,即核外电子排布,主要是电子层数和最外层电子数,决定了元素在周期表的位置,也就决定的元素及其化合物的物理性质和化学性质以及性质的递变。而元素及其化合物的物理性质和化学性质以及性质的递变,反映了元素在周期表的位置,也就反应了元素的原子结构,特别是反映了核外电子排布中的电子层数和最外层电子数的特征。一句话,就是结构决定位置和性质,位置和性质反映结构,位置决定性质,性质反映位置
二、考点点拨
物质结构,元素周期律是中学化学的基本理论之一,也是高考的必考内容之一。要求理解并熟记主族元素的原子结构,同周期、同主族元素的性质递变规律及元素周期表的结构,理解三者之间的内在联系。高考题中主要以元素推断题出现,旨在考查考生的分析推断能力。
三、主要知识点
(1)元素周期表的结构(包括各周期各族元素种数、各族左右相对顺序、各周期稀有气体元素原子序号等):主族元素原子核外电子排布的相似点和递变性;主族元素原子序数、元素符号、名称。
(2)元素周期律及其性质:同周期、同主族元素的原子半径、化合价、金属性、非金属性的递变规律。
(3)判断元素金属性、非金属性强弱的实验标志。
(4)元素周期表中一些特殊位置的元素及其有特殊性质、用途、存在的元素。
四、2010年—2013年广东高考情况
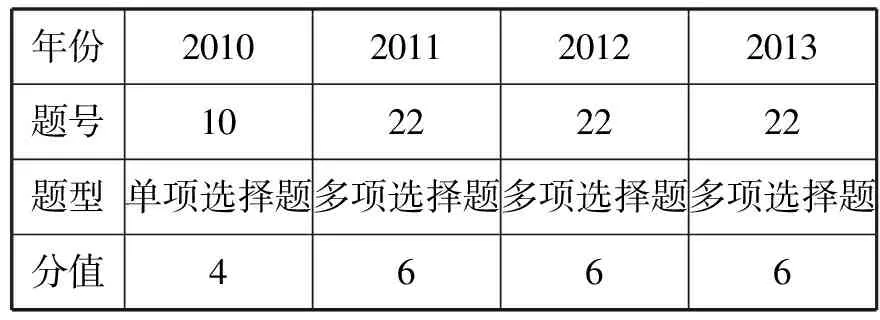
表 2010年—2013年广东高考情况
五、例题解析
1.元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )。
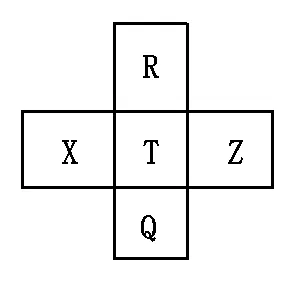
A.非金属性:Z〈T〈X
B.R与Q的电子数相差26
C.气态氢化物稳定:R〈T〈Q
D.最高价氧化物的水化物的酸性:T〉Q
答案:BD。
【解析】由R单质在暗处与H2剧烈化合并发生爆炸,可知R为F,由周期表的相对位置可以确定X为S、T为C国、Z为Ar、Q为Br。由于Z(Ar)为稀有气体,不能比较其非金属性,A错误;R的(原子序数)电子数为9,Q的(原子序数)电子数为35,35-9=26,B正确;F、Cl、Br三种元素位于同周期,同周期元素从上到下非金属性依次减弱,氢化物的稳定性依次减弱,最高价氧化物对应水化物酸性减弱,C错误、D正确。
【命题意图】元素周期律与元素周期表。考察了对元素周期表的编排的熟悉程度,是否知道每个周期的元素种类数。元素周期的递变性。
2.短周期元素甲-戊在元素周期表的相对位置如下表所示,下面判断正确的是( )。
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
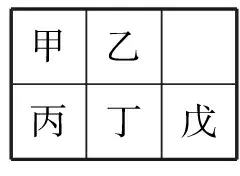
甲乙丙丁戊
解析:同周期元素原子半径是减小的,故A错;同主族元素金属性自上而下是增强的,故B错;同周期的元素的金属性越来越弱,故对应碱性也是减弱的,C正确;同周期的最外层电子数越来越多,故D错。
答案:C
3.短周期元素甲乙丙丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液成碱性,乙位于第VA
主族,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )。
A.原子半径:丙>丁>乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
解析:甲为H,乙为N,丙为Na,丁为Al。所以AD正确。C.丙的氧化物为离子化物。
4.下图是短周期元素化合价与原子序数的关系图,下列说法正确的是( )。
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
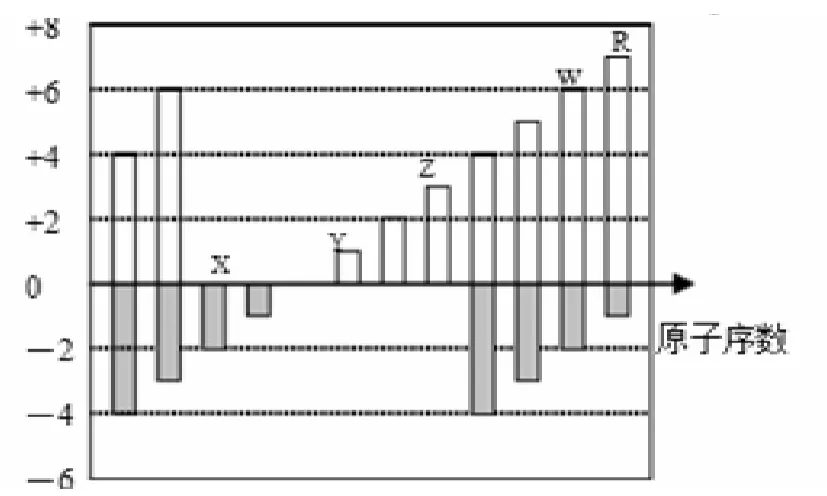
答案:BD。
解析:从图可知,X为O,Y为Na,Z为Al,W为S,R为Cl。A.应该是Y〉Z〉X〉;C.硫酸为共价化合物。
