盘点离子共存规律,解析高考真题
2014-03-18陈泽玲衷明华
陈泽玲 衷明华
(韩山师范学院化学系,广东 潮州 521041)
一、“一色”
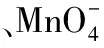
例1.某无色透明的溶液中,下列各组离子能大量共存的是( )。
C.K+、OH-、Cl-、Na+

二、“二性”
二性,即指溶液的酸碱性。
1、酸性。常见的叙述有强酸性溶液、pH=1的溶液、能使pH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液等。


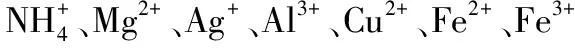
例2.在酸性溶液中能大量共存且形成无色透明溶液的一组物质是( )。
A.Na2CO3、NaCl、NaOH
B.FeCl3、KNO3、KCl
C.Na2SO4、KCl、NaCl
D.Na2SO4、NaNO3、BaCl2

例3.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是 ( )。
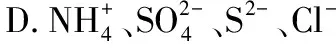
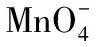
例4.下列各组离子一定能大量共存的是( )。

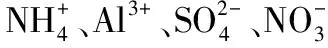
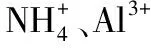
三、“三特殊”
指的是除一些普遍规律外,还有以下三种特殊情况:

例5:下列各组离子在溶液中能大量共存的是( )。
四、“四反应”
若离子间能发生下列四种反应中的任一种,则均不能共存。
(1)发生复分解反应
离子相互直接结合生成难溶物(如AgCl、AgBr、BaSO4等)、气体(如NH3、CO2等)或弱电解质(如H2O、HF、H2S等)均不能大量共存于同一溶液中。
(2)发生氧化还原反应
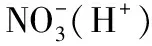
例6.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )。
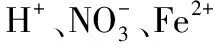
(3)发生双水解反应

(4)发生络合反应
若离子间发生络合反应生成络离子,则这些离子不能共存。如Fe3+与SCN-不共存;Ag+与NH3·H2O分子不共存;Ag+与CN-不共存。
五、“五注意”
1.审题时要注意的细节:注意题目要求“一定大量共存”、“可能大量共存”还是“不能大量共存”等。
2.审题时应注意题中给出的附加条件,如:①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃性气体的溶液、由水电离出的H+或OH-浓度为1×10-10mol/L的溶液等。注意某溶液与铝反应可以生成氢气,在该溶液中不一定存在与H+或者OH-可以共存的离子。
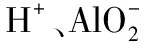
4.常温下,某溶液中由水电离出的H+为0.01mol/L,则该溶液可能是pH=2或者pH=12的溶液。该溶液为酸性或碱性,有H+或者OH-。
六、知己知彼,实战演练
例(2013重庆)在水溶液中能大量共存的一组离子是( )。
答案:A。
例(2013广东)水溶液中能大量共存的一组离子是( )。
答案:C。
例(2013江苏)常温下,下列各组离子在指定溶液中一定能大量共存的是( )。

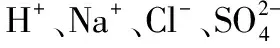
答案:A。
