浅析高考电化学之基础知识及解题技巧
2014-03-18朱杰鹏衷明华
朱杰鹏 衷明华
(韩山师范学院化学系,广东 潮州 521041)
电化学与信息时代息息相关,翻阅了近几年的高考卷,我们可以了解到电化学的相关知识点是极其重要的。但是,在目前看来,仍有很多考生将电化学题划为是失分题。这使我很纳闷,所以我借此机会来分析一下电化学的所有内容,希望看完后,考生们能有所收获。
首先,大脑要先储备金属活动顺序表中的金属排列顺序及离子排序及金属由位置的不同所拥有的性质和氧化还原反应;其次,要理解原电池与电解池的不同(有电池相连的是电解池,无电池相连的是原电池);再者,应理解电池的得失电子情况,具体表现为:原电池中正极得电子负极失电子;电解池中阳极失电子,阴极得电子。继而,应理解电子的移动情况:电解池中阳阴、阴阳(阳极吸引阴离子,阴极吸引阳离子);原电池中正阳负阴(正极吸引阳离子,负极吸引阴离子,最后,当读完这份刊物后,要懂得独立书写各类电化学方程式。
一、常见考点归纳
1.原电池的构成条件;
2.原电池和电解池的电子转移问题;
3.电极产物的判断,溶液浓度的变化或酸碱性的变化;
4.电化学方程式的书写;
5.原电池原理的应用。
二、基础梳理
1.原电池的分类
1)电极为金属与金属或金属与惰性材料(如:碳棒)
[1]当金属与金属为电极或者金属与惰性材料时,较活泼的金属做负极,且该活泼金属能与电解质发生反应,此时负极是金属失电子,正极是电解质中的氧化性较高的阳离子得电子:当金属与惰性材料为电极时,情况与金属与金属情况相同。
[2]当活泼电极不跟电解质溶液发生反应时,此时该金属发生的是金属腐蚀(析氢腐蚀或吸氧腐蚀),此时负极仍是金属失电子,正极是O2得电子或H+得电子(当电解质溶液呈酸性时是H+得电子,当溶液呈碱性时是O2得电子)。
活学活用:在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )。
A.正极附近的SO42-浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
解析:锌片溶解,铜片上有氢气放出;电子由锌片流向铜片;SO42-向负极移动。
变式训练:在盛有NaCl的烧杯中放入用导线连接的铁片和铜片,请写出正极上发生的反应方程式:____。
解析:这两个电极都不会与电解质发生反应,故考虑金属腐蚀。NaCl溶液呈中性,故正极考虑O2得电子,即正极反应方程式是O2+H2O+4e-=4OH-
[3]当正极为金属,负极为某金属氧化物时(如:铅蓄电池),且负极金属失电子后形成的离子能继续与溶液形成沉淀时,此时负极为金属失电子,形成的离子再和溶液中的离子发生复分解反应。正极为某金属氧化物得电子,若形成的物质能继续跟电解质发生反应,则正极反应式为正极得电子,再发生复分解反应。下面我们以铅蓄电池为例。
[铅蓄电池]负极:铅;正极:二氧化铅;电解质溶液:硫酸溶液。
负极反应式为:Pb-2e-+SO42-=PbSO4+2H2O
正极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O
电池反应:
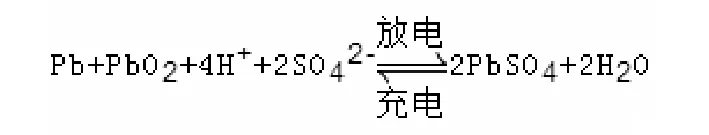
解析:正极PbO2得电子,那到底是Pb得还是O得呢?在这个化学式(PbO2)中,O是-2价,Pb是+4价,而得电子使得价态降低,故只能是Pb得电子,Pb得电子后价态降为+2价(Pb2+)会继续跟溶液中得SO42-继续发生反应生成PbSO4。而溶液中不存在O2-,且溶液呈酸性,故O2-与电解质中的H+发生反应,形成水,故正极反应式如上。
2)电极均为惰性电极且该原电池是燃料电池,则负极为该燃料失电子,正极一般为O2得电子,下面我们以例子来进行说明。
例1:H2/O2燃料电池采用海水作电解质(加入一定量的酸),下列说法不正确的是( )。
A.此燃料电池的总反应为:2H2+O2=2H2O
B.正极发生的电极反应为:
O2+4e-+4H+=2H2O
C.工作时,正极周围海水的pH下降
D.电池工作时,溶液中的H+向正极移动
答案:C
例2:在碱性介质中以CH4为燃料的燃料电池的正极反应式为2O2+4H2O+8e-=8OH-,请写出该燃料电池的负极反应方程式:____。
解析:该电池为燃料电池,故负极为燃料失电子,即CH4失电子。又电解质溶液呈碱性,故负极反应方程式为CH4+10OH--8e-=7H2O+CO32-
2.原电池原理的应用
1)比较不同金属的活动性强弱
根据原电池原理可知,在原电池反应过程中,一般活动性强的金属作负极,而活动性弱的金属(或碳棒)作正极。
2)加快反应速率
原电池可以加快化学反应速率。如锌和稀硫酸反应制取氢气时,可向溶液中滴加少量硫酸铜,形成铜-锌原电池,加快反应进行。
3.电解池
1)电解原理
[1]与外界电源正极相连—阳极—氧化反应(失电子)—吸引阴离子。
[2]与外界电源负极相连—阴极—还原反应(得电子)—吸引阳离子。
2)两极放电顺序
[1]若阳极为活性金属(金属活动顺序表Pt之前的金属),则金属失电子,电极被溶解;若是惰性电极(Pt、Au、石墨),则溶液中阴离子失电子,阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根离子>F-。
[2]在阴极,阳离子放电,顺序与金属活动性顺序表相反:
3)以惰性电极电解电解质溶液的类型
电解水型:含氧酸(如H2SO4)、强碱(如NaOH)、活泼金属含氧酸盐(如KNO3、Na2SO4)。
分解电解质型:无氧酸(如HCl),除HF外、不活泼金属的无氧酸盐(如CuCl2),除氟化物外。
放氢生碱型:活泼金属的无氧酸盐(如NaCl)。
放氧生酸型:不活泼金属的含氧酸盐(如CuSO4)。
综上可知,若想让电解质复原,只需加入电解后从溶液中出来的物质(气体和沉淀)即可,如电解H2SO4溶液,从溶液中出来的是H2和O2,相当于电解水,故只需往溶液中加入适当的水(具体多少得算)。
4.电解原理的应用
1)电解饱和食盐水
阳极反应式:2Cl--2e-=Cl2↑
阴极反应式:2H++2e-=H2↑
总反应式:2NaCl+2H2O=Cl2↑+H2↑+2NaCl
应用:氯碱工业制Cl2、H2和NaCl。
2)电镀或电解精炼铜
[1]待镀金属或精铜作阴极;镀层金属或粗铜作阳极。
[2]电极反应:
阳极:Cu-2e-=Cu2+
阴极:Cu2++2e-=Cu
3)冶炼金属(以冶炼Na为例)
[1]电极反应:
阳极:2Cl—2e-=Cl2↑
阴极:2Na++2e-=2Na
[2]总反应式:2NaCl(熔融)=电解=2Na+Cl2↑
应用:冶炼钠、镁、铝等活泼金属。
前面我们讲了金属会发生腐蚀,那么,学了1~4的内容后,我们现在来说一下怎么进行金属的保护(防护)。
5.金属的防护
1)加防护层,如涂油漆、覆盖陶瓷、电镀、金属钝化等。
2)改变金属的内部结构,如将普通钢制成不锈钢。
3)电化学保护法。
①牺牲阳极的正极(阴极)保护法——利用原电池原理,正极被保护。如在被保护的钢铁设备上装上若干较活泼的金属如锌,让在被保护的金属作原电池的正极。
②外加电源的阴极保护法——利用电解池原理,阴极被保护。如用被保护的钢铁设备作阴极,惰性电极作阳极,外接直流电源。
关于电化学的知识点大致就这些了,面对其他题型,只要上面的知识点学透了,电化学的题就是送分题。接下来,我来提炼近几年的高考题让你巩固一下。
例(2014年广东高考)11.某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其它均为Cu,则( )。
A电流方向:电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-=Cu
答案:A;解析:略。

图 电化学装置
例(2013年广东高考)33.能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。

图 原电池的装置示意图
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);
铜片,铁片,锌片和导线。
①完成原电池的装置示意图,并作相应标注。要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极____。
③甲乙两种原电池中可更有效地将化学能转化为电能的是____,其原因是____。
④根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在材料中应选____作阳极。
解析:由题给试剂,结合原电池的形成条件可知可以组合的原电池可以是:锌铜、锌铁、铁铜原电池。由图示所给电子移动方向可知左边为负极(活泼金属)、右边为正极(不活泼金属),则组装的原电池可以如下:

图 组装的原电池
由所给的电极材料可知,当铜片做电极时,铜片一定是正极,则负极是活泼的金属(失电子发生氧化反应),反应的现象是电极逐渐溶解。以Zn和Cu做电极为例,如果不用盐桥则Zn与CuSO4反应,置换出的Cu附着在Zn表面,阻碍了Zn与CuSO4的接触,不能提供稳定电流。根据牺牲阳极的阴极保护法,可知被保护的金属作阴极,即Zn作为阳极。
答案:(装置图如下);电极逐渐溶解;甲;可以避免活泼金属如Zn和CuSO4的接触,从而提供稳定电流;Zn。

图 原电池的装置示意图
例(2011广东高考)12.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )。
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动

图 化学原理装置
解析:A.发生置换反应,正确。B.形成原电池,铜片作正极,溶液中Cu2+先放电,正确;铁片作负极失去电子形成Fe2+,溶液从蓝色逐渐变成浅绿色,所以C正确。D.a和b分别连接直流电源正、负极,a作阳极,铜片失去电子形成为Cu2+。Cu2+向铁电极移动。错误。
例(2011年广东高考)32(4)镀铝电解池中,金属铝为____极,熔融盐电镀中铝元素和氯元素主要以AlCl4―和Al2Cl7―形式存在,铝电极的主要电极反应式为____。
例(2011年广东高考)32(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是:____。
答案:(4)阳极;阳极:Al-3e-=Al3+
阴极:4Al2Cl7―+3e-=7AlCl4―+Al。
(5)铝在空气中易形成一层极薄的致密而坚固的氧化膜,它能阻止氧化深入内部,起到防腐保护作用。
从上面几个高考电化学题来看,高考题其实并不难,只要掌握了上面的知识点,高考电化学就没什么可怕的。
