补肾固冲方逆转Th1/Th2 亚群失衡治疗URSA 作用与机制研究①
2014-03-18赖楠楠王东梅郭钰琪姚成芳张洪海
彭 莉 赖楠楠 王东梅 郭 菲 王 丽 郭钰琪 姚成芳 张洪海 李 霞
(山东省医学科学院基础医学研究所,济南大学山东省医学科学院医学与生命科学学院,山东省肿瘤医院,济南 250117)
复发性自然流产(RSA)是自然流产连续发生2次或2 次以上,其发病率约为妊娠总数的0.5%~1.0%[1]。RSA 发病原因复杂,除内分泌因素、解剖因素、染色体因素外,约40%~80%病因不明,称为原因不明性复发性自然流产(URSA)[2]。URSA 严重危害育龄妇女生殖健康,且患者再次发生流产概率随既往流产次数增加而升高。随着生殖免疫学研究的不断深入,母胎免疫耐受机制在URSA 发病中的作用日益受到关注[3]。妊娠犹如成功的同种异体移植,母胎免疫耐受在其中发挥着重要作用。T淋巴细胞是机体免疫调节的主体,在诱导与维持母胎免疫耐受中扮演着重要角色,其亚群失衡在妊娠相关疾病中作用日益受到关注[4]。目前URSA 治疗主要采用非特异性免疫抑制剂、免疫细胞转输等方法,但存在疗效不稳定、副作用大、价格昂贵等缺点。中医药毒副作用小、安全有效,治疗URSA 有着独特优势。补肾固冲方(BSGCF)是临床治疗URSA 的有效方剂,但其治疗靶点与作用机制尚未明确。本研究观察补肾固冲方治疗前后URSA 患者Th1/Th2 亚群分化状态,并分析其疗效相关性,进一步揭示URSA 的免疫学发病机理,阐释补肾固冲方逆转Th1/Th2 亚群失衡治疗本病的作用与分子机制,为精确指导临床治疗提供实验依据。
1 材料与方法
1.1 研究对象 入选标准:URSA 诊断依据[5]:(1)患者有2 次或2 次以上自然流产史,无活产史;(2)夫妇双方和(或)胚胎染色体正常,无家族遗传病及近亲结婚史;(3)妇检白带检查、超声检查和(或)子宫输卵管造影等检查排除患者器质性病变、生殖器官解剖畸形及感染性因素;(4)月经周期正常,基础体温双相,超声监测排卵正常;(5)男方精液分析正常;(6)性激素、甲状腺功能、血糖、胰岛素等内分泌检查均正常;(7)自身抗体如抗核抗体、抗心磷脂抗体、抗甲状腺抗体、抗2-糖蛋白Ⅰ抗体检查均呈阴性;(8)血栓前状态有关的检查,包括D-二聚体、纤维蛋白(原)降解产物、血凝系列、全血分析均正常;(9)Torch 系列IgM 均阴性;(10)以往未进行过主动免疫治疗。正常对照纳入标准:妊娠12 周以内正常妊娠查体妇女,年龄<40 岁;既往无自然流产、死胎、死产史,无遗传、解剖、内分泌方面异常,无感染、自身免疫性疾病史;本次妊娠期间无阴道流血、腹痛等先兆流产症状和体征;超声证实胚胎发育正常,有心管搏动。
所有病例为2013 年1 月至12 月在山东中医药大学附属医院妇产科门诊及病房就诊的30 例URSA 患者,年龄<40 岁,平均(26.7±3.2)岁,孕周约(7.5±1.6)周;选择同期就诊于我院妇科查体的正常早孕妇女30 例作为正常对照组,平均(25.7±3.4)岁,孕周约(7.2±1.5)周;两组的年龄与孕周均无统计学差异(P >0.05),具有可比性。
1.2 研究药物 补肾固冲方,由菟丝子(Semen Cuscutae Chinensis)、桑寄生(Herba Taxilli)、阿胶(Colla Corii Asini)、陈皮(Pericarpium Citri Reticulatae)、杜仲(Eucommia ulmoides)、黄芩(Scutellaria baicalensis Georgi)、白术(Atractylodes macrocephala Koidz)、甘草(liquorice root),按照5∶5∶4∶4∶3∶3∶2∶2比例组成,常规法水煎、醇沉,回收乙醇,浓缩药物浓度为1.95 g/ml,灭菌后真空包装,4℃保存。
1.3 方法
1.3.1 服药方法 URSA 组患者早晚各服用补肾固冲方提取液20 ml,连服14 d;正常对照组不服药。
1.3.2 标本收集与保存 抽取正常妊娠组、实验组治疗前及末次服药次日患者外周静脉血5 ml,EDTA-2Na 抗凝,密度梯度离心法分离外周血单个核细胞,分别用于流式抗体标记及RT-PCR 检测。
1.3.3 标本检测
1.3.3.1 主要试剂 大鼠抗人荧光抗体:FITCCD4、PE-IL-IFN-γ、PE-IL-4 均购自美国BD Pharmigen 公司,M-MLV 购于MBI 公司,RNA 酶抑制剂购于BioBasic 公司,GIT、DEPC、Agarose 为AMRESCO公司产品;氯仿、异丙醇、无水乙醇均购于天津广成化学试剂有限公司。内参照β-肌动蛋白(β-actin)、T-bet、GATA-3 引物由上海博尚生物技术有限公司合成,引物序列见表1。
1.3.3.2 流式抗体标记与检测 收集外周血单个核细胞,调整细胞浓度为1 ×106个/ml,加入佛波酯30 μg/L、离子霉素(Ionomycin)1 mg/L、莫能霉素(Monensin)1.7 μg/L,37 ℃,5% CO2孵育4 h。收集细胞,1 ×PBS 洗2 遍,去上清,加入大鼠血清,室温避光孵育30 min。将外标抗体FITC-CD4 按说明书加入到细胞悬液中,4℃避光孵育30 min;1 ×PBS洗2 遍,去上清;BD 固定穿膜试剂盒固定穿膜(按说明书操作),加入内标抗体(PE-IFN-γ、PE-IL-4),4℃避光孵育30 min;穿膜缓冲液洗2 次,去上清,PBS 重悬细胞,转管,上机检测。Winmidin 2.9 分析Th1(CD4+IFN-γ+)及Th2(CD4+IL-4+)亚群比例。
1.3.3.3 RT-PCR 检测 RNA 提取:采用异硫氰酸胍一步法提取子宫组织单个核细胞总mRNA,紫外分光光度仪检测D260/D280 比值,验证RNA 浓度和纯度。RT 反应:采用oligo dT 为RT 反应引物,取2.5 μg 总RNA 按RT 试剂盒说明书逆转录合成cDNA 20 μl;PCR 反应:总反应体系为25 μl,包含RT产物5 μl,10 ×PCR buffer 2.5 μl,25 mmol/L MgCl22 μl,上、下游引物各0.25 μl(25 pmol/L),10 mmol/L dNTP 0.5 μl,Taq DNA 聚合酶0.5 μl,DEPC 水14 μl。反应条件为95 ℃预变性5 min,94℃1 min,58℃~60 ℃1 min,72 ℃1 min,26 个循环后,70 ℃延长10 min。1.5 %凝胶(EB 染色)水平电泳,采用Alpha 凝胶成像系统分析图像:以β-actin 为内参照,计算目的基因与同步β-actin 灰度值比值作为相对表达量。
1.3.3.4 治疗后子宫出血天数 记录URSA 患者从服药第1 天至子宫出血完全停止的天数。
1.3.3.5 观察指标 (1)Th1(CD4+IFN-γ+)亚群占CD4+细胞百分比,Th2(IL-4+CD4+)亚群占CD4+细胞百分比。(2)Th1 亚群特异性核转录因子T-bet 及Th2 亚群特异性核转录因子GATA-3 mRNA转录水平。
1.4 统计学分析 应用SPSS21 软件进行分析,计量资料以±s 表示。采用One Way-ANOVA 方差分析,两组间比较采用Turkey 法检验,数据间相关性用Pearson 相关性分析,相关系数(r 值)为正,表示正相关,r 值为负,表示负相关。各组数据P <0.05为差异有统计学意义。
2 结果
2.1 补肾固冲方对URSA 患者Th1 亚群比例的影响 流式细胞术胞内外因子检测显示,URSA 患者治疗前Th1 亚群比例明显高于正常妊娠组,提示Th1 亚群比例升高可能在URSA 的发病中扮演了重要角色。补肾固冲方治疗后,URSA 患者Th1 亚群比例明显降低,与治疗前比较有显著性差异(P <0.05),提示补肾固冲方通过下调Th1 亚群比例治疗URSA,见图1。
2.2 补肾固冲方对URSA 患者Th2 亚群比例的影响 流式细胞术胞内外因子检测显示,URSA 患者治疗前Th2 亚群比例显著低于正常妊娠组,提示Th2 亚群比例降低可能是URSA 发病机制之一。补肾固冲方治疗后,URSA 患者示Th2 亚群比例明显升高,与治疗前比较有显著性差异(P <0.05),提示上调Th2 亚群比例可能是补肾固冲方治疗URSA 的机制之一,见图2。

表1 PCR 引物序列及产物长度Tab.1 RT-PCR primer sequences and products length

图1 外周血Th1 亚群比例比较Fig.1 Comparison of Th1 proportion in peripheral blood
2.3 补肾固冲方对Th1/Th2 亚群比率的影响 结果显示,URSA 患者Th1/Th2 亚群比率明显高于正常妊娠组(P <0.05),提示Th1/Th2 亚群偏移是导致URSA 发病的机制之一。补肾固冲方治疗后,URSA 患者Th1/Th2 亚群比率明显降低,与治疗前比较有显著性差异(P <0.05),与正常妊娠组比较无明显差异(P >0.05),提示补肾固冲方能优势诱导模式向Th2 亚群偏移,逆转URSA 患者Th1/Th2失衡状态,进而治疗URSA。
2.4 治疗后子宫出血天数与Th1、Th2 亚群相关性分析 补肾固冲方治疗后,URSA 患者子宫出血均停止,随访均足月分娩。Pearson 相关性分析显示,URSA 患者服用补肾固冲方治疗后子宫出血停止时间与Th1、Th2 比例及Th1/Th2 亚群比率呈显著相关性,其中子宫出血天数与Th1 亚群比例呈显著正相关(r=0.521,P <0.05),与Th2 亚群比例呈负相关(r=-0.213,P >0.05),与Th1/Th2 亚群比率呈正相关(r=0.560,P >0.05),见图4。
2.5 补肾固冲方对URSA 患者T-bet mRNA、GATA-3mRNA 转录水平的影响 RT-PCR 结果显示,与正常妊娠组比较,URSA 患者治疗前外周血Th1 亚群特异性和转录因子T-bet mRNA 转录水平明显升高(P <0.05),Th2 亚群特异性和转录因子GATA-3 mRNA 转录水平明显降低(P <0.05)。补肾固冲方治疗后,URSA 患者T-bet mRNA 表达明显降低,GATA-3 mRNA 表达明显升高,与正常妊娠组比较无明显差异(P >0.05),提示调节Th1、Th2 亚群特异性核转录因子转录水平是补肾固冲方逆转URSA患者Th1/Th2 亚群失衡的机制之一。

图2 外周血Th2 亚群比例比较Fig.2 Comparison of Th2 proportion in peripheral blood
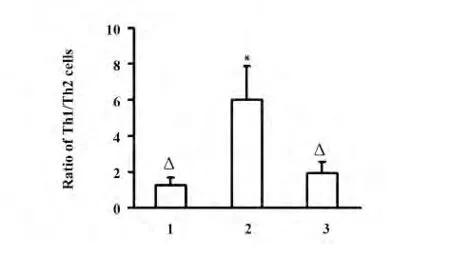
图3 外周血Th1/Th2 亚群比率比较Fig.3 Comparison of ratio of Th1/Th2 cells in peripheral blood

图4 治疗后子宫出血天数与Th1、Th2、Th1/Th2 亚群相关性分析Fig.4 Correlation between uterine bleeding duration and Th1,Th2 and Th1/Th2 subsets
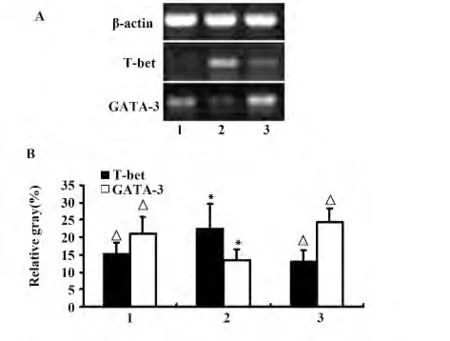
图5 外周血T-bet、GATA-3 mRNA 表达比较Fig.5 Expression of T-bet and GATA-3 mRNA in peripheral blood
3 讨论
胚胎携带父方的MHC 单元型,相对于母体犹如成功的半同种异体移植,母胎免疫耐受机制在其中发挥着重要的作用[6]。T 细胞是免疫调节的主体,初始T 细胞遇抗原刺激后在特异性核转录因子与分化诱导因子作用下分化为不同亚群,分泌特征性细胞因子,主导不同的免疫反应[7]。Th1、Th2 是经典的T 细胞亚群,Th1 细胞特征性地分泌白介素-2(IL-2)、干扰素γ(IFN-γ)和肿瘤坏死因子α(TNF-α)等细胞因子,主要介导细胞免疫,在母胎免疫排斥中发挥着重要作用[8];Th2 细胞特征性地分泌IL-4、IL-5 和IL-10 等细胞因子,主要介导体液免疫,在母胎免疫耐受的建立与维持过程中扮演了重要角色[9]。正常妊娠中Th1/Th2 平衡向Th2 亚群漂移,有利于形成与维持正常的母胎免疫耐受状态[10]。研究已证实Th1 型细胞因子表达升高及Th2 型细胞因子表达降低与妊娠丢失密切相关[11],我们的前期研究亦证实药物流产过程中存在Th1/Th2 亚群向Th1 偏移现象[12,13]。本研究结果显示URSA 患者Th1 亚群比例明显高于正常妊娠,Th2 亚群比例明显低于正常妊娠,Th1/Th2 比率明显升高,进一步证实Th1/Th2 亚群失衡参与了URSA 的发生。
目前,URSA 治疗主要采用非特异性免疫抑制剂、免疫细胞转输等方法,但存在疗效不稳定、副作用大、价格昂贵等缺点[14]。中医药具有毒副作用小、安全有效的优点,因此成为URSA 治疗研究的热点。URSA 属中医学“滑胎”范畴,亦称“数堕胎”。中医认为“肾主生殖”,《素问·奇病论》指出:“胞络者,系于肾”,《女科经纶·引女科集略》说:“女之肾脉系于胎,是母之真气,子之所赖也,若肾气亏损,便不能固摄胎元”。肾藏精,为先天之本、天癸之源、冲任气血之根,是促使与维持女性生殖功能的主导。若先天禀赋不足,肾气未充,或因孕后房事不节,纵欲所伤,以致肾气亏虚,冲任损伤,胎失所系,而致屡孕屡堕。因此,肾虚冲任不固是URSA 的主要病机,补肾固冲是本病基本治疗原则。补肾固冲方根据补肾固冲安胎原则组方,方中菟丝子、桑寄生补肾固冲,为君药;阿胶养血止血,陈皮、杜仲健脾补肾,为臣药;黄芩、白术清热安胎,为佐;甘草调和诸药,为使;诸药合用,共奏补肾固冲、养血安胎之功效。
本研究显示,补肾固冲方治疗后,URSA 患者Th1亚群比例显著降低,Th2 亚群比例显著升高,提示逆转Th1/Th2 亚群偏移是补肾固冲方治疗URSA 的作用靶点之一。相关性分析显示,补肾固冲方治疗后,子宫出血天数与Th1 亚群比例呈显著正相关,与Th2亚群比例呈负相关,与Th1/Th2 亚群比例呈正相关,进一步证实补肾固冲方通过逆转Th1/Th2 亚群失衡介导母胎免疫耐受,进而发挥治疗URSA 的作用。初始T 细胞受到抗原刺激后,在分化诱导因子及特异性核转录因子作用下分化为Th1/Th2 亚群,T-bet 和GATA-3 分别是Th1、Th2 亚群的特异性核转录因子,在其亚群分化过程中发挥着重要作用[15]。本研究发现,补肾固冲方能显著下调URSA 患者Th1 亚群特异性核转录因子T-bet 转录水平,同时上调Th2 亚群特异性核转录因子GATA-3 转录水平,进而优势诱导T细胞向Th2 亚群偏移,逆转URSA 患者Th1/Th2 亚群失衡状态,介导母胎免疫耐受。
本研究结果进一步证实了Th1/Th2 亚群失衡在URSA 发病中的作用,阐释了药物靶向逆转Th1/Th2 亚群失衡治疗URSA 的作用与分子机制,为精确指导临床治疗及创新药物研发提供了实验依据。然而,URSA 发病过程中T 细胞亚群失衡的始动因素尚未明确,此方面的深入探讨将进一步阐释URSA 中T 细胞亚群失衡的原因及分子机制,为临床治疗提供更加有效的靶点与途径。
[1]陈 慧,陈立斌,宋小侠,等.URSA 患者外周血免疫细胞特征及其意义的临床研究[J].中山大学学报,2010,31(4):467-471.
[2]杜希燕.不明原因复发性自然流产病人应用淋巴细胞主动免疫的观察和护理[J].护理研究,2012,26(8):2172-2173.
[3]Gao L,Zhang JP,Chen H,et al.Characteristics of immune cell changes before and after immunotherapy and their clinical significance in patients with unexplained recurrent spontaneous abortion[J].Genet Mol Res,2014,13(1):1169-1178.
[4]常淑华,宋俏蔚,周 璐,等.安胎灵治疗脾肾亏虚型反复性流产的临床研究[J].中国中医药科技,2010,17(5):383-384.
[5]刘长明,丛 林,方慧琴,等.Treg 和Th17 在原因不明性复发性流产发病中作用的探讨[J].现代妇产科进展,2011,20(12):944-947.
[6]范登轩,金莉萍,李大金.T 细胞抗原受体γδT 细胞与母胎免疫耐受[J].国际生殖健康/计划生育杂志,2010,29(6):457-460.
[7]李 霞,王永红,王 丽,等.宫清颗粒诱导Th17/Treg 亚群偏移减轻药物流产后子宫出血[J].中国新药与临床杂志,2012,31(8):462-468.
[8]Takeshita A,Kusakabe KT,Hiyama M,et al.Dynamics and reproductive effects of complement factors in the spontaneous abortion model of CBA/J × DBA/2 mice[J].Immunobiology,2014,219(5):385-91.
[9]毛立群,杨 鹏,闫燕华,等.复发性流产患者外周血T 淋巴细胞亚群及CD4+辅助性T 淋巴细胞亚型的变化[J].中华妇产科杂志,2000,35(12):722-723.
[10]罗蕊丽,赵亚娟.树突细胞与妊娠免疫耐受的研究进展[J].医学综述,2011,28(1):3705-3707.
[11]樊 伟,李尚为,刘西茹.干预协同刺激信号对反复自然流产患者Th1/Th2 转换影响的体外研究[J].四川大学学报(医学版),2006,37(5):773-775.
[12]Li X,Zhang M,Wang B,et al.Shenghua Decoction reduces uterine bleeding and regulates T-cell Paradigm in human deciduas of RU486 medical abortion[J].J Ethnopharmacol,2013,150(3):907-917.
[13]Li X,Wang B,Li Y,et al.The Th1/Th2/Th17/Treg paradigm induced by stachydrine hydrochloride reduces uterine bleeding in RU486-induced abortion mice[J].J Ethnopharmacol,2013,145(1):241-253.
[14]邓 云,丁 惠.复发性自然流产的病因及治疗现状[J].东南国防医药,2013,15(2):167-169.
[15]丁 艳,尹 薇,蔡 萍,等.巨细胞病毒感染婴儿Th1/Th2细胞分化及转录因子T-bet/ GATA-3 的表达[J].中华微生物学和免疫学杂志,2009,29(11):1002-1003.
