三角帆蚌热休克蛋白60基因克隆及其表达分析
2014-03-17吴圣楠刘大伟刘毅胡宝庆张建强王艳王
吴圣楠刘大伟刘 毅胡宝庆张建强王 艳王 婷
(1. 江西师范大学生命科学学院, 南昌 330022; 2. 南昌大学生命科学与食品工程学院, 南昌 330031)
三角帆蚌热休克蛋白60基因克隆及其表达分析
吴圣楠1刘大伟2刘 毅1胡宝庆2张建强1王 艳1王 婷1
(1. 江西师范大学生命科学学院, 南昌 330022; 2. 南昌大学生命科学与食品工程学院, 南昌 330031)
利用3′RACE技术, 对高通量转录组测序所得三角帆蚌HSP60基因(hcHSP60)长片段(2629 bp)进行了3′末端克隆, 经拼接得到hcHSP60 cDNA全长序列。采用多种分子生物学软件对hcHSP60 cDNA全长序列进行了特征分析, 并采用 RT-PCR技术检测了其组织分布及经冷热应激后的表达变化。结果显示, hcHSP60 cDNA全长为2807 bp, 其中开放阅读框为1707 bp, 编码568个氨基酸, 预测分子量大小为61.04 ku, pH 7.0时的理论等电点为5.63。序列中不存在信号肽与跨膜结构。氨基酸序列保守性分析表明, hcHSP60氨基酸序列与光滑双脐螺HSP60同源性最高(达82%), 而与牙鲆、白云金丝鱼HSP60的同源性最低(为75%)。RT-PCR检测结果表明, hcHSP60在肝胰腺中的表达水平最高, 而在血液中的表达水平最低。30℃与35℃水温处理三角帆蚌4h后, 各组织中hcHSP60表达水平明显上升, 表明hcHSP60可能在三角帆蚌耐热应激反应中起着重要作用。
三角帆蚌; 热休克蛋白60; 序列分析; 表达
热休克蛋白(Heat shock proteins, HSPs)是生物体在受到物理或化学刺激时发生应激反应所产生的一类蛋白质, 又名应激蛋白。根据分子量的不同, 可以将HSPs分为HSP90、HSP70、HSP60及小分子量HSP等若干家族[1]。HSPs首次从热激果蝇幼虫唾液腺部位分离得到[2]。HSPs分子在正常状态下能帮助新生肽链折叠, 而在应激状态下, HSPs被大量诱导, 其分子伴侣作用变大, 当细胞受到各种刺激时,蛋白质肽链由折叠变成延伸, 空间构型也发生改变,进而与突变蛋白结合, 使后者解离, 并通过多肽折叠、复性以维持细胞自稳定, 从而防止细胞受损[3,4]。
HSP60分子是 HSPs家族中最为保守的分子伴侣蛋白, 大多数成员为组成型表达蛋白[5]。HSP60在真核生物中主要存在于线粒体中, 蛋白N-末端有一个线粒体定位序列, 能够引导HSP60进入线粒体中[6]。HSP60基因如发生突变, 会导致线粒体功能障碍[7]。HSP60在细胞生命活动中占据着非常重要的地位, 当机体处于应激状态时, HSP60被大量合成,进入循环系统, 协助变性蛋白恢复其天然结构[8]。迄今除了研究最多的细菌 HSP60, 还在赤点石斑鱼(Epinephelus akaara)[9]、三疣梭子蟹(Portunus trituberculatus)[10]、草鱼(Ctenopharyn odon idellus)[11]、凡纳宾对虾(Litopenaeus vannamei)[12]等物种中克隆出HSP60全长序列, 并对它们的基因结构、功能和组织表达进行了研究, 而针对软体动物HSP60的研究则尚不多见。
三角帆蚌(Hyriopsis cumingii)是我国特有的淡水育珠蚌, 用其培育的珍珠质量上佳, 近年淡水育珠蚌培育珍珠开始发展[13]。但日益严重的病害给我国淡水育珠产业造成了重大经济损失。HSPs是生物体内的重要抗感染和抗逆蛋白分子, 对三角帆蚌HSPs的深入研究有助于我国淡水育珠产业的健康发展。本研究利用 3′RACE技术, 对高通量转录组测序所得三角帆蚌 HSP60基因(hcHSP60)长片段(2629 bp)进行了3′末端克隆, 经拼接得到hcHSP60 cDNA全长序列, 采用多种分子生物学软件对其进行特征分析, 并采用 RT-PCR技术检测了其在多种组织中的表达分布及在冷热应激后的变化情况。
1 材料与方法
1.1 材料
本研究所用三角帆蚌购自南昌市人民公园菜市场, 体长约10—15 cm。购回实验室后, 立即用自来水将蚌壳上的淤泥仔细刷洗干净, 置于盛有曝气自来水的水族箱(100 cm×60 cm×45 cm)中暂养, 箱中水量不宜过多, 以刚刚淹没蚌体为佳。每天用曝气自来水换水1至2次, 充气泵充气饲养, 暂养1周确认蚌体健康无病之后方开始实验。
1.2 核酸提取与cDNA模板合成
采用 Invitrogen公司的 Trizol试剂盒提取总RNA, 操作过程中(包括组织总 RNA提取以及应用RNA的所有相关实验)所用离心管及枪头都经1 g/L焦碳酸二乙酯(Diethylpryocarbonate, DEPC)水处理过夜, 琉璃器皿及金属器械经180℃高温烘烤6h以上使RNase彻底失活。RNA的具体提取参考试剂盒的说明书进行。cDNA合成按SMART cDNA Synthesis Kit操作手册进行。
1.3 hcHSP60 cDNA全长获得
始自 hcHSP60 cDNA 5′末端的 1条长段序列(2629 bp)由转录组高通量测序结果获得, 转录组测序工作由北京贝瑞和康生物技术有限公司完成。依据此序列, 采用Clontech公司的SMARTer™ RACE cDNA Amplification Kit试剂盒获得该基因的3′端序列。扩增时共设计2条引物: HSP60-F1与HSP60-F2。首先使用逆转录酶 SMARTScribe™ Reverse Transcriptase和引物3′ CDS primer A 对总RNA进行逆转录合成 cDNA, 再使用引物 HSP60-F1和 UPM (Long引物和Short引物按1︰3比例混匀所得), 以上面合成的cDNA为模板进行第一轮PCR扩增; 将第一轮 PCR扩增产物稀释 50倍, 然后用引物HSP60- F2和 UPM进行第二轮PCR扩增, 将第二轮PCR产物进行电泳并对目的条带进行切胶回收纯化, 纯化后的PCR产物与pMD18-T进行连接, 转化后挑取阳性克隆测序, 最后进行全长序列拼接, 得到hcHSP60 cDNA全长序列。用于hcHSP60基因扩增与表达的引物见表1。
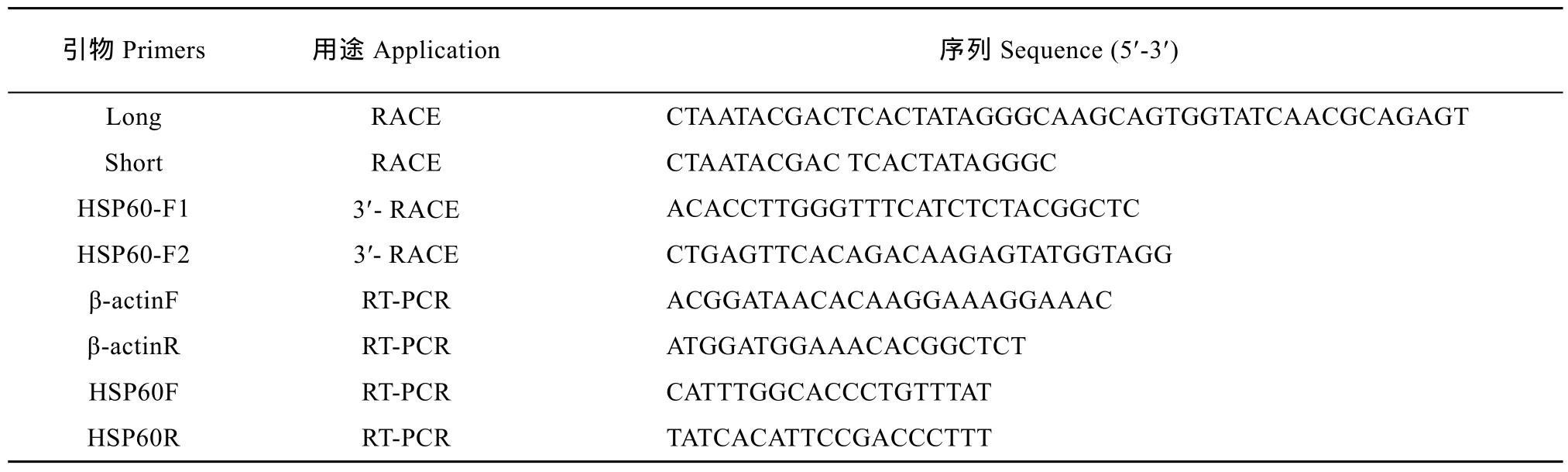
表1 hcHSP60基因扩增与表达所用引物Tab. 1 Primers used in amplification and expression of hcHSP60
1.4 hcHSP60基因序列分析与系统进化树构建
利用 ExPASy(http://expasy.pku.edu.com)上软件分析 hcHSP60氨基酸序列与开放阅读框(ORF);采用NCBI BLASTp进行序列同源基因搜索; 利用SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)预测分析信号肽, 用 TMHMM 软件预测跨膜区;利用ClustalW 1.83软件比较hcHSP60与其他物种HSP60氨基酸序列同源性; 采用 Mega 4.0软件的邻接法(N-J法)构建基于氨基酸序列的系统进化树,并采用自展法(Bootstrap Method)对其可靠性进行分析验证(1000个假重复数)。用于氨基酸比对和进化树构建的基因名称及其 GenBank序列登录号见表2。
1.5 hcHSP60在不同组织中的表达
从暂养蚌的水族箱中选取3个蚌, 取血液、鳃、肝胰腺、外套膜及肌肉等 5种组织, 用 Trizol法提取总 RNA, 用紫外分光仪(UV-5100)测定浓度并统一稀释至100 ng/μL, 各取2 μL反转录成cDNA, 利用RT-PCR法检测室温下(20 ℃)hcHSP60在三角帆蚌不同组织中的表达, 引物见表 1。PCR扩增条件: 94 ℃5min; 94 ℃ 30s, 58 ℃ 30s, 72 ℃ 90s, 40循环; 72 ℃ 10min。产物用1%琼脂糖凝胶电泳进行分析。
1.6 hcHSP60在冷热应激后的表达变化
将蚌分成7组(每组放置3个), 分别置于5℃、10℃、15℃、20℃、25℃、30℃及35℃等7种水温,放置4h后分别取其血液、鳃、肝胰腺、外套膜及肌肉等组织, Trizol法提取各组织的总 RNA, 利用RT-PCR法检测hcHSP60在不同组织中的表达变化, PCR扩增条件同1.5。
通过Quantity One软件计算目的条带和β-actin条带的光密度比值, 结果使用SPSS20.0软件中的单因素方差分析法(One-way ANOVA)进行统计分析, P<0.05为显著性差异。

表2 用于氨基酸序列比对及进化树构建的60基因登录号Tab. 2 Genes of HSP60 used for multiple alignments and construction of phylogenetic tree
2 结果
2.1 hcHSP60 cDNA全长及推导的氨基酸序列特征
以三角帆蚌血液组织总 RNA为模板, 通过 3′RACE-PCR扩增, 获得长度为178 bp扩增片段, 序列拼接获得的hcHSP60基因cDNA全长为2807 bp (GenBank登录号: KF941200), 其中5′端非翻译区69 bp, 3′端非翻译区 1031 bp, 有典型的加尾信号(AATAAA)和 PolyA尾巴。该基因开放阅读框为1707 bp, 编码 568个氨基酸, 预测分子量大小为61.04 ku, pH 7.0时的理论等电点为5.63。多重比对结果证明 hcHSP60符合 HSP60s所有特征。使用SignalP 4.0预测hcHSP60无信号肽, TMHMM预测hcHSP60无跨膜区。
2.2 序列同源性
利用Clustal X1.8和GeneDoc软件对13个物种的HSP60氨基酸序列进行了同源比对(表2)。hcHSP60氨基酸序列与光滑双脐螺(Biomphalaria glabrata) HSP60的同源性最高, 达82%; 与牙鲆(Paralichthys olivaceus)与白云金丝鱼(Tanichthys albonubes) HSP60的同源性最低, 为75%。
2.3 HSP60系统进化树
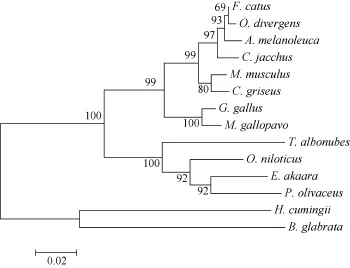
图1 HSP60系统进化树Fig. 1 Phylogenetic tree of HSP60 gene
应用Mega4.0软件按邻接法构建了HSP60系统进化树(图1)。结果显示, 所列物种分为4个分支, 其中, hcHSP60与光滑双脐螺 HSP60在一个分支上,表明在所选的物种中, hcHSP60与光滑双脐螺HSP60之间的分子进化地位最近。
2.4 hcHSP60组织表达
提取室温条件下(20 )℃ 的三角帆蚌血液、鳃、肝胰腺、外套膜及肌肉等5种组织总RNA, 经逆转录得到cDNA, 利用RT-PCR, 分别扩增得到长度为141 bp的hcHSP60片段和长度为145 bp的β-actin片段(图2)。从图4可以看出, hcHSP60在各个组织中均有表达, 以肝胰腺中的表达水平最高, 其次为肌肉、外套膜及鳃, 而在血液中的表达最低。
2.5 冷热应激后的hcHSP60表达变化
由图3可以看出, 经30℃或35℃刺激4h后, 各组织中hcHSP60的表达水平明显高于其他几种温度下的表达。其中, 血液 hcHSP60表达峰值出现于35 , ℃ 而其他4种组织中的hcHSP60表达峰值皆出现于30℃。
3 讨论
HSP60广泛存在于原核生物和真核生物中, 是HSPs家族中最为保守的司细胞保护作用之伴侣蛋白分子[5]。不同物种的HSP60基因结构非常保守, 赤点石斑鱼HSP60 基因编码578个氨基酸[7], 三疣梭子蟹的HSP60基因编码577个氨基酸[10]。本研究所克隆hcHSP60开放阅读框编码568个氨基酸, 蛋白分子量为61 ku, 等电点为5.63。氨基酸序列比对显示hcHSP60和其他物种HSP60氨基酸序列有较高的相似性, 都在70%以上, 与光滑双脐螺HSP60相似性高达82%。系统进化分析表明hcHSP60与同属软体动物的光滑双脐螺聚为一支,表明本研究所克隆的hcHSP60确为热休克蛋白60家族成员。

图2 hcHSP60在三角帆蚌不同组织中的表达Fig. 2 The expression of hcHSP60 in different tissues of H. cumingii

图3 hcHSP60基因在冷热应激后的表达Fig. 3 The expression of hcHSP60 under different water temperature
hcHSP60作为 HSP60家族中的一员, 含有HSP60家族信号位点(AAVEEGIVPGGG), 而其序列中不存在信号肽, 说明它不是分泌蛋白。依据hcHSP60含有ATP/ADP结合位点(D G V T V A K),基质结合位点(E G M K F D R G Y I S P Y), 线粒体定位序列(A A V E E G I V P G G G)等事实, 表明其作用位点也存在于细胞线粒体中[14]。hcHSP60氨基酸序列中有 1个典型的 C末端 GGM重复序列(GGMGGGM), 还有多个磷酸化位点和N-型天冬酞胺糖基化位点。有研究表明HSP60能借助上述位点激活免疫相关因子IL-8、IL-12、IL-15、B7、MLP、MZP 和NO等, 通过发动天然免疫反应来抵御细菌的入侵[15,16]。
HSP60广泛存在与各种生物体内, 而不同生物体HSP60在不同组织中的表达水平各异。赤点石斑鱼HSP60在肝、肠、鳃、头肾、胃、脑、脾中均有表达, 以脑中的表达量最高[9]。三疣梭子蟹 HSP60在肝、心、腹肌、触角腺、鳃、肠、附肢肌肉中皆有表达, 以触角腺和肠中的表达量最高[10]。而本研究则发现hcHSP60在三角帆蚌的血液、肝胰腺、鳃、外套膜及肌肉中均有表达, 而以肝胰腺中的表达水平最高。推测肝胰腺在三角帆蚌保护机体细胞及其损伤修复方面起重要作用。
HSPs是一类应激蛋白, 可通过传递自身“危险信号”, 触发免疫细胞的免疫应激反应。多种应激因子, 如重金属、细菌、热休克都能诱导HSPs的表达。褶纹冠蚌在热刺激后, 其HSP70在组织中的表达量明显提高, 以鳃组织中的表达量增加最多, 血淋巴次之, 而肌肉的表达量增加最少[17]。极端嗜热菌(Pyrococcus furiosus)能生活在98℃的高温下, 最主要的HSPs分子为HSP60及HSP20, 表明HSP60在提高细菌耐热能力方面起着重要作用[18,19]。本研究的结果表明, 在相对较高水温(30℃与 35 )℃下放置4h后, 三角帆蚌各组织中hcHSP60表达量明显升高,表明hcHSP60在抗热应激反应中起着重要作用。有研究表明, 冷应激可引起鸡肝脏HSP60表达显著增加[20]、福寿螺个别组织HSP60急剧上升[21], 而本文用较低水温(5℃、10℃及 15 )℃处理 4h后, 发现各组织中hcHSP60的表达与20℃或25℃处理组之间相比并无明显变化, 零度及零度以下水温应激能否刺激hcHSP60的表达上调, 有待于进一步的研究。
[1] Morimoto R I. Cell in stress: transcriptional activation of heat shock genes [J]. Science, 1993, 259(5100): 1409—1410
[2] Tissieres A, Mitchell H K, Tracy U M. Protein Synthesis in sailvary glands of Drosophila melanogster: Relation to chromosome puffs [J]. Journal of Molecular Biology, 1974, 84(3): 389—398
[3] Robert J. Evolution of heat shock proteins and immunity [J]. Developmental & Comparative Immunology, 2003, 27(6-7): 449—464
[4] Tsan M F, Gao B. Cytokine function of heat shock proteins [J]. American Journal of Physiology-Cell Physiology, 2004, 86(4): 739—744
[5] Hutchison E G, Tichelaar W, Hofhaus G, et al. Identification and electron microscopic analysis of a chaperonin oligomer from Neurospora crassa mitochondria [J]. The EMBO Journal, 1989, 8(5): 1485—1490
[6] Li L, Nan P, Zhai S, et al. Molecular cloning, characterization, and expression of hsp60 in caudal fin regeneration of Misgurnus anguillicaudatus [J]. Molecular and Cellular Biochemistry, 2014, 387(1-2): 143—150
[7] Deocaris C C, Kaul S C, Wadhwa R. On the brotherhood of the mitochondrial chaerones mortalin and heat shock protein 60 [J]. Cell & Stress Chaperones, 2006, 11(2): 116—128
[8] Soltys B J, Gupta R S. Immunoelectron microscopic localization of the 60~kDa heat shock chaperonin protein (HSP60) in mammalian cells [J]. Experimental Cell Research, 1996, 222(1): 16—17
[9] Qu M, Shi X F. Cloning of HSP60 gene from Epinephelus akaara and its express characterization before and after vibrionic stressed [J]. Acta Oceanologica Sinica, 2011, 33(1): 111—119 [曲朦, 施晓峰. 赤点石斑鱼HSP60 基因克隆及弧菌应激前后的组织表达特性分析. 海洋学报, 2011, 33(1): 111—119]
[10] Qin Y. Correlation research of salinity adaptivity of heat shock protein Portunus trituberculatus HSP60 and HSP90α [D]. Shanghai Ocean University, 2012 [覃烨. 三疣梭子蟹热休克蛋白HSP60和HSP90α的盐度适应相关性研究. 上海海洋大学, 2012]
[11] Xu X Y, Shen Y B. Molecular cloning, characterization and expression patterns of HSP60 in the grass carp (Ctenopharyngodon idella) [J]. Fish & Shellfish Immunology, 2011, 31(6): 864—870
[12] Zhou J, Wang W N, He W Y, et al. Expression of HSP60 and HSP70 in white shrimp, Litopenaeus vannamei in response to bacterial challenge [J]. Journal of Invertebrate Pathology, 2010, 103(3): 170—178
[13] He X J, Shi Z Y, Chen X W, et al. Effect pearl-nucleusinserting operation in visceral mass on haemocytes in Hyriopsis cumingii lea [J]. Acta Hydrobiologica Sinica, 2010, 34(2): 410—417 [何秀娟, 施志仪, 陈晓武, 等. 内脏团插核术刺激对三角帆蚌血细胞的影响.水生生物学报, 2010, 34(2): 410—417]
[14] Fenton W A, Kashi Y, et al. Residues in chaperonin GroEL required for polypeptide binding and release [J]. Nature,1994, 371: 614—619
[15] Quintana F J, Cohen I R. The HSP60 immune system network [J]. Trends in Immunology, 2011, 32(2): 89—95
[16] Tsan M F, Gao B. Heat shock proteins and immune system [J]. Journal of Leukocyte Biology, 2009, 85(6): 905—910
[17] Xie Y H, Hu B Q, Wen C G. Cloning and expression analysis of HSP70 gene from Cristaria plicata [J]. Journal of Nanchang University (Natural Science), 2011, 35(5): 457—463 [谢彦海, 胡宝庆, 文春根. 褶纹冠蚌热休克蛋白HSP70基因的克隆及表达研究. 南昌大学学报(理科版), 2011, 35(5): 457—463]
[18] Laksanalamai P, Maeder D L, Robb F T. Regulation and Mechanism of Action of the Small Heat Shock Protein from the Hyperthermophilic Archaeon Pyrococcus furiosus [J]. Journal of Bacteriology, 2001, 183(17): 5198—5202
[19] Kanai T, Takedomi S, Fujiwara S, et al. Identification of the Phr-dependent heat shock regulon in the hyperthermophilic archaeon, Thermococcus kodakaraensis [J]. Journal of Biochemistry, 2010, 147(3): 361—370
[20] Zhang Z W. Effect of cold stress on lipid metabolism and inflammatory factors in chicken liver [D]. Northeast Agricultural University, 2012 [张子威. 冷应激对鸡肝脏脂肪代谢与炎性因子的影响. 东北农业大学, 2012]
[21] Zhen G W. Molecular characteristics of HSPs genes and their expression patterns in the golden apple snails, Pomacea canaliculata [D]. China Jiliang University, 2012 [郑国湾. 外来生物福寿螺热休克蛋白的克隆与其表达差异的研究. 中国计量学院, 2012]
CLONING AND EXPRESSION ANALYSIS OF HEAT SHOCK PROTEIN 60 GENE FROM HYRIOPSIS CUMINGII
WU Sheng-Nan1, LIU Da-Wei2, LIU Yi1, HU Bao-Qing2, ZHANG Jian-Qiang1, WANG Yan1and WANG Ting1
(1. College of Life Sciences, Jiangxi Normal University, Nanchang 330022, China; 2. School of Life Sciences and Food Engineering, Nanchang University, Nanchang 330031, China)
Heat shock protein 60 (HSP60) is an important molecular chaperone protein that mainly exists in the mitochondria of organism. In the present study, the cDNA sequence of Hyriopsis cumingii HSP60 (hcHSP60) was cloned by 3′ rapid amplification of cDNA ends methods (3′-RACE) based on a long chain sequence of hcHSP60 (2629 bp) and was determined by high flux sequencing for transcriptome of H. cumingii blood cells, and its expression in the different tissues was detected by using reverse transcription-polymerase chain reaction (RT-PCR). Results showed that the full-length cDNA of hcHSP60 was 2807 bp that contains an open reading frame of 1707 bp, encoding a protein of 568 amino acid residues with 61.04 ku of predicted molecular weight and 5.63 of the theoretical isoelectric point, which was predicted to have no signal peptide and transmembrane helices. The deduced amino acid sequence of hcHSP60 shares the highest identity (82%) with HSP60 of Biomphalaria glabrata, and the phylogenetic analysis demonstrated that they were clustered in a same clade. The results of RT-PCR indicated that hcHSP60 was constitutively expressed in all 5 examined tissues of H. cumingii with the highest expression in hepatopancreas. The expression of hcHSP60 in all detected tissues was up-regulated obviously by higher water temperature, suggesting that it may play an important role in the stress response against heat.
Hyriopsis cumingii; Heat shock protein 60; Sequence analysis; Expression
Q781
A
1000-3207(2014)05-0897-06
10.7541/2014.134
2013-08-11;
2014-03-05
国家自然科学基金项目(31060359); 江西省自然科学基金(20122BAB204017)资助
吴圣楠(1992—), 女, 江西鹰潭人; 硕士研究生; 主要从事分子免疫学研究。E-mail: wusn2013@163.com
刘毅, E-mail: yiliusan@sina.com
猜你喜欢
杂志排行
水生生物学报的其它文章
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- MORPHOLOGICAL OBSERVATION AND RBCL SEQUENCE ANALYSIS OF A NEW SPECIES FROM CHINA, GRATELOUPIA BOAOENSIS WANG ET LUAN SP. NOV.(HALYMENIACEAE, RHODOPHYTA)
- GILL MEDIATES IMMUNE RESPONSES AFTER GRASS CARP REOVIRUS CHALLENGE IN GRASS CARP (CTENOPHARYNGODON IDELLA)
- 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响
- 一种快速构建集胞藻6803 petBD必需基因定点突变株的方法
- 大通湖环棱螺的次级生产力
