VD3羟基化酶的定向研究进展
2014-03-17刘苗,汪永辉,陆群
VD3羟基化酶的定向研究进展
刘苗 汪永辉 陆群
(西南交通大学生命科学与工程学院,成都 610031)
维生素 D3羟基化酶(Vdh)作为细胞色素酶P450s(CYP)蛋白家族成员,催化VD3形成有生物活性的1α,25(OH)2VD3。但是,由于VD3并不是Vdh的天然底物,Vdh羟基化活性较低。采用定向构建Vdh重组质粒的方法对Vdh催化活性位点给予优化,从而提高其羟基化能力。就目前对Vdh的结构特性和定向研究进行综述。
Vdh 异源表达 氧化还原蛋白 定向突变 25(OH)VD31α,25(OH)2VD3
VD3是一种脂溶性的激素原,它主要是经紫外线照射从皮肤内的7-脱氢胆固醇转化而来,或是从食物当中获取[1,2]。在哺乳动物中,VD3没有生物活性,因此必须利用细胞色素酶P450s(CYPs)对VD3进行羟基化,转化成有生物活性形式的VD3,即25-OHVD3,1α,25-(OH)2VD3。在人体内,首先是由肝脏中的CYP27A1催化形成25-OHVD3,然后再由肾脏中的CYP2R1催化形成1α,25-(OH)2VD3,通过这两步反应完成了VD3-1α,25(OH)2VD3的转化过程。活性1α,25(OH)2VD3在体内与维生素D受体结合(VDH)可以调节钙磷代谢,以及调控多种细胞应答,如细胞分化和细胞增殖等。1α,25(OH)2VD3及其衍生物在临床上已经被用于治疗慢性肾功能衰竭、甲状旁腺功能亢进、骨质疏松以及银屑病等疾病[3,4]。虽然从胆固醇到1α,25-(OH)2VD3的化学合成路线已经成熟,但是其总产率却不到1%。工业上,一般采用生物合成的方法,只需要一步就能实现VD3的转化过程,且成本低,对环境的污染小。而实现这种生物催化反应,关键在于反应所使用的微生物菌株以及VD3羟基化酶(Vdh)的手性和特异性结构域[2]。
大多数的细菌、真菌及放线菌如假诺卡氏菌属自养菌株,链霉菌属等微生物都能将无生物活性VD3转化成有生物活性的1α,25(OH)2VD3[2]。在工业上一般采用环糊精作为底物载体,但是运用这种方法酶的转化能力较弱,且副反应多,转化菌株的生长速度低。因此为了提高Vdh的反应活性,有必要对VD3羟基化酶的特性以及定向研究进行概述和分析。
Vdh属于CYP107蛋白家族成员。CYP107酶是一个超家族,其共同特点是含有一非共价键结合的血红素,是一个内膜蛋白,牢固地结合在细胞内膜
上,需要NADPH的还原等价物和氧分子来氧化底物,NADPH提供的电子需要氧化还原伴侣蛋白将其传递到细胞色素酶P450酶上。天然的P450s大多为脂溶性的,其在细胞内的表达水平比较低,不利于工业化生产。为了扩大P450s的应用以及增加其利用度,因此有必要提高P450s包括底物作用域、区域选择和立体选择性、催化活性、抑制作用及联合表达等在内的催化活性。
1 vdh异源细胞表达
由于游离的Vdh活性不高,结构不稳定,体外反应常表现出广谱底物活性。所以研究者一般采用异源表达系统即宿主-载体系统表达Vdh基因(vdh)。大肠杆菌、酵母等作为宿主系统具有生长快,容易操作等优点。放线菌基因组中含有许多P450酶的基因,具有稳定的氧化还原反应环境。因此放线菌如链霉菌、假诺卡氏菌、红平红球菌等均可作为良好的Vdh宿主菌株。Sakaki等[5]成功利用大肠杆菌(E.coli)表达小鼠25(OH)VD31α-羟基化酶。Kawauchi等[6]从自养无枝酸菌杆菌FEM BP-1573中分离出P450VD25(CYP105A2),成功地在变铅链霉菌(S.lividans)中表达。Fujii等[2]以放线菌属红平红球菌(Rhodococcus erythropolis)为宿主细胞建立了CYP107(Vdh)的表达系统,使CYP107的羟基化能力特异性增强。酵母细胞表达系统能识别线粒体和微粒体P450酶的靶向信号序列。由此相关学者从人类细胞组织中分离出CYP2R1基因,转入大肠杆菌或酿酒酵母菌(S.cerevisiae)中表达,其CYP2R1的表达水平显著增加。该研究发现重组的酵母细胞具有单氧合酶的活性,能在细胞溶质和细胞膜上形成电子传递链[7]。删除人CYP2R1(维生素D325-羟基化酶)与老鼠CYP2J3(维生素D325-羟基化酶)疏水性区域的氨基酸残基后,导入大肠杆菌中表达,25(OH)VD31α羟基化活性特异性增加。重组的酵母细胞功能性地表达人CYP2R1,加入底物后,能将VD3催化形成25(OH)VD3[8,9]。不同的Vdh在不同的异源表达系统表达水平不同。因此表达不同的vdh时应选择合适的宿主细菌。合适的异源细胞表达系统不仅能实现维生素D3的羟基化过程,还能合成新的代谢产物,并且在野生型和突变型羟基化酶的对比研究中发挥中至关重要的作用[9]。图1和图2分别为各种细菌和哺乳动物中VD325-和25(OH)VD31α-羟基化酶以及它们的异源表达系统。
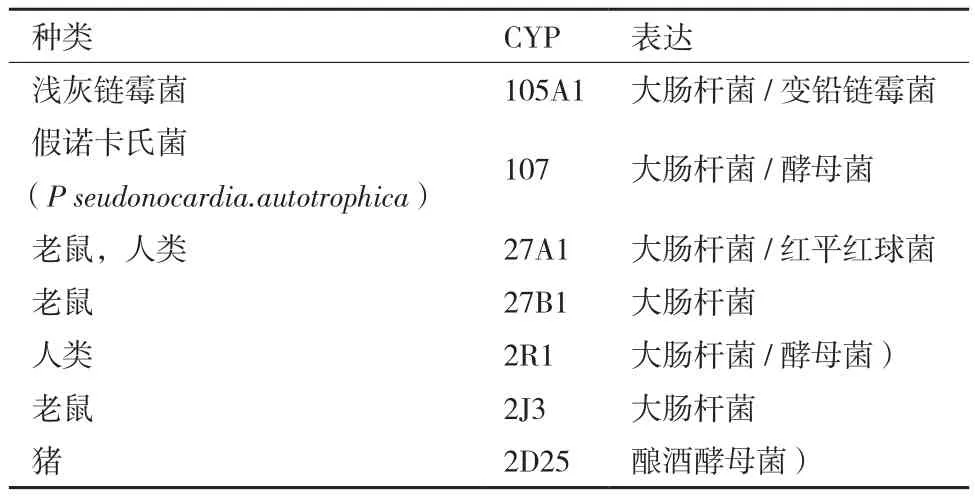
表1 VD325-羟基化酶及其异源表达系统[1-9]

表2 25(OH)VD31α-羟基化酶及其异源表达系统[6-9]
2 Vdh与氧化还原伴侣蛋白协同表达
大多数天然的Vdh如果单一的在宿主细胞中表达,那么它的羟基化能力较弱。因此,Vdh在宿主细胞表达的同时需要氧化还原蛋白作为分子伴侣协同表达,提高酶表达量。常用的分子伴侣为铁氧还原蛋白,如ThcD、AciC、Fdx、Fdr和AciB等[2,10]。Vdh是一类微粒体P450酶,能够接受NADPH-细胞色素P450s 还原酶提供的电子。铁氧还原蛋白酶将NADH供体提供的电子转移到Vdh的血红素结构域。Fujii等[2]发现Vdh基因若单独在宿主细胞当中表达,VD3的C-25位羟基化活性较低(20.2 mmol/ min/mol),然而氧化还原伴侣蛋白ThcC/ThcD-VDh重组基因在宿主细胞当中联合表达后,Vdh的C-25的羟基化活性增加了近6倍(119.2 mmol/min/mol)。这些数据说明尽管内源性的氧化还原分子同时在宿主细胞当中表达,Vdh-氧化还原伴侣蛋白的联合表达也能增强该酶的羟基化活性。Sawada等[11]成功地构建了人的CYP27B1和牛的ADX,ADR的表达质粒,然后导入大肠杆菌细胞中表达。CYP27B1羟基化活性特异性增加。这就说明了电子通过ADX和ADR
从NADPH成功地转移到了CYP27B1,形成电子传递链。Strushkevish等[12]发现人类CYP2R1与分子伴侣蛋白GroEL/ES在大肠杆菌中协同表达,发酵培养物中25(OH)VD3,1α,25-(OH)2VD3的产量显著增加[12]。CYP27B1是25(OH)VD3的1α羟基化酶,催化1α,25-(OH)2VD3的形成。Uchidaa等[13]将小鼠体内的CYP271-GroEL/ES重组基因导入到大肠杆菌中过量表达,CYP27B1的表达水平远高于野生型。而缺少GroEL/ES分子伴侣蛋白时,CYP27B1酶的结构发生折叠导致表达水平降低。放线菌类菌株含有稳定的Vdh,并且具有电子转移蛋白酶,提供了氧化还原反应的环境。因此,放线菌常用来作为工业上进行羟基化反应的宿主菌株。目前将氧化还原蛋白融合到Vdh的表达质粒中协同表达是提高Vdh的25-和1α-羟基化活性一种有效的基因重组方法。
3 诱导表达重组质粒
构建Vdh表达质粒的试验中,研究者发现构建的重组质粒在大肠杆菌(E.coli)/链霉菌(Streptomyces)中的表达水平较低,因此他们在试验过程中加入诱导剂诱导重组质粒的表达,提高Vdh的表达水平。常用的诱导剂为丙酮、硫链丝菌素等。Fujii等[14]构建了PTAOR3-VDh-boxAB重组质粒,导入到P. autotrophica中表达,细胞提取物利用SDS-PAGE和CO差谱分析法(CDSA)测定其Vdh的活性。分析发现在加入丙酮的细胞提取物中,CDSA在P450 nm处有显著的吸收峰,而没有加入丙酮的细胞提取物中,CDSA在P450 nm处没有明显的吸收峰。SDSPAGE数据也显示丙酮能诱导PTAOR3-VDh-boxAB的表达。分析结果表明丙酮能作为诱导剂诱导分子伴侣蛋白boxAB和VDh 活性的表达。同样地,相关学者在构建VDh-Fdx-Fdr的表达基因的同时,采用硫链丝菌素作为诱导剂诱导重组质粒在红平红球菌中表达。结果在红平红球菌的培养中检测到大量的VD3的活性形式[15]。这些数据说明宿主细胞在表达Vdh和氧化还原伴侣蛋白的重组基因时,都需要加入诱导剂诱导其表达。
4 定向构建Vdh的突变体
由于VD3并不是Vdh的天然底物,所以研究者们采用定向诱变Vdh基因,改变底物识别域的结合位点来获得更高酶活性的Vdh[16]。Fujii等[2]先从假诺卡氏属自养无枝酸菌 NPRC12473分离得到Vdh基因,经随机突变,将其突变基因克隆到载体PET-aciBC上,然后转入大肠杆菌中表达,从1 000个转化物中分离得到8个高活性突变体,得到4个最佳氨基酸置换,构建出Vdh-K1的突变体。同样地,定点突变也检测到了这个8个活性位点。在这8个活性位点中,Fujii分析出4个最佳氨基酸置换点(T70R,V156S,E216A,E384R)。相对于野生型基因表达活性而言,其中每一个突变体在大肠杆菌中Vdh表达活性都提高了2-3倍。这4个突变基因同时在大肠杆菌中表达,Vdh的羟基化的活性会提高7.9倍。Fujii将这4个最佳的基因置换组合整合到前面所得到的Vdh-K1的突变菌株中表达,得到光谱数据显示Vdh 25-羟基化的活性提高12倍,25(OH)VD3的1α-羟基化活性提高近22倍(相对于野生型Vdh-WT)[1,2,16]。文献报道在Vdh-K1的培养物中,科学家们不仅发现25(OH)VD3,1α,25(OH)2VD3的含量明显增加,还检测到少量的26(OH)VD3,但并没有检测到1α(OH)VD3分子[1,17,18]。晶体结构分析[1]表明Vdh-K1的4个氨基酸替换不是位于酶的底物结合位点上,而是在酶结构呈分散排列。不管有无底物的结合,突变型Vdh-K1呈封闭的分子构象,末端的血红素囊状结构暴露在溶剂中;野生型Vdh-WT却呈现开放式的分子构象。这些结果表明通过4个氨基酸替换(T70R、V156S、E216A和E384R)使得Vdh分子构象平衡从开放式向封闭式构象移动[1]。Hayashi等[19]通过对细胞色素酶P450(CYP)105A1基因定向诱变,获得R73V/R84V双突变体,该突变体能实现VD3-1α,25(OH)2VD3过程的高转化。突变点R73V/R84V位于CYP105A1基因中底物识别域上,具有25(OH)VD31α-高羟基化能力[16]。他们在变铅青链霉菌TK23进行重组表达,并且在该链霉菌的培养物当检测到大量的1α,25(OH)2VD3,除此之外,还检测到新的代谢产物1α,25(R),26(OH)3D3和1α,25(S),26(OH)3D3
[16,20]。这两种新的代谢产物同样也具有抗增殖活性和低血钙活性,但二者的转化率不高。通过晶体结构分析和Docking 软件模拟底物结合方法,
Hayashi等[19]证实了R73V/R84A突变体具有VD3C25,C1和C26(C27)的羟基化的能力。从浅灰链霉菌中提取出的P450酶系CYP105A1具有VD2和VD3的羟基化能力。Omer等[20]通过在CYP105A1(P450SU-1)N端添加靶向信号序列,成功地将其导入到高等植物中的叶绿体中表达。Sawada等[21]成功地将浅灰链霉菌的CUP105A1重组基因导入到大肠杆菌中表达,提高了VD3 25-和25(OH)VD3 1α-羟基化活性。Seifert等[22,23]针对CYP102A1催化位点上F87和A328两个氨基酸残基进行定点突变,获得24种新的突变体。这些系列突变体能识别多种底物,产生广泛而有效的环化和非环化的羟基化合物。
经过定向诱变,获得高活性Vdh突变体,突变体不仅具有更高酶的活性,并且对反应活性位点具有高度选择性。新的稳定构象通常具有不同的功能特异性,因而产生不同的区域选择和立体选择性,识别不同的VD3底物分子,得到新的具有抗增殖,低血钙等生物学功能的VD3活性药物。为临床上治疗维生素D类疾病提供有效的途径。
5 展望
为了提高Vdh羟基化能力,研究人员采取异源表达系统表达vdh,协同表达氧化还原分子伴侣蛋白提高Vdh重组质粒的表达水平,加入诱导剂或启动子启动重组质粒的表达,定点突变Vdh活性位点提高酶的羟基化能力。除此之外,在表达Vdh基因同时,有相关学者[10,19]采用添加抗生素例如乳链球菌素(nisin)等方法形成乳链球菌素-脂质微孔复合物,形成VD3-PMCD复合物的离子通道,提高Vdh的羟基化活性。除了上述方法外,VD3-PMCD复合物进入细胞机制的研究,以及Vdh-底物晶体结构分析,相应靶向信号蛋白序列的添加或抑制酶活性的氨基酸残基的删除,Vdh的区域和立体选择性和有序羟基化反应的分子机制的研究等蛋白工程方面都是未来获取更高酶活性Vdh的研究重点,为 Vdh的定向研究提供新的方向和前景。相信随着生物技术的快速发展,活性维生素D3药物的生物制备将会得到新的突破。
[1] Yasutake Y, Fujii Y, Nishioka T, et al. Structural evidence for enhancement of sequential vitamin D3hydroxylation activities by directed evolution of cytochrome P450 Vitamin D3hydroxylase[J]. American Society for Biochemistry and Molecular Biology, 2010, 385(41):170-175.
[2] Fujii Y, Kabumoto H, Nishimura K, et al. Purification, characterization, and directed evolution study of a vitamin D3hydroxylase from Pseudonocardia autotrophica[J]. Biochemical and Biophysical Research Communications, 2009, 385(2):170-175.
[3] Schuster I. Cytochromes P450 are essential players in the vitamin D signaling system[J]. Biochimica et Biophysica Acta, 2011, 1814(1):186-199.
[4] Takeda K, Asou T, Mastsuda A, et al. Application of cyclodextrin to microbial transformation of vitamin D3and 1α, 25-dihydroxyvitamin D3[J]. Ferment, Bioeng, 1994, 78(5):380-382.
[5] Sakaki T, Sawada N, Takeyama K, et al. Enzymatic properties of mouse 25-hydroxyvitamin D31α-hydroxylase expressed in Escherichia coli[J]. Biochem, 1999, 265:950-956.
[6] Kawauchi H, Sasaki. J, Adachi T, et al. Cloning and nucleotide sequence of a bacterial cytochrome P-450VD25gene encoding vitamin D325-hydroxylase[J]. Biochim Biophys, 1994, 1219:179-183.
[7] Sakaki T, Shibata AM, Yabusaki Y, et al. Organella-targeted expression of rat liver cytochrome P450c27 in yeast . Genetically engineered alteration of mitochondrial P450 into a microsomal form creates a novel functional electron transport chain[J]. Biol Chem, 1992, 267:16497-16502.
[8] Yamasaki T, Izumi S, Ide H, et al. Identification of a novel rat microsomal vitamin D325-hydroxylase[J]. Biol Chem, 2004, 279:22848-22856.
[9] Sakaki T, Sugimoto H, Hayashi K, et al. Bioconversion of vitamin D to its active form by bacterial or manmmalian cytochrome P450[J]. Biochim Biophys Acta, 2011, 1814(1):249-256.
[10] Imoto N, Nishioka T, Tamura T, et al. Permeabilization induced by lipid II-targeting lantibiotic nisin and its effect on the bioconversion of vitamin D3to 25-hydroxyxitamin D3by Rhodococcus erythropolis[J]. Biochemical and Biophysical Research Communications, 2011, 405:393-398.
[11] Sawada N, Sakaki T, kitanaka S, et al. Enzymatic properties of
human 25-hydroxyvitamin D31alpha-hydroxylase coexpression with adrenodoxin and NADPH-adrenodoxin reuctase in Escherichia coli[J]. Bochem, 1999, 265:950-956.
[12] Strushkevish N, Usanov SA, Plotnikov AN, et al. Structural analysis of CYP2R1 in complex with vitamin D3[J]. J Mol Biol, 2008, 380(1):95-105.
[13] Uchidaa E, Kagawab N, Sakaki T, et al. Purification and characterization of mouse CYP 27B1 overproduced by an E.coli system coexpressing molecular chaperonins GroEL/ES[J]. Biochemical and Biophysical Research Communications, 2004, 323(2):505-511.
[14] Fujii Y, Norhisa K, Fujii T, et al. Construction of a novel expression vector on Pseudonocardia autotrophia and its application to efficient biotransformation of compactin to pravastatin, a specific HMG-CoA reductase inhibitor[J]. Bichemical and Biophysical Research Communications, 2011, 404:511-516.
[15] Yasutake Y, Tamura T. Efficient production of active form of vitamin D3by microbial conversion[J]. Synthesiology, 2011, 4(4):227-235.
[16] Taek SJ, Lauchli R, Arnold FH. Cytochrome P450:taming a wild type enzyme[J].Current Opinion in Biotechnology, 2011, 22:809-817.
[17] Sasaki J, Miyazaki A, Saito M, et al. Transformation of vitamin D3to 1alpha, 25-dyhydroxyvitmin D3via 25-hydroxyvitamin D3using Amycolata sp.strains[J]. Microbiol Biotechol, 1998, 1219(2):179-183.
[18] Sasaki J, Mikami A, Mizoue K, et al. Transformation of 25-and 1alpha-hydroxyvitamin D3to 1alpha, 25-dihydroxyvitamin D3by using Streptomyces sp.Strains[J]. Environ Microbiol, 1991, 57(10):2841-2846.
[19] Hayashi K, Yasuda K, Sugimoto H, et al. Three-step hydroxylation of vitamin D3by a genetically engineered CYP105A1[J]FEBS J, 2010, 277(19):1742-4658.
[20] Omer CA, Lenstra R, Litle PJ, et al. Genes for two herbicideinducible cytomchromes P-450 from Streptomyces groseolus[J]. Bacteriol, 1990, 172(6):3335-3345.
[21] Sawada N, Sakaki T, Yoneda S, et al. Conversion of vitamin D3to 1α, 25-dihydroxyvitamin D3by Streptomyces griseolus cytochrome P450SU-1[J]. Biochemical and Biophysical Resrarch Communications, 2004, 320:156-164.
[22] Seifert A, Vomund S, Grohmann K, et al. Rational design of a minimal and highly enriched CYP102A1 mutant library with improved region-, stereo- and chemoselectivity[J]. Chembiochem, 2009, 10(5):853-861.
[23] Weber E, Seifert A, Antonovici M, et al. Screening of a minimal enriched P450 BM3 mutant library for hydroxylation of cyclic and acyclic alkanes[J]. Chembiochem, 2010, 11(3):2502-2505.
[24] Liu W, Hansen JN. Some chemical and physical properties of nisn, a small protein antibiotic produced by Lactococcus lactis[J]. Environ Microbiol, 1990, 56:2551-2558.
(责任编辑 狄艳红)
Advances in Directed Research of VD3Hydroxylase
Liu Miao Wang Yonghui Lu Qun
(School of Life Science and Engineering of Southwest Jiaotong Uiversity,Chengdu 610031)
Vitamin D3 hydroxylase is a cytochrome P450(CYP)responsible for the biocatalytic conversion of vitamin D3 to 1α, 25-dihydroxyvitamin D3(1α, 25(OH)2VD3)。Since VD3 is not a natural substrate for Vdh, the hydroxylase of Vdh is quite low. Researchers construct a novel of recombination Vdh plasmid by directed evolution to optimize the active sites of catalytic structure, thereby improving the hydroxylase ability. This article reviewed Vdh structure properties and development of directed evolution.
Vdh Heterologous expression Redox partner protein Directed evolution 25-hydroxyvitaminD3 1α 25-dihyroxyvitamin D3
2013-08-09
刘苗,女,硕士研究生,研究方向:生物转化;E-mail:920946828@qq.com
陆群,男,副教授,硕士生导师,研究方向:微生物药学、生物催化与降解、反应器与生化工艺学原理;E-mail:luqun1125@126.com
