生物柴油新原料
——微生物油脂
2014-03-17贾彬,王亚南,何蔚红等
生物柴油新原料
——微生物油脂
贾彬1,2王亚南2何蔚红2刘德海2谢复红2王继雯2冯菲2黄瑛1
(1.深圳大学生命科学学院,深圳 518061;2.河南省微生物工程重点实验室,郑州 450003)
生物柴油是替代传统石化能源的重要途径,但高昂的原料油成本限制其进一步应用。微生物油脂具有价格低廉、供给充足和不占用耕地资源等优点,是理想的生物柴油原料油脂。对微生物油脂组成成分,提取和测定方法等方面进行详细介绍,并重点综述转座标签育种、代谢通路调控育种、转录因子调控育种和发酵过程优化等技术在提高细胞油脂积累量方面的应用进展,探讨以微生物油脂为新原料制备生物柴油的优点及可行性。
微生物油脂 生物柴油 油脂含量测定 代谢通路调控
生物柴油指甘油三酯经酯交换工艺生成的脂肪酸甲酯或乙酯。随着能源危机的加剧和原油价格的飙升,生物柴油技术受到越来越多的关注与重视。就我国实际情况而言,我国是世界第二大能源消费国,对外石油依存度已超过50%,石油供给的相对不足已成为制约经济发展的关键瓶颈,这使生物柴油具有巨大的发展空间。本文就生物柴油的发展趋势,对微生物油脂的研究状况进行综述,探讨以微生物油脂为新原料制备生物柴油的优点及可行性,为降低生物柴油成本提供对策。
1 生物柴油概况
与石化柴油相比,生物柴油具有良好的燃料性能、较高的安全性能、清洁尾气排放性能和发动机低温启动性能,且润滑性良好,能延长发动机使用寿命,属于典型的绿色可再生能源,是石化燃料的理想替代品。生物柴油的原料油可分为植物油脂、动物油脂、废弃油脂以及新兴的微生物油脂等。各国在原料油的选择上区别较大,欧、美等国多数以大豆油、菜籽油、芥末籽油等作为原料油,而东南亚等国基本使用棕榈油,日本则一般使用餐饮废油,我国主要采用麻风树油、黄连木油等木本油脂和地沟油等废弃油脂,而以微生物油脂为原料的生物柴油还处于研究阶段。据统计,现阶段生物柴油的原料油成本占总成本的50%-85%[1],成为决定生物柴油最终价格的关键因素。
2 生物柴油原料油优劣分析
2.1 现有生物柴油油源特点及缺陷
草本油料作物油脂含量较高,种子收获、贮藏、运输和加工的程序简便。但我国种植量少,不能用于生物柴油生产;木本油料植物可在荒山种植,不
占用耕地资源,还可绿化环境、改良生态。但其油脂含量偏低,收获、存储成本高,荒山种植进一步增加了采摘难度和效率;废弃油脂成本较低,但其成分复杂,酸度高,加上我国废弃油脂的回收渠道缺乏、监督不严,且回流餐桌现象屡禁不止,难以稳定、持续供给生物柴油生产。
按照我国当前运输燃油消耗量估算,以生物柴油完全替代石化燃料需要相应种植大豆 27 605×104hm2,占现有耕地面积225.5%;种植油菜7 524×104hm2,占耕地61%;种植麻疯树2 666×104hm2,占耕地22%[2]。巨大的种植量和种植面积在我国难以实现,寻找高油脂含量的新油源意义重大。
2.2 微生物油脂及其优势
微生物油脂又称单细胞油脂(Single cell oils),是微生物在一定条件下将碳水化合物、碳氢化合物等碳源转化为菌体内大量储存的油脂。其主要成分同植物油脂类似,但不饱和程度更高,以它为原料生产的生物柴油品质更高[3]。与其它原料油相比微生物油脂具有以下优点:(1)原料供给充足。微生物生长周期仅4-7 d,且环境适应性强,甚至可以做到即时生产;(2)不占用耕地和淡水资源。部分藻类可在江海湖泊生长,更符合国家生物柴油发展政策;(3)可规模化管理和生产。微生物不受外界环境影响,能在工厂发酵罐中大规模生产,进而实现现代化工业生产;(4)产品附加值高。大部分微生物在产油的同时会积累EPA、DHA和饲料蛋白等高附加值副产品,增加生物柴油产业链,提高产品利润。由此可见,微生物油脂具有广阔前景,是生物柴油未来发展的重要方向。
3 微生物油脂研究进展
3.1 产油微生物的种类
微生物大都能合成少量油脂,但只有油脂积累量超过20%的部分才可被称为油脂微生物。虽然油脂微生物在藻类、酵母、真菌和细菌中都存在,但可用于生物柴油生产的仅有一少部分,表1列举了几种常见油脂微生物及其油脂含量。表中酵母、真菌类油脂含量最高(50%-70%),藻类油脂含量稍低(30%-60%),细菌类油脂含量最低(20%-40%)。可见,对生物柴油来说,酵母、真菌和藻类才具有实际意义。其中酵母、真菌为异养型微生物,需额外添加碳、氮源才能合成油脂。而藻类为典型自养微生物,生长需求低,能直接利用光和CO2合成油脂。它们在无论淡水还是海水的开放环境中都可大量繁殖,更适合生物柴油发展的需求。

表1 常见油脂微生物及其油脂含量
3.2 微生物油脂成分组成
微生物油脂成分同植物油脂成分基本相同,均为脂肪酸甘油三酯。甘油酯的脂肪酸碳链长度多为偶数,尤其以棕榈酸、油酸、亚油酸和硬脂酸等含量较高,但部分微生物多不饱和脂肪酸含量较高,不同来源微生物油脂脂肪酸组成情况见表2[6,10]。藻类油脂以C16、C18为主,Δ9、Δ12和Δ15形式的不饱和脂肪酸较多。酵母和真菌油脂也以不饱和脂酸为主,C18∶1和C18∶2最多,C16∶1略少,且多含特殊脂,如M. alpina含7%的C20∶3,
E. coronata则含13%的C20∶1和6%的C22∶1。细菌油脂含量较低,油脂成分结构也相对简单,以饱和脂肪酸为主,但极少数细菌油脂积累度可高达70%以上,但总体上讲,细菌油脂不适合生物柴油生产。
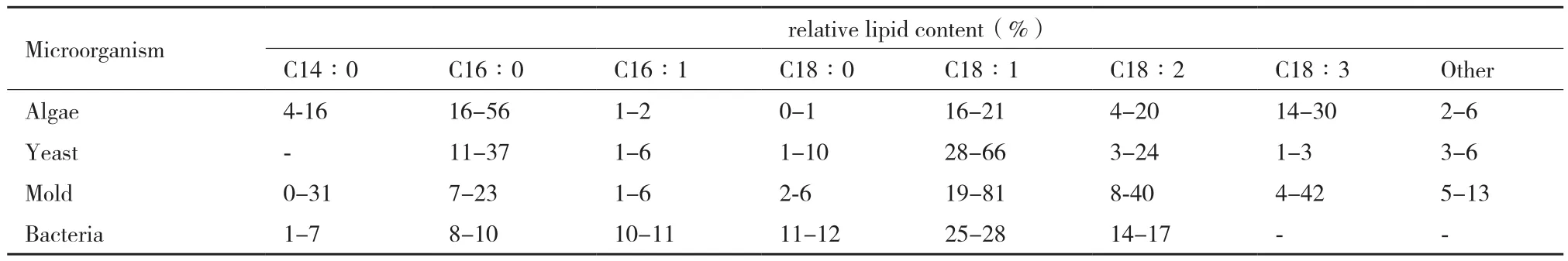
表2 油脂微生物的脂肪酸组成
3.3 微生物油脂的提取及含量测定
3.3.1 提取方法 油脂提取方法可能随目标提取物不同而存在较大差异,但其效率却是影响油脂价格和品质的关键因素。微生物油脂提取一般只涉及细胞破碎和油脂分离两个过程,但由于藻类水分含量高需增加脱水步骤,因而晒干、喷雾干燥、冷冻干燥和滚筒干燥等方法常被作为藻类油脂提取的预处理步骤。
细胞破碎的方法有基于机械剪切力的超声、高压、珠磨床和粉碎机破碎等,也有基于物理/化学法的反复冻融、有机溶剂处理、渗透压休克和生物酶处理等方法。根据原料材质,选择合理的细胞破碎方法非常重要。Lee等[12]比较了高压、微波、超声等5种破碎方法对微藻油脂提取率的影响发现,在同等条件微波法提取效率最高,油脂提取量达到28.6%。而Mendes-Pinto[13]等在提取微藻虾青素时则发现高压和匀浆器破碎的效率最高,是酸、碱、酶处理等方法的2-3倍。
油脂分离过程中常用的方法有有机溶剂萃取和超临界萃取等。在有机溶剂萃取法中,可供选择的溶剂种类很多,但萃取溶剂不同会导致油脂成分发生改变,如用乙醇替代正己烷能显著增加羟基苯乙烯甾醇酯、生育酚等高附加值油脂的含量[14]。Moreau[15]则认为随着溶剂极性增加油脂回收量也增加,并且高温也有利于提高溶剂的萃取效率;CO2超临界法萃取(SCCO2)是新近发展的一种高效油脂分离方法,该方法操作温和、对有效成分破坏少、无溶剂残留。Halim等[16]详细评估了有机溶剂萃取和SCCO2在微藻油脂提取效率、脂肪酸组成、萃取动力学等方面的差异,得到SCCO2法提取油脂效率高,非常适用于生物柴油油脂提取的结论。该方法能直接原位提取藻类油脂,效率是正己烷萃取法的5.6倍。
3.3.2 测定方法 传统油脂定量必须在细胞油脂提取结束后,经计算得到。该方法虽然准确但步骤多、耗时长、细胞消耗量大,无法满足快速定量的要求。Izard等[17]通过硫酸-磷酸-香草醛显色反应的方法,快速定量细胞油脂含量(包括极性脂和中性脂)。由于该方法无需油脂提取步骤,且细胞用量只有0.5 mL,极大缩短了油脂含量测定时间。Wang等[18]利用该方法筛选经粒子束照射的酵母突变体,成功筛选到两株高产油脂酵母。
为了实时测定菌体油脂含量,Kimura等[19]开发了基于尼罗红(Nile red)染色的荧光检测法。他们将细胞用尼罗红染色5 min,在发射光400 nm-700 nm,激发光488 nm的条件下测定荧光强度,换算油脂含量。该方法速度快、灵敏度高、对细胞无害,可进行活体细胞测定。Chen等[20]在此基础上进行改进,加入DMSO辅助尼罗红染色,荧光测定条件改为530 nm/575 nm,并与96孔板筛选结合,发展出高通量油脂测定方法,成功应用于工程油脂微藻的快速筛选。Montero等[21]则结合尼罗红染色荧光和流式细胞分选快速测定微藻油脂含量,进一步提高油脂测定效率,并实现了细胞的实时筛选。与尼罗红类似的染料油红(Oil red O)也逐渐应用于微生物油脂含量测定[22]。
染色荧光法在液态培养的油脂含量测定中非常有效,但无法在固态培养测定中应用。为此,Peng等[23]建立了基于近红外光谱分析的刻度模
型法对固态培养的微生物油脂含量进行测定,该方法测定结果的平均标准误差低于0.58%,成功对Microsphaeropsissp、Nigrosporasp等5种固体发酵的真菌油脂含量进行测定。
4 提高微生物油脂含量的策略
4.1 高含量油脂微生物育种技术
4.1.1 传统诱变育种 传统物理、化学诱变技术曾在工业微生物育种中发挥重要作用,迄今仍在微生物育种广泛使用。常见物理诱变有紫外线、X-射线等,化学诱变剂有碱基类似物、5-氟尿嘧啶、烷化剂和氯化锂等,利用该技术提高微生物油脂含量的报道较多,鉴于篇幅限制不再此过多讨论。
4.1.2 转座标签育种 利用转座子随机插入基因组,寻找与油脂合成相关基因的育种工作已取得一定进展,发现了与油脂合成相关的系列基因。Kamisaka等[24]通过转座子突变在酿酒酵母中发现5个能提高菌体含量的基因,其中ΔSnf2使油脂含量提高3.8倍。宋安东等[25]利用转该技术选育出油脂含量提高20.6%的发酵型丝孢酵母突变株。
4.1.3 代谢通路调控育种 微生物油脂代谢是一个多酶参与的复杂过程,从油脂的合成、碳链的延伸、脂质体的转运、存储到最终氧化转化为能量涉及了糖酵解、三羧酸循环、β-氧化等多个细胞生理生化过程,线粒体、内质网、过氧化物酶体等多个细胞器都参与其中,共同构成复杂的网络结构。研究者针对代谢网络特点,利用基因工程和代谢工程手段对其进行调整和结构优化,以期提高柴油酵母的油脂含量。
直接增加油脂合成量是首选调控策略。乙酰CoA羧化酶(ACC)、酯酰CoA:二酰甘油酰基转移酶(DGAT)和磷酸酯:二酰甘油酰基转移酶(PDAT)直接参与油脂合成并为关键限速酶,通过增加它们的表达量来提高油脂含量的方法非常有效。ACC是脂肪酸从头合成途径中第一个限速酶,Davis等[26]将大肠杆菌BL21中4个ACC基因全部过表达,直接导致菌体油脂含量提高6倍,Klaus[27]将拟南芥ACC基因在马铃薯中表达使其油脂含量提高5倍;DGAT和PDAT都是甘油三酯合成途径最后一步的催化酶,负责催化二酰甘油到三酰甘油的转化,前者对酰基CoA依赖,后者不依赖。迄今为止,至少发现两个DGAT1家族(DGAT1和DGAT2),两者不仅在序列同源性上有较大差别,很可能具有不同的生理学功能。Bouvier等[28]将拟南芥DGAT两个基因分别导入酵母和烟草发现,转化株中DGAT活性提高200-600倍,相应油脂含量分别提高9倍和7倍。DGA1是酵母中最早鉴定的DGAT,属于DGAT2家族,负责催化酿酒酵母中87%的二酰甘油转化为三酰甘油。研究者还在Y. lipolytica中发现了属于DGAT1家族的DGA2,用POX启动子调控单独过表达它能使细胞油脂含量提高63%。LOR1是目前唯一发现的酵母PDAT,该酶同时具有磷脂酶和酰基转移酶的活性,在酵母对数生长期的TAG合成中起主要作用,该酶缺失导致TAG含量下降40%,目前尚未有藻类DGAT和PDAT的报道[29]。
减少细胞油脂自身消耗量是另一种常见策略。脂肪酸β-氧化是胞内氧化消耗油脂的主要代谢途径,抑制该途径可减少油脂自身消耗量。酯酰CoA氧化酶(AOX)是该途径关键酶,该酶家族保守性差,在不同种属间区别较大,在C. tropicalis中发现3个,C. maltose中2个,在S. cerevisiae中只有一个,在Y. lipolytica中则发现6个。研究表明,部分抑制β-氧化可增加细胞油脂含量,但完全缺失AOX则会影响细胞能量供给导致细胞难以正常生长[30]。
改变中间代谢产物流向,减少分支路径竞争也能有效增加细胞油脂含量。甘油醛3磷酸(G3P)是甘油三酯基本骨架,它和磷酸二羟丙酮(DHAP)同为糖酵解中间产物且二者能相互转化,Beopoulos等[31]将负责从G3P到DHAP转化的关键酶GUT2敲除,改变代谢网络中碳流向,生成了更多甘油-3-磷酸,使酵母油脂含量提高了3倍,在此基础上他们继续敲除β-氧化途径的AOX进一步使油脂含量提高了4倍。类似地,Thierry等[32]把负责G3P穿梭作用的Gpd1基因过表达,增加了甘油-3-磷酸的积累量,进一步缺失AOX后使细胞油脂含量提高34%;另一方面,胞内磷脂合成与甘油酯合成相互竞争,它们均以磷脂酸为底物,减少磷脂合成量能增加细胞甘油酯含量[30]。
增强油脂合成相关途径酶促进细胞油脂含量。虽然有些酶并未直接参与油脂代谢,但是它们与油
脂代谢相关,部分增加它们的表达量也可提高细胞油脂含量。油脂合成基本原料乙酰辅酶A是由柠檬酸裂解生成,Rangasamy等[33]证明增加ATP:柠檬酸裂解酶(ACL)表达量使油脂含量提高16%;另一方面,甘油酯合成是一个化学耗能过程,NADPH在合成途径中充当还原剂,增加细胞NADPH供应量同样能提高细胞油脂含量,而NADPH则由苹果酸脱氢酶(ME)催化苹果酸分解产生。Zhang等[34]分别将Mucor circinelloides和Mortierella alpine的ME基因在M. circinelloides中过表达,使油脂含量相应增加2.5倍和2.4倍。
4.1.4 其他 随着研究深入,人们发现从转录水平调节油脂合成的优势逐渐突出,利用转录因子(TFs)调节油脂合成途径关键酶水平和丰度的研究正在开展。已经在动植物中发现大量与油脂合成相关的TFs,如SREBP、SebHLH和GmDof4等,但在微生物却比较少。Courchesne等[30]认为细胞转录因子构成金字塔形结构,高等级TFs相对保守且能调控低等级TFs,低等级TFs数量多却不保守导致研究难度大,而与油脂合成相关的TFs恰为低等级TFs。目前,只有S. cerevisiaeSNF2转录因子研究相对清楚,它负责调控磷脂合成,受纤维醇、胆碱抑制,如上文所述,直接缺失SNF2可使油脂含量提高3.8倍[24]。可见,TFs调控策略在提高油脂含量上极有潜力,但当前研究仍处于寻找和发现TFs的阶段。越来越多研究证明单一代谢途径调节取得的效果有限,在细胞水平上开展多策略综合应用才能有效提高油脂积累研究也被逐渐重视。2007年由欧盟第七框架计划支持建立了“脂酵母”计划,该计划希望以油脂酵母Y. lipolytica为出发菌,利用海洋解烷烃类细菌特有降解转化酶开发出脂类通用型发酵平台,用以生产各种功能脂。
4.2 发酵过程优化
虽然基因工程、代谢工程在提高油脂含量方面发挥了重要作用,但对遗传背景不清楚的菌来说,利用发酵过程控制提高油脂含量无疑是最简单、有效的途径。介于篇幅限制,有关发酵温度、pH、通气量等基本参数的控制优化不在此讨论。
4.2.1 限制因子控制 油脂合成已被证明是细胞在碳源充裕而其他方面受限制时的一种能量积累方式。常见限制性因子有氮源受限、硫源受限和磷源受限等。其中氮源受限最易实现,简单改变培养基C/N比即可实现油脂发酵生产的控制。Papanikolaou等[35]发现培养基C/N从83.5增加到133.5后,Cunninghamella echinulata油脂含量随之从36%增至47%。李永红等[36]在R. toruloides同样发现其油脂含量随之C/N增加而提高,C/N为420时油脂含量达到最高值76%;硫限制对油脂含量积累同样有促进作用。Wu等[37]研究了R. toruloides在硫限制时的油脂状况发现,C/S比为46750时,细胞油脂含量达58.3%,且硫限制时,细胞油脂含量保持稳定不再随C/N而变化。磷限制也有类似结果,降低培养基磷含量可显著增加R. toruloides油脂含量[36]。
4.2.2 发酵底物控制 萄糖、甘油是油脂发酵生产常用底物,但大规模工业化生产仍可能存在成本较高的问题,为减少微生物油脂生产成本,研究者研究廉价底物的油脂生产工艺。因此,利用木质纤维素水解物作为发酵底物的报道非常多。油脂微生物代谢底物谱广,不但能利用水解产物中的葡萄糖等六碳糖,而且能有效转化木糖等五碳糖,对解决纤维素全糖利用问题有积极促进作用。除木质纤维素水解物外,几丁质水解物也是一种非常有潜力的油脂发酵底物。R. glutinis、R. opacus和C. curvatus等已被证实能以该水解产物为唯一碳源进行生长,且油脂积累量能达到28%以上[38]。为进一步增加发酵底物范围,Zhao等[39]将菊粉酶基因转入Y. lipolytic中,获得了能直接利用菊芋生产油脂的工程菌,菌体油脂含量可达50%以上,部分解决原料来源问题,同时也可有效解除滩涂、盐碱地荒置问题。
4.2.3 发酵模式优化 当前,微生物油脂生产主要以液态发酵为主,其中分批补料培养模式可方便控制限制因子浓度,获得了广泛应用。在C. curvatus发酵粗甘油生产油脂的研究中,批式培养时生物量仅能达到6 g/L,而分批补料培养则能达到30 g/L以上,油脂含量可达52%[40]。此外,为缩短发酵时间,减少原料消耗,林金涛[41]等提出了两阶段的培养模式,该模式将菌体的生长阶段和产油阶段分开,能节省氮源及其他辅料的消耗,提高油脂产量。也有少数固体发酵产油脂的报道,但总体水平不高,
Peng等[23]固体发酵后油脂产量为80 mg/gds,油脂占干发酵物的10.2%。
近年来,混合培养法逐渐成为一种新油脂发酵模式。Cheirsilp等[42]将黏红酵母与小球藻混合培养后发现菌体生长速度和油脂产量均有明显提高,菌体培养时间缩至5 d,菌体量达(4.63±0.15)g/L,油脂产量达(2.88±0.16)g/L。他们认为,混合培养时藻类作为O2供体提高了酵母生长速度,而酵母作为CO2供体促进藻类生长,二者共同使菌体量和油脂含量有明显提高。国内北京化工大学谭天伟等[43]也采用类似方法取得了良好效果,油脂产量达216 mg/L,分别是纯培养黏红酵母的5.42倍,螺旋藻的7.64倍。
5 结语
高原料成本而引起的高价格生物柴是影响整个产业普及和应用的关键因素。微生物油脂生产周期短、供给充足的优点使各国在油源选择的问题上逐步趋向一致,开发高油脂含量微生物资源、增加微生物的油脂产量、降低微生物产油成本等研究已成为当前共识。
欧美等国在高油量微生物资源开发研究中走在前列。以微藻为例,美国可再生能源实验室自1978年起就开展了海洋高产油脂藻类的大规模筛选研究,已从3 000多种产油藻类中筛选出近300种油脂含量超过50%的硅藻和绿藻。我国在这方面的研究还有待加强,油脂微生物资源的获取环境也需从土壤过度到深海、高山、冰川、极地等特殊环境。
基于代谢工程、基因工程等技术,人类已有了不少提高微生物油脂产量的调控策略,并进一步获得了一系列产脂肪酸、脂肪醇和脂肪酸乙酯的工程菌株。但多数调控策略的手段单一,导致其通用性差,在一个材料中有效而另一材料中无效的例子随处可见。如增加ACC表达量,可显著提高马铃薯的油脂含量,但对藻类却收效甚微[44]。而且现阶段产油微生物种类较多,各自遗传背景差异较大,也进一步增加了研究难度。因此,选择合适的宿主做模式,在适当改造的基础上综合各种调控策略,系统研究油脂合成、转运和氧化等步骤,将逐步受到重视和认可,并将成为今后研究的热点。本实验室已从深海中筛选出一批产油酵母,并对其中一株Y. lipolytica的产油模式和发酵过程进行了研究,由于该菌遗传背景相对清晰,本实验室试图将它改造成为酵母类油脂调控研究的参照物之一,相关的遗传改造工作正在进行。
综上所述,微生物油脂技术作为生物质能源研究中的重要内容,已逐步在生物柴油研究和应用中发挥关键作用,取得了很大进展。有理由相信,随着微生物油脂生产工业化、自动化和规模化程度的提高,微生物油脂将会越来越廉价,并最终解决生物柴油价格高的难题。
[1] JV G. Business management for biodiesel producers[R]. NREL Technical Report, 2004, NREL/SR-51036342.
[2] 童牧, 周志刚. 新一代生物柴油原料—微藻[J]. 农业工程技术(新能源产业), 2009(5):19-26.
[3] Xu H, Miao X, Wu Q. High quality biodiesel production from a microalga Chlorella protothecoides by heterotrophic growth in fermenters[J]. J Biotechnol, 2006, 126(4):499-507.
[4] Lin J, Shen H, Tan H, et al. Lipid production by Lipomyces starkeyi cells in glucose solution without auxiliary nutrients[J]. J Biotechnol, 2011, 152(4):184-188.
[5] Ratledge C, Cohen Z. Microbial and algal oils:Do they have a future for biodiesel or as commodity oils?[J]. Lipid Technol, 2008, 20(7):155-160.
[6] Meng X, Yang J, Xu X, et al. Biodiesel production from oleaginous microorganisms[J]. Renew Energ, 2009, 34(1):1-5.
[7] Papanikolaou S, Chevalot I, Komaitis M, et al. Single cell oil production by Yarrowia lipolytica growing on an industrial derivative of animal fat in batch cultures[J]. Appl Microbiol Biotechnol, 2002, 58(3):308-312.
[8] Zhu LY, Zong MH, Wu H. Efficient lipid production with Trichosporon fermentans and its use for biodiesel preparation[J]. Bioresour Technol, 2008, 99(16):7881-7885.
[9] Kaur P, Worgan JT. Lipid production by Aspergillus oryzae from starch substrates[J]. Appl Microbiol Biotechnol, 1982, 16(2):126-130.
[10] Ratledge C, Wynn JP. Advances in applied microbiology[M]. 1st editon. Calif:Academic Press, 2002:1-44.
[11] Alvarez HM, Steinbuchel A. Triacylglycerols in prokaryotic microorganisms[J]. Appl Microbiol Biotechnol, 2002, 60(4):367-376.
[12] Lee JY, Yoo C, Jun SY, et al. Comparison of several methods for effective lipid extraction from microalgae[J]. Microbiol Biotechnol, 2010, 101(Suppl 1):S75-S77.
[13] Mendes-Pinto M, Raposo M, Bowen J, et al. Evaluation of different cell disruption processes on encysted cells of Haematococcus pluvialis:effects on astaxanthin recovery and implications for bioavailability[J]. J Appl Phycol, 2001, 13(1):19-24.
[14] Moreau R, Hicks K. The composition of corn oil obtained by the alcohol extraction of ground corn[J]. J Am Oil Chem Soc, 2005, 82(11):809-815.
[15] Moreau R, Powell M, Singh V. Pressurized liquid extraction of polar and nonpolar lipids in corn and oats with hexane, methylene chloride, isopropanol, and ethanol[J]. J Am Oil Chem Soc, 2003, 80(11):1063-1067.
[16] Halim R, Gladman B, Danquah MK, et al. Oil extraction from microalgae for biodiesel production[J]. Bioresour Technol, 2011, 102(1):178-185.
[17] Izard J, Limberger RJ. Rapid screening method for quantitation of bacterial cell lipids from whole cells[J]. J Microbiol Methods, 2003, 55(2):411-418.
[18] Wang J, Li R, Lu D, et al A quick isolation method for mutants with high lipid yield in oleaginous yeast[J]. World J Microbiol Biotechnol, 2009, 25(5):921-925.
[19] Kimura K, Yamaoka M, Kamisaka Y. Rapid estimation of lipids in oleaginous fungi and yeasts using Nile red fluorescence[J]. J Microbiol Methods, 2004, 56(3):331-338.
[20] Chen W, Zhang C, Song L, et al. A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae[J]. J Microbiol Methods, 2009, 77(1):41-47.
[21] Montero MF, Aristizábal M, Reina GG. Isolation of high-lipid content strains of the marine microalga Tetraselmis suecica for biodiesel production by flow cytometry and single-cell sorting[J]. J Appl Phycol, 2010(1):1-5.
[22] Shin HY, Lee JY, Kim EJ, et al. Rapid quantification of lipids in Acremonium chrysogenum using Oil Red O[J]. Curr Microbiol, 2011, 62(3):1023-1027.
[23] Peng X, Chen H. Rapid estimation of single cell oil content of solid-state fermented mass using near-infrared spectroscopy[J]. Bioresour Technol, 2008, 99(18):8869-8872.
[24] Kamisaka Y, Noda N, Tomita N, et al. Identification of genes affecting lipid content using transposon mutagenesis in Saccharomyces cerevisiae[J]. Biosci Biotechnol Biochem, 2006, 70(3):646-653.
[25] 宋安东, 刘玉博, 谢慧, 等. 利用转座标签mTn-lacZ/leu2插入突变发酵性丝孢酵母2.1368-Leu筛选高效产油突变株[J].生物工程学报, 2011, 27(3):468-474.
[26] Davis MS, Solbiati J, Cronan JE, et al. Overproduction of acetyl-CoA carboxylase activity increases the rate of fatty acid biosynthesis in Escherichia coli[J]. J Biol Chem, 2000, 275(37):28593-28598.
[27] Klaus D, Ohlrogge JB, Neuhaus HE, et al. Increased fatty acid production in potato by engineering of acetyl-CoA carboxylase[J]. Planta, 2004, 219(3):389-396.
[28] Bouvier-Nave P, Benveniste P, Oelkers P, et al. Expression in yeast and tobacco of plant cDNAs encoding acyl CoA:diacylglycerol acyltransferase[J]. Eur J Biochem, 2000, 267(1):85-96.
[29] Beopoulos A, Nicaud JM, Gaillardin C. An overview of lipid metabolism in yeasts and its impact on biotechnological processes[J]. Appl Microbiol Biotechnol, 2011, 90(4):1193-1206.
[30] Courchesne NM, Parisien A, Wang B, et al. Enhancement of lipid production using biochemical, genetic and transcription factor engineering approaches[J]. J Biotechnol, 2009, 141(2):31-41.
[31] Beopoulos A, Mrozova Z, Thevenieau F, et al. Control of lipid accumulation in the yeast Yarrowia lipolytica[J]. Appl Environ Microbiol, 2008, 74(24):7779-7789.
[32] Dulermo T, Nicaud JM. Involvement of the G3P shuttle and betaoxidation pathway in the control of TAG synthesis and lipid accumulation in Yarrowia lipolytica[J]. Metab Eng, 2011, 13(35):482-491.
[33] Rangasamy D, Ratledge C. Genetic enhancement of fatty acid synthesis by targeting rat liver ATP:Citrate lyase into plastids of tobacco[J]. Plant Physiol, 2000, 122(4):1231-1238.
[34] Zhang Y, Adams IP, Ratledge C. Malic enzyme:the controlling activity for lipid production? Overexpression of malic enzyme in Mucor circinelloides leads to a 2.5-fold increase in lipid accumulation[J]. Microbiology, 2007, 153(7):2013-2025.
[35] Papanikolaou S, Sarantou S, Komaitis M, et al. Repression of reserve lipid turnover in Cunninghamella echinulata and Mortierella isabellina cultivated in multiple-limited media[J]. J Appl Microbiol, 2004, 97(4):867-875.
[36] 李永红, 刘波, 赵宗保, 等. 圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究[J]. 生物工程学报, 2006, 22(4):650-656.
[37] Wu S, Zhao X, Shen H, et al. Microbial lipid production by Rhodosporidium toruloides under sulfate-limited conditions[J]. Bioresour Technol, 2011, 102(2):1803-1807.
[38] Zhang G, French WT, Hernandez RE, et al. Microbial lipid production as biodiesel feedstock from N-acetylglucosamine by oleaginous microorganisms[J]. J Chem Technol Biotechnol, 2011, 86(5):642-650.
[39] Zhao CH, Cui W, Liu XY, et al. Expression of inulinase gene in the oleaginous yeast Yarrowia lipolytica and single cell oil production from inulin-containing materials[J]. Metab Eng, 2010, 12(6):510-517.
[40] Liang Y, Cui Y, Trushenski J, et al. Converting crude glycerol derived from yellow grease to lipids through yeast fermentation[J]. Bioresour Technol, 2010. 101(19):7581-7586.
[41] 林金涛, 沈宏伟, 张泽会, 等. 圆红冬孢酵母两阶段培养法生产微生物油脂[J]. 生物工程学报, 2010, 4(07):997-1002.
[42] Cheirsilp B, Suwannarat W, Niyomdecha R. Mixed culture of oleaginous yeast Rhodotorula glutinis and microalga Chlorella vulgaris for lipid production from industrial wastes and its use as biodiesel feedstock[J]. N Biotechnol, 2011, 28(4):362-368.
[43] 苗金鑫, 薛飞燕, 张栩, 等. 粘红酵母和钝顶螺旋藻混合培养生产微生物油脂培养基优化[J]. 生物加工过程, 2007(3):27-31.
[44] Dunahay T, Jarvis E, Dais S, et al. Manipulation of microalgal lipid production using genetic engineering[J]. Appl Biochem Biotechnol, 1996, 57(1):223-231.
(责任编辑 狄艳红)
New Biodiesel Raw Material— Microbial Lipid
Jia Bin1,2Wang Yanan2He Weihong2Liu Dehai2Xie Fuhong2Wang Jiwen2Feng Fei2Huang Ying1
(1. College of Life Science,Shenzhen University,Shenzhen 518061;2. Henan Key laboratory of microbe engineering,Zhengzhou 450003)
Biodiesel is an important approaches for substitution of fossil energy, however, high raw material cost restricts its further application. Microbial lipid is ideal biodiesel raw material because of its quality of sufficient supply, cheapness and none farmland consuming. In this paper, we summarized resent progress in microbial lipid extraction and determination, detailed reviewed the applications of transposon tagging, metabolic pathway control, transcription factor control and fermentation optimization in cellular lipid accumulation, discussed the possibility and advantages of biodiesel production using microbial lipid.
Microbial lipid Biodiesel Lipid determination Metabolism pathway control
2013-06-03
国家自然科学基金项目(31100582)
作者介绍:贾彬,男,博士,副研究员,研究方向:生物质能源;E-mail:Jiasanlin@gmail.com
