燕麦多酚纯化、发芽燕麦不同组分的多酚分布及抗氧化活性
2014-10-25付晓燕谢笔钧孙智达
付晓燕,隋 勇,谢笔钧,孙智达,*
(1.华中农业大学楚天学院食品与生物科技学院,湖北武汉 430205;
2.华中农业大学食品科技学院,湖北武汉 430070)
燕麦多酚纯化、发芽燕麦不同组分的多酚分布及抗氧化活性
付晓燕1,隋 勇2,谢笔钧2,孙智达2,*
(1.华中农业大学楚天学院食品与生物科技学院,湖北武汉 430205;
2.华中农业大学食品科技学院,湖北武汉 430070)
采用大孔树脂纯化与液相萃取相结合的方法,对燕麦多酚的纯化工艺进行优化,并对发芽燕麦不同组分的多酚分布及抗氧化活性进行研究。结果表明:采用AB-8大孔树脂,用体积分数70%乙醇洗脱,萃取前将溶液pH调至2,选择乙酸乙酯作为萃取溶剂,能够有效地分离纯化燕麦多酚。燕麦发芽后籽粒、芽和根中蒽酰胺的含量显著提高,且主要集中在乙醇洗脱组分中,水洗组分中含有一定量的酚酸类物质。还原力实验结果表明,在相同试样浓度下,蒽酰胺的抗氧化活性弱于酚酸。
燕麦,多酚,纯化,发芽,抗氧化活性
燕麦富含多种生物活性成分,具有抗氧化、降血脂等保健功能,酚类物质是燕麦抗氧化功能的最主要来源[1]。燕麦中的酚类化合物主要包括简单的酚类(如各种酚酸)、燕麦蒽酰胺和黄酮类化合物[2]。在燕麦中已经发现的酚酸有咖啡酸、阿魏酸、p-香豆酸、对羟基苯甲酸、香草酸、芥子酸、原儿茶酸、丁香酸、没食子酸、水杨酸、苯乙酸等[3-4]。燕麦蒽酰胺是一系列羟基肉桂酸及其衍生物和邻氨基苯甲酸及其衍生物通过酰胺键(-HNCO-)连接而成的物质,是燕麦中特有的抗氧化成分[5]。目前在燕麦中发现的蒽酰胺至少有24种,含量最高的是p-香豆酸、阿魏酸和咖啡酸分别与5-羟基邻氨基苯甲酸通过酰胺键连接而成的物质,简称2p、2f和2c[6-7]。燕麦中黄酮类化合物含量较少。研究证实燕麦酚类提取物对活性氧自由基具有较强的清除能力,能够抑制β-胡萝卜素褪色及亚油酸氧化,并能提高机体内超氧化物歧化酶和谷胱甘肽过氧化物酶的活性,是天然抗氧化剂的重要来源之一[7-9]。
发芽是无害化、低成本提升植物种子营养价值和功能性质的重要手段,研究表明燕麦发芽过程中酚类物质的含量显著提高,但对其分离纯化的研究还鲜有报道。大孔树脂具有吸附容量大、选择性强、再生方便等优点,液液萃取法工艺简单、成本低、能有效萃取出目标组分,二者被广泛用于天然产物的分离纯化[10-11]。本研究采用大孔树脂纯化与液液萃取相结合的手段,对燕麦多酚的纯化工艺进行了优化,并对发芽燕麦不同组分的多酚分布及抗氧化活性进行了研究,旨在为燕麦多酚的利用提供科学依据。
1 材料与方法
1.1 材料与仪器
晋燕八号裸燕麦 由山西省农科院高寒区作物研究所提供;Folin-Ciocalteau试剂 Sigma公司;AB-8、D101大孔树脂 南开大学化工厂;HP-20大孔树脂 上海摩速科学器材有限公司;ADS-17大孔树脂 天津市海光化工有限公司;甲醇、乙醇、没食子酸、碳酸钠、盐酸、乙酸乙酯、铁氰化钾、三氯化铁、三氯乙酸、磷酸氢二钠、磷酸二氢钠 均为分析纯。
250B生化培养箱 江苏金坛市宏华仪器厂;FD-1-50冷冻干燥机 北京博医康实验仪器公司;AC 210S电子天平 美国Sartorius Instrument Ltd;DK-98-IIA数显恒温水浴锅 天津市泰斯特仪器有限公司;RE111型旋转蒸发仪 瑞士Buchi公司;755B分光光度计、UV1700可见-紫外分光光度计 上海精制科学仪器厂。
1.2 实验方法
1.2.1 燕麦多酚的提取 准确称取一定量粉碎后的原样和6d籽粒置于带塞三角瓶中,按料液比1∶40(W/V)加入体积分数80%的乙醇溶液,置于50℃水浴摇床中浸提2h,提取结束后抽滤,将提取液于旋转蒸发仪上回收乙醇,得燕麦多酚浓缩液。
1.2.2 燕麦多酚的纯化 采用大孔树脂纯化与液相萃取纯化相结合的方法[12]。
1.2.2.1 大孔树脂的筛选 将相同浓度的燕麦多酚浓缩液分别通过相同体积和高度的大孔树脂D-101、AB-8、HP-20和ADS-17进行吸附,先用水洗至无糖,再用体积分数80%的乙醇洗脱至洗脱液无色为止,将洗脱液于50℃下真空浓缩,冷冻干燥后称重、测定总酚含量,计算总酚吸附率、解吸率和回收率,公式如下:

式中:B0—上柱总多酚量,mg;B1—水洗脱多酚量,mg;B2—乙醇洗脱多酚量,mg;Q1—吸附率,%;Q2—解吸率,%;R—总酚回收率,%。
1.2.2.2 乙醇体积分数的确定 将燕麦多酚浓缩液上AB-8大孔树脂,先用水洗至无糖,然后分别用体积分数30%、50%、70%和90%的乙醇洗脱至洗脱液无色为止,收集洗脱液,减压回收乙醇,真空冷冻干燥后称重、测定总酚含量,总酚回收率按公式(3)计算。
1.2.2.3 pH对萃取效果的影响 称取一定量的大孔树脂纯化产物,用一定体积蒸馏水溶解,分别用2mol/L盐酸将试样pH调至2、4和6,加入与试样相同体积的乙酸乙酯萃取3次,每次萃取时间为30min,收集乙酸乙酯相,回收有机溶剂,冷冻干燥后称重、测定总酚含量,计算总酚回收率,公式如下:

式中:C0—萃取前多酚量,mg;C1—有机相多酚量,mg;S—总酚回收率,%。
1.2.2.4 萃取溶剂的选择 称取一定量的大孔树脂纯化产物,用一定体积蒸馏水溶解,将试样pH调至2,分别加入与试样相同体积的氯仿、乙酸乙酯和正丁醇萃取3次,每次萃取时间为30min,收集有机相,回收有机溶剂,冷冻干燥后称重、测定总酚含量,总酚回收率按公式(4)计算。
1.2.3 总酚含量的测定 采用Folin-Ciocalteau法[13],准确吸取待测液0.1mL,依次加入6mL蒸馏水,0.5mL Folin-Ciocalteau试剂,混匀后加入20%的Na2CO3溶液1.5mL,充分混匀,定容10mL,在室温下静置1h后于765nm下测定其吸光度。以溶液浓度(mg/L)为横坐标,吸光度(A)为纵坐标,得回归方程为:y=0.0011x+ 0.008,R2=0.9999。
1.2.4 燕麦种子发芽实验 将燕麦种子用2%次氯酸钠溶液于室温下浸泡15min,洗去残余的次氯酸钠溶液,用蒸馏水浸渍种子于18℃生化培养箱中浸泡16~18h,将种子沥干后置于自制发芽盘中于18℃培养箱中连续发芽6d(前期研究表明发芽6d后总酚含量增长趋势逐渐变缓,故选取发芽6d样品进行后续实验),培养箱保持湿度在95%以上。将发芽6d的燕麦分为籽粒、芽和根3部分,于冷冻干燥机中干燥36h,备用。
1.2.5 发芽前后燕麦多酚不同组分的制备 称取一定量的未发芽燕麦种子、发芽6d的燕麦籽粒、芽和根,按图1流程对酚类物质进行提取纯化,得组分Ⅰ、Ⅱ和Ⅲ进行后续实验。
1.2.6 燕麦多酚的紫外可见光谱分析 取一定量原样、6d籽粒、6d芽和6d根的纯化产物(包括组分Ⅰ、Ⅱ和Ⅲ),分别用甲醇溶解,在紫外可见光谱仪上扫描,扫描波长为200~500nm。
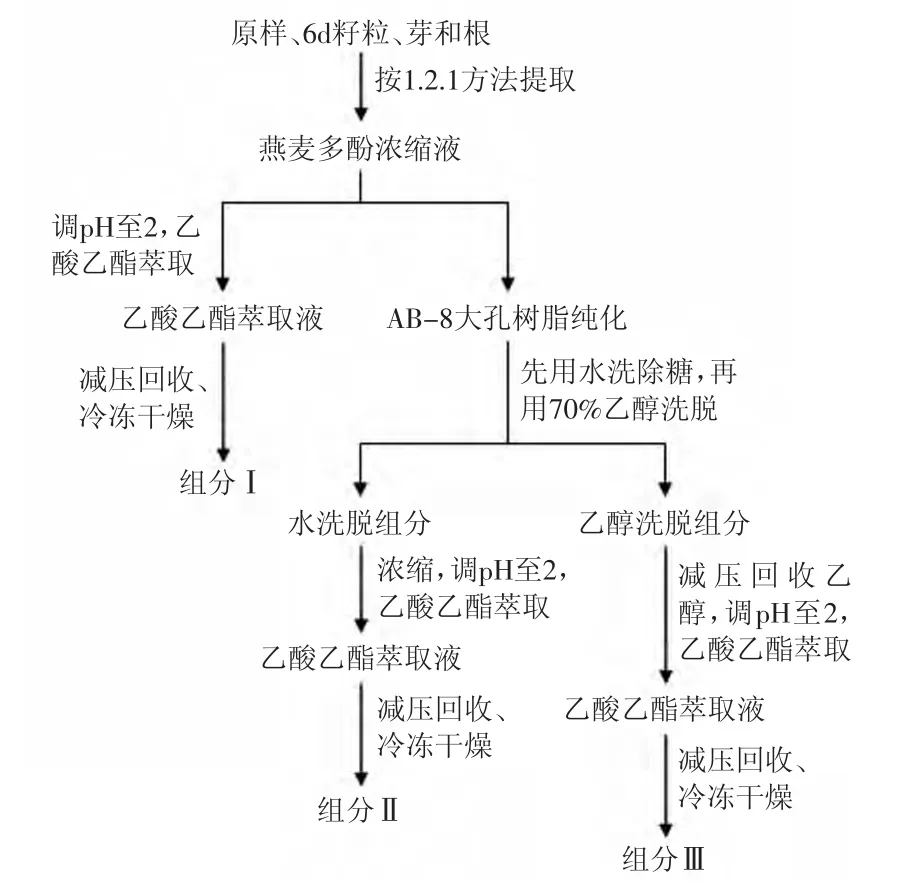
图1 燕麦发芽前后不同多酚组分的制备流程Fig.1 Preparation flow of different phenolic fraction separated from ungerminated and germinated oat
1.2.7 燕麦多酚还原能力的测定 采用Liu等[14]报道的方法,取不同浓度的样品溶液1.0mL,加入0.2mol/L,pH6.6的磷酸钠缓冲液1.0mL及1%的铁氰化钾溶液1.0mL,于50℃水浴反应20min后急速冷却,加入10%的三氯乙酸溶液1.0mL,3000r/min离心10min,取上清液2.5mL,加入蒸馏水2.0mL及0.1%三氯化铁溶液0.5mL,混合均匀,10min后于700nm处测定其吸光度,吸光值越大表示还原能力越强。
2 结果与分析
2.1 燕麦多酚的纯化
2.1.1 大孔树脂的筛选 由于大孔树脂的极性、孔径、比表面积、孔容等不同,故对某一类化学物质的吸附性能存在差异,从而达到分离纯化的目的。在本研究所选树脂中,D-101为非极性,AB-8为弱极性,HP-20为中等极性,ADS-17为极性[15]。由表1可以看出,AB-8型大孔树脂对燕麦多酚的吸附率和解吸率均较好,总酚回收率明显高于其他3种树脂,故采用AB-8型大孔树脂作为燕麦多酚分离纯化的柱填充材料较为适宜。
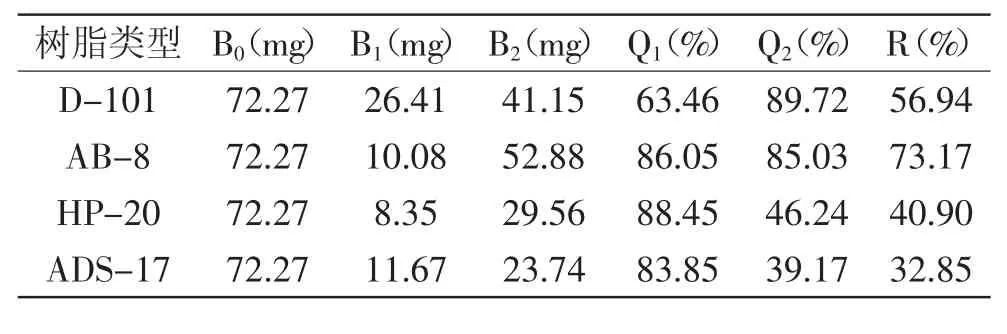
表1 四种大孔树脂对燕麦多酚的吸附分离性能比较Table 1 Comparison of adsorbing and separating capability of four types of maeroporous resin on oat phenols
2.1.2 乙醇洗脱浓度的确定 采用AB-8型大孔树脂作为柱材料,不同浓度乙醇对燕麦多酚的洗脱效果见图2。

图2 乙醇体积分数对总酚回收率的影响Fig.2 Effect of ethanol concentration on the recovery rate of total phenols
由图2可知,在一定范围内,随着乙醇浓度增加,总酚回收率逐渐提高。当用30%的乙醇洗脱时,总酚回收率只有47.19%,而当乙醇浓度提高到70%时,总酚回收率可达76.83%。再将乙醇浓度提高到90%,总酚回收率反而有所下降,这可能是由于燕麦多酚中含有某些极性物质,当乙醇浓度较高时,这些极性物质不易被洗脱。可见70%的乙醇可以作为对燕麦多酚比较适宜的洗脱溶剂,这与张守文等[10]的研究结果相一致。
2.1.3 pH对萃取效果的影响 对初步纯化产物采用有机溶剂进一步萃取纯化,pH对萃取效果的影响见图3。

图3 pH对总酚回收率的影响Fig.3 Effect of pH on the recovery rate of total phenols
由图3可以看出,当pH为2时,总酚回收率较高,约66.04%的多酚都能集中在乙酸乙酯层,随着pH的增大,乙酸乙酯相中的多酚含量越来越少,当pH为6时,总酚回收率仅有22.81%。由于燕麦中含有多种酚酸,在酸性条件下,羧基的解离倾向受到抑制,多酚更容易以分子的形式存在于溶液中[16],从而有利于乙酸乙酯的萃取,因此选择萃取前将样品溶液的pH调至2。
2.1.4 萃取溶剂的选择 由图4可以看出,3种溶剂对燕麦多酚回收率的大小顺序为:乙酸乙酯>正丁醇>氯仿,说明乙酸乙酯的极性与燕麦中酚类物质的极性较为接近,可以作为比较适合的萃取溶剂。

图4 萃取溶剂对总酚回收率的影响Fig.4 Effect of extraction solvent on the recovery rate of total phenols
2.2 燕麦发芽前后不同组分的多酚分布
对未发芽燕麦种子、发芽6d的燕麦籽粒、芽和根按1.2.5制备流程分别得到4个样品的组分Ⅰ、Ⅱ和Ⅲ,燕麦多酚在不同组分中的分布情况见表2。
由表2可以看出,未经大孔树脂处理的组分Ⅰ中总酚含量较高,经大孔树脂纯化后酚类物质有一定的损失,但对原样、6d籽粒和6d芽来说,大部分多酚存在于组分Ⅲ中,表明其可被70%乙醇溶液洗脱,水洗组分中损失的酚类物质较少。而在6d根中,水洗组分Ⅱ中总酚含量大于乙醇洗脱组分Ⅲ,说明根中可能含有大量极性较强的酚类物质,它们不能被弱极性的AB-8大孔树脂吸附而随着水流失掉。
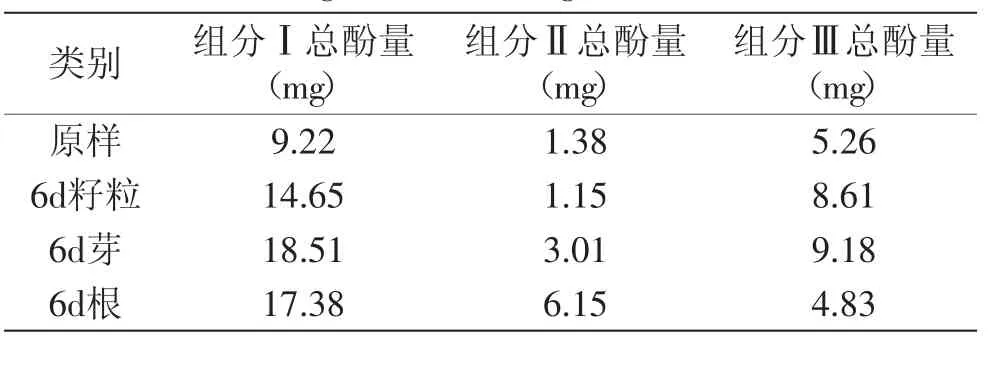
表2 燕麦发芽前后不同组分的多酚分布Table 2 Distribution of phenols in different fraction separated from ungerminated and germinated oat
2.3 燕麦发芽前后不同组分的紫外可见光谱分析
原样、6d籽粒、6d芽和6d根不同组分的紫外可见光谱图见图5。
由图5可知,原样组分Ⅰ的紫外光谱在280nm和320nm附近有较大的光吸收,符合酚类物质的光谱特征;而发芽后籽粒、芽和根的组分Ⅰ都在340nm附近出现了明显的吸收峰,这与燕麦蒽酰胺的光谱特征相吻合[17],表明燕麦发芽过程中蒽酰胺的合成量增加。此外,由4个样品组分Ⅱ和Ⅲ的光谱图可以看出,水洗组分Ⅱ只在280nm附近有比较明显的光吸收,340nm附近的吸收峰基本都集中在组分Ⅲ中,表明70%乙醇溶液能够较好的富集燕麦蒽酰胺,而随水流失掉的可能是一些极性较强的酚酸类物质。
2.4 燕麦发芽前后不同组分还原能力的比较
研究表明,抗氧化剂的还原力与其抗氧化活性之间普遍存在相关性,可通过测定还原力来表示抗氧化活性的强弱[18],结果见图6。
由图6可知,随着原样、6d籽粒、芽和根提取物浓度的提高,吸光度均增大,还原力增强,且吸光度值与浓度之间呈现良好的线性关系。通过对4个样品组分Ⅰ、Ⅱ和Ⅲ的还原力进行比较发现,在相同的试样浓度下,不同组分吸光度的大小顺序均为组分Ⅱ>组分Ⅰ>组分Ⅲ,表明含有极性酚酸的水洗组分还原能力最强,未经大孔树脂纯化的酚类物质混合组分还原能力次之,而燕麦蒽酰胺较为集中的乙醇洗脱组分还原能力最弱。蒽酰胺是燕麦发芽过程中大量合成的物质,也是燕麦所特有的抗氧化成分,但研究表明其抗氧化活性不如酚酸类物质,可能由于分子量普遍较大、结构较为复杂所致。
3 结论
通过对4种大孔树脂吸附分离性能的考察及对不同浓度乙醇洗脱效果的比较,确定AB-8作为分离纯化燕麦多酚的树脂,用体积分数70%的乙醇进行洗脱。对初纯物进一步考察溶液pH和不同溶剂对萃取效果的影响,确定萃取前将溶液的pH调至2,选择乙酸乙酯作为萃取溶剂。
对未发芽燕麦,发芽6d的燕麦籽粒、芽和根分别采用大孔树脂纯化与有机溶剂萃取得到组分Ⅰ、Ⅱ和Ⅲ,紫外可见光谱分析结果表明燕麦发芽过程中蒽酰胺的合成量增加,且蒽酰胺主要集中在乙醇洗脱组分Ⅲ中,水洗组分Ⅱ中含有一定量的酚酸类物质。还原力实验结果表明,在相同试样浓度下,不同组分还原力的大小顺序为组分Ⅱ>组分Ⅰ>组分Ⅲ,说明蒽酰胺的抗氧化活性弱于酚酸,这可能与其分子量和分子结构有关。

图5 燕麦发芽前后不同组分的紫外可见光谱图Fig.5 UV spectrogram of different fraction separated from ungerminated and germinated oat
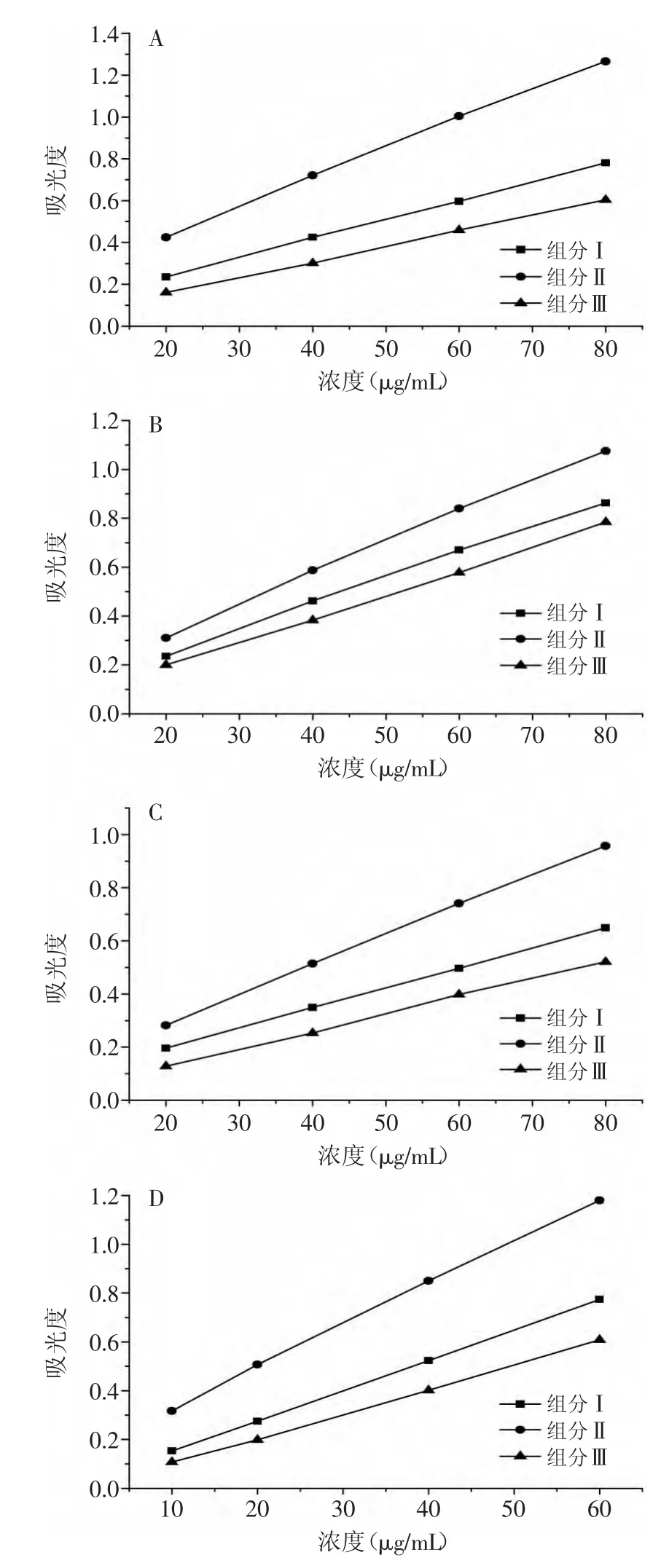
图6 燕麦发芽前后不同组分的还原能力Fig.6 Reducing power of different fraction separated from ungerminated and germinated oat
[1]汪海波,谢笔钧,刘大川.燕麦中抗氧化成分的初步研究[J].食品科学,2003,24(7):62-67.
[2]SKOGLUND M.Phenolic Compounds in oats--effects of steeping,germination and related enzymes[D].Uppsala:Swedish University of Agricultural Sciences,2008.
[3]PETERSON D M.Oat antioxidants[J].Journal of Cereal Science,2001,33(2):115-129.
[4]DOKUYUCU T,PETERSON D M,AKKAYA A.Contents of antioxidant compounds in Turkish oats:Simple phenolics and avenanthramide concentrations[J].Cereal Chemistry,2003,80(5):542-543.
[5]刘清,姚惠源.燕麦酚类抗氧化成分研究进展[J].粮食与油脂,2004(9):7-9.
[6]EMMONS C L,PETERSON D M.Antioxidant activity and phenolic contents of oat groats and hulls[J].Cereal Chemistry,1999,76(6):902-906.
[7]BRATT K,SUNNERHEIM K,BRYNGELSSON S,et al. Avenanthramides in oats(Avena sativa L.) and structureantioxidant activity relationships[J].Agriculture and Food Science,2003,51(3):594-600.
[8]PETERSON D M,HAHN M J,EMMONS C L.Oat avenanthramides exhibit antioxidant activities in vitro[J].Food Chemistry,2002,79(4):473-478.
[9]JI L L,LAY D,CHUNG E,et al.Effects of avenanthramides on oxidantgeneration and antioxidantenzyme activity in exercised rats[J].Nutrition Research,2003,23(11):1579-1590.
[10]张守文,王红,张娜.大孔树脂分离纯化燕麦麸皮多酚的研究[J].农产品加工·学刊,2013(3):21-24.
[11]李咏梅,王学松,艳春.茶叶中茶多酚的提取方法研究[J].广州化学,2003,28(1):59-63.
[12]张青松,李胜,吴媛媛,等.萃取法结合大孔树脂吸附在葡萄皮渣中提取纯化白藜芦醇的应用[J].食品工业科技,2009,30(8):227-228.
[13]PETERSON D M,EMMONS C L,HIBBS A H.Phenolic antioxidants and antioxidant activity in pearling fractions of oat groats[J].Journal of Cereal Science,2001,33:97-103.
[14]Liu Q,Yao H Y.Antioxidant activities of barley seeds extracts[J].Food Chemistry,2007,102:732-737.
[15]吴娜,张瑞巧,余婷,等.大孔树脂分离纯化艾蒿黄酮的研究[J].食品科技,2008,1:160-163.
[16]白蕾.海带多酚的分离提取及其抗肿瘤活性研究[D].大连:大连理工大学,2008.
[17]JONSSON K.Isolation and identification of three possible avenanthramide from oats that increase during germination[D].Uppsala:Swedish University of Agricultural Sciences,2006.
[18]杨小兰,田艳花,师成滨,等.啤酒花多酚的提取工艺及抗氧化活性的研究[J].食品科学,2006,27(10):297-302.
Purification of oat phenols,distribution of phenolic compounds and antioxidant activity of different fractions separated from germinated oat
FU Xiao-yan1,SUI Yong2,XIE Bi-jun2,SUN Zhi-da2,*
(1.College of Food&Biology Science and Technology,Chutian College,Huazhong Agricultural University,Wuhan 430205,China;
2.College of Food Science and Technology Huazhong Agricultural University,Wuhan 430070,China)
The purification technology of oat phenols by maeroporous resin and liquid extraction was optimizated in this article.On this basis,distribution of phenolic compounds and antioxidant activity of different fractions separated from germinated oat were studied.The optimum purification technology was as follows:maeroporous resin was chosen AB-8 using 70%ethanol as elution solvent.pH value was adjusted to 2 using ethyl acetate as extraction solvent.The content of avenanthramides from germinated oat grains,buds and roots increased obviously.Avenanthramides mainly exist in the ethanol fraction and some phenolic acids were lost with water. The reducing power experiment results indicated that the antioxidant activity of avenanthramides was lower than phenolic acids at the same concentration.
oat;phenols;purification;germination;antioxidant activity
TS210.1
A
1002-0306(2014)08-0083-05
10.13386/j.issn1002-0306.2014.08.009
2013-08-19 *通讯联系人
付晓燕(1985-),女,硕士研究生,研究方向:天然产物化学。
“十一五”国家科技支撑计划项目(2006BAD27B09)。
