蒙药参竹精片中总黄酮的含量测定
2014-03-17温爱平张秀艳邬卫东向萍陈晓霞
温爱平 张秀艳 邬卫东 向萍 陈晓霞
1.内蒙古医科大学药学院,内蒙古呼和浩特010110;2.内蒙古医科大学第一附属医院药剂部,内蒙古呼和浩特010050
蒙药参竹精片中总黄酮的含量测定
温爱平1张秀艳1邬卫东2向萍1陈晓霞1
1.内蒙古医科大学药学院,内蒙古呼和浩特010110;2.内蒙古医科大学第一附属医院药剂部,内蒙古呼和浩特010050
目的建立参竹精片中总黄酮的含量测定方法。方法采用超声法提取,利用黄酮类与NaNO2-Al(NO3)3-NaOH发生显色反应,以芦丁为对照品,采用分光光度法对不同批号参竹精片中总黄酮的含量进行测定。结果芦丁浓度在0.0102~0.0714 mg/mL范围内与吸收度呈良好的线性关系(r=0.9997),平均回收率为98.80%,RSD为0.86%(n=9)。结论该方法简便,重复性好,结果准确可靠,可作为参竹精片质量控制的方法。
参竹精片;总黄酮;分光光度法
蒙药参竹精片是由参竹精颗粒(蒙药名毛浩日查干-5)[1]改剂型而成的新药,是由手掌参、黄精、玉竹、何首乌(制)、广枣五味药材组成,主要用于肾寒、肾虚、精血不足、筋骨酸痛、年迈体弱等症状,具有补肾壮阳、滋补强身的功能[1]。据文献报道,参竹精片中的玉竹[2]、广枣[3]、何首乌(制)[4]、黄精[5]均含有黄酮类成分。总黄酮的含量测定方法有紫外-可见分光光度法[6-9]、荧光分光光度法[10]、高效液相色谱法[11-12]、薄层扫描法[13]、薄层-紫外分光光度法[14]、毛细管电泳法[15]等。有关参竹精片剂的定性定量报道有薄层鉴别[16]和大黄素的含量测定[17],但未见有关总黄酮的报道,本文采用分光光度法对参竹精片剂中总黄酮的含量测定方法进行研究,为参竹精片的质量控制及阐释其药效物质基础提供一定的科学依据。
1 仪器与试药
AgiLent 8453紫外-可见分光光度仪(美国安捷伦科技公司);DL-720D型数控超声仪(上海之信仪器有限公司);SARTORIUS-BS224S型电子分析天平(北京赛多利斯仪器系统有限公司);其他容量仪器均经过校正。
参竹精片(内蒙古元和药业有限公司生产,批号:120601、120602、140101、140102、140401、140402、140403、140404),芦丁对照品(中国药品生物制品检定所,批号:100080-200707);其他试剂均为分析纯。
2 方法与结果
2.1 定性鉴别
称取参竹精片剂粉末0.5 g,置具塞锥形瓶中,加入80%乙醇25 mL,密塞,超声处理30 min,滤过,滤液蒸去乙醇,加乙酸乙酯20 mL萃取,萃取液挥干,残渣加80%乙醇10 mL溶解,作为鉴别用溶液。
2.1.1 盐酸-镁粉反应取供试液1 mL,分置两支试管中,其中一支加入少量镁粉,并滴加浓盐酸数滴,同置于水浴上加热1 min后,取出观察,不加盐酸镁粉的溶液为黄色,加盐酸镁粉变为红棕色。
2.1.2 三氯化铝反应取供试液各1 mL,分置两支试管中,其中一支加入少量1%三氯化铝溶液,不加三氯化铝溶液为黄色,加三氯化铝溶液为黄绿色荧光。
2.1.3 氨水反应取供试液各1 mL,分置两支试管中,其中一支加少量氨水,不加氨水溶液为淡黄色,加氨水溶液为橙色。
2.2 定量测定
2.2.1 提取溶剂的选择取本品(批号:120601)粉末约0.25 g4份,精密称定,置具塞锥形瓶中,分别以甲醇、60%乙醇、80%乙醇和95%乙醇作溶剂,超声提取40 min,测定其含量。结果总黄酮含量分别为3.15%、3.44%、3.67%和1.37%。可见,采用80%乙醇作为提取溶剂总黄酮含量最高,故选择80%乙醇作为提取溶剂。
2.2.2 提取时间的选择取本品粉末(批号:120601)约0.25 g 4份,精密称定,置具塞锥形瓶中,精密加80%乙醇25 mL,分别超声处理20、30、40、60 min,测定其含量。结果总黄酮含量分别为2.98%、3.08%、3.67%、3.35%。可见,提取40 min总黄酮含量最高,故选定提取时间为40 min。
2.2.3 供试品溶液的制备取参竹精片10片,精密称定,研细,取粉末约0.25 g,精密称定,置具塞锥形瓶中,精密加入80%乙醇25 mL,密塞,称重,超声处理40 min,放冷,再称重,用溶剂补足减失重量,滤过,取续滤液作为供试品溶液。
2.2.4 亚硝酸钠用量的选择精密量取同一供试品溶液(批号:120601)5份各1 mL,置10 mL量瓶中,分别精密加5%亚硝酸钠溶液0.1、0.3、0.5、0.7、1.0 mL,混匀,放置6 min;精密加10%硝酸铝溶液0.3 mL,混匀,放置6 min;加1 mol/L氢氧化钠溶液4 mL,用80%乙醇稀释至刻度,混匀,放置15 min,测定含量,结果总黄酮含量分别为2.98%、3.30%、3.39%、3.37%和3.27%。可见,亚硝酸钠加0.5 mL时,总黄酮含量最高,故亚硝酸钠的加入量确定为0.5 mL。
2.2.5 硝酸铝用量的选择精密量取同一供试液(批号:120601)5份各1 mL,置10 mL量瓶中,精密加5%亚硝酸钠溶液0.5 mL,混匀,放置6 min;分别精密加10%硝酸铝溶液0.1、0.3、0.5、0.7、1.0 mL,混匀,放置6 min;加1 mol/L氢氧化钠溶液4 mL,用80%乙醇稀释至刻度,混匀,放置15 min,测定含量,结果总黄酮含量分别为2.98%、3.19%、3.36%、3.31%、3.28%。可见,10%硝酸铝加0.5 mL总黄酮含量最高,故选硝酸铝的加入量为0.5 mL。
2.2.6 氢氧化钠用量的选择取同一供试液(批号:120601)5份各1 mL,置10 mL量瓶中,精密加5%亚硝酸钠溶液0.5 mL,混匀,放置6 min;加10%硝酸铝溶液0.5 mL,混匀,放置6 min;分别精密加1 mol/L氢氧化钠溶液2、3、4、5、6 mL,用80%乙醇稀释至刻度,混匀,放置15 min,测定含量,结果总黄酮含量分别为2.34%、3.34%、3.66%、3.58%、3.37%。可见,氢氧化钠加4 mL时,总黄酮含量最高,故选氢氧化钠加入量为4 mL。
2.2.7 测定波长的选择精密量取供试品溶液l mL,按照上述条件显色后,在400~800 nm波长范围内进行光谱扫描,结果见图1。由图1可见,最大吸收波长在495 nm处,故选择495 nm为测定波长。
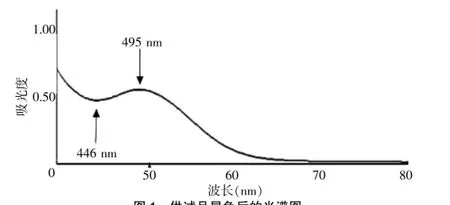
图1 供试品显色后的光谱图
2.2.8 标准曲线的制备精密称取于120℃干燥至恒重的芦丁对照品适量,加80%乙醇溶解并稀释成每1毫升含芦丁0.204 mg的溶液,作为对照品溶液。分别精密量取上述对照品溶液0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL,置10 mL量瓶中,精密加5%亚硝酸钠溶液0.5 mL,摇匀,放置6 min,精密加10%硝酸铝溶液0.5 mL,摇匀,放置6 min,再加1 mol/L氢氧化钠溶液4 mL,分别用80%乙醇至刻度,摇匀,放置15 min,以试剂为空白,照紫外-可见分光光度法,在495 nm的波长处测定吸光度,以浓度C(mg/mL)为横坐标,吸光度A为纵坐标,绘制标准曲线,见图2。以吸光度对浓度作线性回归,得回归方程:A=12.815C-0.0064(r=0.9997),可见浓度在0.0102~0.0714 mg/mL范围内,与吸光度呈良好的线性关系。

图2 芦丁标准曲线
2.2.9精密度试验取同一供试品溶液(批号:140404),按上述方法显色后,测定吸光度,连续测定6次,结果分别是0.609、0.609、0.607、0.608、0.608、0.608,平均值为0.608,RSD为0.14%。表明该法的精密度较好。2.2.10稳定性试验对显色后的供试品溶液(批号:140404),分别在0、10、20、30、40 min时测定吸光度,共测定5次,结果分别是0.609、0.603、0.599、0.590、0.580,平均吸收值为0.596,RSD为1.91%。结果表明:供试品溶液显色后在40 min内稳定。
2.2.11 重复性试验取本品(批号:140404)粉末约0.25 g 6份,精密称定,按“样品含量测定”项下操作,测定吸光度,计算含量,结果见表1。提示,该法的重复性较好。

表1 重复性试验结果
2.2.12 加样回收率试验取已知含量的参竹精片剂粉末(批号:140404,含量4.8%)约0.125 g 9份,精密称定,分别置具塞锥形瓶中,分别精密加入芦丁对照品适量(约相当于处方量的80%、100%、120%各3份),以下按“供试品溶液制备”项下操作,制备回收率测定溶液,并按“样品含量测定”项下操作,测定吸光度,计算回收率,结果见表2。

表2 加样回收率试验结果
2.2.13 样品含量测定精密量取供试品溶液1 mL,置10 mL量瓶中,按“标准曲线的制备”项下方法操作,以不加氢氧化钠的测定液为空白,测定吸光度,用回归方程计算样品中总黄酮含量,分别对8批参竹精片剂中总黄酮的含量进行测定,结果见表3。

表3 样品含量测定结果(n=3)
3 讨论
3.1 空白的选择
分别以试剂、供试品溶液和不加氢氧化钠的测定液作空白,在400~800 nm波长范围内进行光谱扫描,结果以试剂为空白,在此波长范围内无明显的吸收峰,其余两空白在500 nm左右均有吸收峰,且测定结果基本一致,因此本实验采用不加氢氧化钠的测定液作为空白。
3.2 研究意义
本研究首次采用紫外-可见分光光度法对参竹精片中总黄酮的含量进行了测定,通过方法学考察,表明该法简便、快速、测定结果准确可靠,为阐释蒙药参竹精片的药效物质基础及其质量控制提供科学依据,有关参竹精总黄酮的药效还有待于进一步研究。
[1]药典委员会.中国卫生部药品标准-蒙药分册[S].1998:127.
[2]黄海涛,杨铁金,李莉,等.采用高效液相色谱法分析不同产地玉竹中的黄酮成分[J].齐齐哈尔医学院学报,2013,34(6):852-853.
[3]舒亮,王二云,高晓慧,等.蒙药广枣总黄酮的提取及HPLC和LC-MS定性分析[J].中国民族医药杂志,2012,(3):41-43.
[4]董东,董顺福,韩丽琴,等.何首乌中总黄酮与微量元素含量分析及其药效机理研究[J].时珍国医国药,2008,19(9):2218-2219.
[5]陈克克,史丽,李莺,等.黄精总黄酮和总酚的含量测定[J].陕西农业科学,2012,(1):58-60.
[6]史国举.紫外-可见分光光度法测定复方红景天胶囊中总黄酮含量[J].中国医药科学,2011,1(14):45-46.
[7]黄荣,傅小红,常波.分光光度法测定火棘提取物中总黄酮[J].华西药学杂志,2013,28(6):642-643.
[8]段志涛,高英,霍文杰,等.桑白皮中总黄酮含量测定方法研究[J].中国实验方剂学杂志,2013,19(7):133-135.
[9]江秀娟,梁华伦,陈艳霞,等.小驳骨总黄酮含量测定及其提取工艺研究[J].今日药学,2014,24(4):258-261.
[10]马登磊,邵建群,何深知,等.荧光分析法测定元宝枫叶中总黄酮含量的研究[J].首都医科大学学报,2014,35(1):113-117.
[11]李小燕,潘洪平.高效液相色谱法测定复方银杏叶片中银杏总黄酮的含量[J].时珍国医国药,2007,18(7):1599-1600.
[12]韩成花,白玉华,于春燕,等.高效液相色谱法同时测定大庆马齿苋中山奈酚和槲皮素的含量[J].中国医药导报,2014,11(7):91-93.
[13]于玲,卢静华,姚丹.双波长薄层扫描法测定冬凌草片中总黄酮的含量[J].时珍国医国药,2008,19(3):686-686.
[6]封桂英.黄芩茎叶总黄酮对CIA小鼠细胞免疫功能的影响[D].承德:承德医学院,2013.
[7]黄贤荣,梁爱君,黄忠,等.黄芩茎叶药理作用研究进展[J].解放军药学学报,2012,28(3):264-268.
[8]朱晓.黄芩茎叶总黄酮对ox-LDL致人脐静脉内皮细胞氧化损伤的保护作用及机制研究[D].扬州:扬州大学,2013.
[9]杜庆波.黄芩药理活性研究新进展[J].齐齐哈尔医学院学报,2014,35(1):110-111.
[10]马森林.黄芩茎叶化学成分研究[D].石家庄:河北师范大学,2012.
[11]史高峰,祝娟娟,张兴潜,等.黄芩茎叶中总黄酮提取工艺优化[J].食品科学,2012,33(20):109-112.
[12]程齐来,黄志勤,杨韶平.黄芩苷提取工艺中提取溶剂的研究[J].时珍国医国药,2007,18(10):2481-2482.
[13]北京医学院,北京中医学院.中草药化学成分[M].北京:人民卫生出版,1980:293.
[14]黎万寿,陈幸.黄芩苷提取工艺研究[J].中草药,2000,31(2):107-108.
[15]田帅华,李钱.灯盏细辛中野黄芩苷提取纯化工艺研究[J].中成药,2010,32(1):124-127.
[14]吴可,谢朝晖,王芳.炮制对葛根中总黄酮及葛根素含量的影响[J].中国医药导报,2011,8(1):64-66.
[15]张颖,崔英杰,房信胜,等.毛细管电泳法同时检测南蛇藤中三种黄酮类活性成分[J].食品工业科技,2013,34(6):57-60.
[16]银金兰,丛素香,常绍琴.蒙药参竹精片质量研究中的薄层鉴别[J].中国民族医药杂志,2006,12(3):52-52.
[17]温爱平.高效液相色谱法测定蒙药参竹精片中大黄素的含量[J].现代中药研究与实践,2013,27(5):64-65.
(收稿日期:2014-08-07本文编辑:卫轲)
The determination of total flavonoids in Shenzhujing Tablet
WEN Aiping1ZHANG Xiuyan1WU Weidong2XIANG Ping1CHEN Xiaoxia11.College of Pharmacy,Inner Mongolia Medical University,Inner Monggol Autonomous Region,Huhhot010110,China;2.Department of Pharmacy,the First Affiliated Hospital of Inner Mongolia Medical University,Inner Monggol Autonomous Region,Huhhot010050,China
Objective To establish the method of determination for total flavonoids in Shenzhujing Tablet.Methods The ultrasonic extraction was used,and rutin was used as reference substance,colorimetry was used to determine the total flavonoids in Shenzhujing Tablet from different batches,by flavonoids and sodium nitrite-aluminum nitrate-sodium hydroxidc producing color under alkaline conditions.Results Rutin showed good linear relationship in the range of 0.0102-0.0714 mg/mL(r=0.9997),the average recovery was 98.80%,RSD was 0.86%(n=9).Conclusion The method is simple,reproducible,the results are accurately and reliable and can be used to quality control of Shenzhujing Tablets.
Shenzhujing Tablet;Total flavonoids;Colorimetry
R284.2
B
1673-7210渊2014冤11渊b冤-0087-04
2014-08-07本文编辑:卫轲)
内蒙古自治区卫生和计划生育委员会医疗卫生科研计划项目(编号201302051)。
温爱平(1962.1-),女,教授,硕士生导师,主要从事中蒙药质量研究。
邬卫东(1960.10-),男,主任药师,主要从事药品质量检验工作。
