碱皂化法提取麸皮中辅酶Q10的工艺研究
2014-03-15王丽霞何扩史忠林
王丽霞,何扩,史忠林
(河北北方学院农林科技学院,河北张家口075000)
碱皂化法提取麸皮中辅酶Q10的工艺研究
王丽霞,何扩,史忠林
(河北北方学院农林科技学院,河北张家口075000)
以麸皮为原料,利用碱皂化法提取辅酶Q10,紫外分光光度法测定含量。试验结果表明:最佳碱皂化处理条件为:pH为11,料液比1∶12(g/mL),皂化温度为90℃,皂化时间为90min。
麸皮;辅酶Q10;提取;皂化
近年来,辅酶Q10的生理功能不断地被发现,例如其抗氧化作用有利于预防动脉硬化、高血脂;在人体内节约和再生维生素E[1-3]。Lockwood等报道部分癌症患者通过服用一定量的辅酶Q10进行一年的治疗试验,病人均未发生肿瘤转移,其中有病例其肿瘤发生部分消退[4]。由此可见,开发辅酶Q10这一产品具有广阔的应用前景。国内外生产辅酶Q10,通常是在破碎细胞的基础上再用有机溶剂进行萃取,虽然工艺简单、耗能低且溶剂易回收,但提取物中包含的大量脂肪酸甘油酯及各种游离脂肪酸等杂质影响产品纯度[5]。用皂化法可以将上述杂质转移到水相,而脂溶性的辅酶Q10留在有机相。本实验以麸皮为原材料,采用酸破碎细胞直接皂化的方法,从而提高辅酶Q10的提取率。
1材料与方法
1.1 原料与试剂
麸皮:河北北方学院农学系;硫酸、氢氧化钠、石油醚:天津市北方天医化学试剂;无水乙醇:天津市凤船化学试剂科技有限公司。
1.2 仪器与设备
752紫外分光光度计、PHSJ-3F型pH计:上海精密科学仪器有限公司;HH-S数显恒温水浴锅:金坛市医疗仪器厂。
1.3 工艺流程
稀硫酸破碎麸皮组织→加热→加氢氧化钠溶液皂化→冷却→石油醚萃取3次→滤液用去离子水洗涤至中性→除水→加入无水乙醇后放入冰箱析出杂质→过滤得滤液→紫外分光光度法测量
1.4 酸消解碎细胞[6]
1)配置浓度为10-3mol/L即pH为3的稀硫酸溶液(用pH计测定并调整)备用;
2)用天平称量50 g麸皮组织加适量丙酮和碳酸钙充分研磨后放入500mL大烧杯中;
3)用量筒量取300mL上述已配置好的稀硫酸,也加入大烧杯内;
4)将大烧杯置于80℃水浴锅中密封加热90min;
5)待冷却后过滤用蒸馏水定容至500mL备用。
1.5 测定方法
采用紫外分光光度法来测定,具体做法参考文献[6]。
2结果与分析
2.1 单因素试验结果分析
2.1.1 皂化pH试验
取20mL 1.4所述备用液(相当于2 g麸皮)5组,在不同pH下的NaOH溶液进行皂化,pH值选取9、10、11、12、13 5个水平,设定料液比为1∶15(g/mL),皂化温度90℃,皂化时间100min。结果如图1所示。
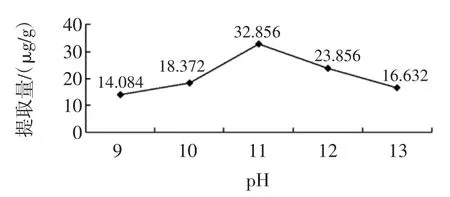
图1不同pH辅酶Q10的提取量Fig.1 Extracting quantity of Co Q10in different pH
图1 结果表明:当料液比、温度、时间相同时,pH为11时提取量最大,其次是pH为12,所以选取pH为11。
2.1.2 皂化料液比(g/mL)试验
取20mL 1.4所述备用液(相当于2 g麸皮)5组,分别取pH11为NaOH溶液4、10、20、30、40mL进行皂化,其pH11,皂化温度90℃,皂化时间100min。结果如图2所示。

图2不同料液比辅酶Q10的提取量Fig.2 Extracting quantity of Co Q10with different m aterial to liquor
图2 结果表明:在pH11,皂化温度90℃,皂化时间100min条件下,料液比为1∶15(g/mL)时提取量最高,其次是1∶10(g/mL)。所以选取料液比1∶15(g/mL)。
2.1.3 皂化温度试验
取20mL 1.4所述备用液(相当于2 g麸皮)5组,在pH为11,料液比1∶15(g/mL),皂化时间100min的条件下,设计不同皂化温度进行试验,结果如图3所示。
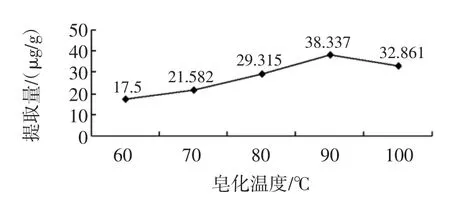
图3不同皂化温度辅酶Q10的提取量Fig.3 Extracting quantity of Co Q10with different saponification temperature
图3 结果表明:在pH11,料液比1∶10(g/mL),皂化时间100min条件下,温度为90℃时提取量最高,所以选取皂化温度90℃。
2.1.4 皂化时间试验
取20mL 1.4所述备用液(相当于2 g麸皮)5组,在pH为11,料液比1∶15(g/mL),皂化温度为90℃的条件下,选取最佳的皂化时间。结果如图4所示。

图4不同皂化时间辅酶Q10的提取量Fig.4 Extracting quantity of Co Q10with saponification time
图4 结果表明:在皂化温度为80℃时提取量最高。
2.2 正交试验
在单因素实验的基础上,以A皂化pH、B料液比(g/mL)、C皂化温度(℃)、D皂化时间(min)为四因素,设计L9(34)正交试验。正交试验因素水平见表1,结果见表2。

表1 试验因素水平表Tab le1 Levelsof factors in experim ent

表2 试验设计及试验结果Table2 Design and resu ltsof experim ent
从试验结果分析,温度对提取率影响最大,其次是料液比、pH。其中在pH为11,料液比1∶12(g/mL),皂化温度为90℃,皂化时间为90min时可得到最大的提取量,即最佳组合为A2B1C2D3。
2.3 验证试验
正交试验确定的最佳结果的提取量与正交试验结果的最优组合提取量比较结果见表3。

表3 提取量比较结果Table3 The resultsCompare
按正交试验确定的最优提取条件,在皂化pH11,液料比1∶12(g/mL),皂化温度90℃,皂化时间90min情况下,测得辅酶Q10的提取量为47.277μg/g,比正交试验结果中的较优组合A2B2C2D2的提取量高,表明此正交试验得出的最优组合是符合实际的。
3结论
利用高效液相色谱法来检测辅酶Q10的量比较精确,但是工序繁琐,耗费时间。虽然利用紫外分光光度计法检测辅酶Q10的值偏高于高效液相色谱法测定的含量,但是操作简单、快速,且紫外分光光度法和高效液相色谱法测定辅酶Q10具有良好的相关性,在一定程度上可以用紫外分光光度法来代替高效液相色谱法测定辅酶Q10的含量[7]。本实验采用紫外分光光度法测定了碱皂化法对辅酶Q10的提取效果,并优化了相关的提取条件,尽可能的利用皂化法去除杂质。通过本试验确定了利用碱皂化法提取麸皮中辅酶Q10的最佳条件是pH为11,料液比1∶12,皂化温度为90℃,皂化时间为90min。
[1]肖新才,冯翔.辅酶Q10抗氧化作用研究进展[J].国外医学卫生学分册,2003,30(4):216-221
[2]马菊,石宁.食品中应用辅酶Q10的研究进展[J].食品科技,2009,34 (2):18-21
[3]张鸿,吴玉荷.类维生素物质-辅酶Q10的研究进展[J].国外医学卫生学分册,2002,29(6):370-373
[4]Lockwood K,Mosegarard S,Wu Zu-fu.Apparent partial remission of breastcaneer in high risk[J].MolAspeetsMed,1994(15):231-240
[5]许忻,冀亚飞,陆瑾,等.3,4,5-三甲氧基甲苯的合成[J].精细石油化工,2001(5):43-45
[6]吕春茂,李英华,安艳秋,等.辅酶Q10几种提取工艺的优化研究[J].食品科学,2007,28(12):132-135
[7]许忻,冀亚飞,陆瑾,等.3,4,5-三甲氧基甲苯的合成[J].精细石油化工,2001(5):43-45
Extraction ofW heat Bran in the Alkaline Saponification of Coenzyme Q10
WANG Li-xia,HEKuo,SHIZhong-lin
(CollegeofAgrcultureand Forestry,HebeiNorth University,Zhangjiakou 075000,Hebei,China)
In thisexperiment,theauthorextractedandseparated coenzymeQ10fromwheatskinusing themethodof alkalinesaponification,and determined byUV.The resultsshowed thatthebestconditions foralkalisaponification:pH 11,ratioofmaterial to liquor1∶12(g/mL),reflux temperature90℃,saponification timeof90min.
wheatbran;coenzyme Q10;extraction;saponification
10.3969/j.issn.1005-6521.2014.011.010
2012-12-05
王丽霞(1981—),女(汉),讲师,研究生,研究方向:食品科学。
