锆催化添加剂对乙酸氧化动力学的影响
2014-03-14李柏春向若言
李柏春,魏 萌,向若言
(河北工业大学化工学院,天津 300130)
对二甲苯(PX)液相氧化大都以Co、Mn和Br作为催化体系[1~5],所采用的溶剂通常为乙酸,因为只有在羧酸作溶剂的体系中MC催化体系才有较高的催化活性。此外,乙酸是一种相对惰性的溶剂,易获得且价格适中, 所以适合应用于大规模的工业生产中[6]。 但是伴随着PX的氧化,部分乙酸也会同时被氧化而损失,这一损失不仅大大降低了整个反应过程的效率,提高了产品的生产成本,而且提高了反应系统中副产物的含量。影响乙酸氧化损失速率的因素很多,如氧分压、催化剂浓度、催化剂组成、促进剂浓度、液相水含量和反应温度等。对于乙酸氧化生成COx的反应机理,Ariko等[7-8]对其进行过一定量的研究工作;盖旭东[9]对影响醋酸氧化速率的因素进行了全面系统的分析,提出了一个动力学模型来定量地描述这一过程,但该研究只是以当时PX的工艺为研究对象,天津石化研究院在三井公司所开发工艺的催化剂基础上添加了过渡金属Zr和Ni,在保证了收率不变的情况下缩短了反应停留时间,提高了产量,其中Zr的效果更好,因此选用添加第三组分Zr来进行研究。但目前还没有系统分析Zr对乙酸液相氧化反应的影响,笔者旨在补充这方面的工作,为实际过程的工艺改进提供一定依据。
收稿日期:2014-03-03;修改稿收到日期:2014-04-30。
作者简介:李柏春(1963-),教授,从事新型分离工艺过程研究。E-mail:ctstlbc@163.com。
1 实验部分
1.1 主要实验药品
空气、氧气、氮气、醋酸(纯度≥99.5%)、Co(CH3COO)2·4H2O、Mn(CH3COO)2·4H2O、四溴乙烷(C2H2Br4,纯度≥98%)、中石化天津分公司芳烃部工业原料;锆离子(ZrO2溶于醋酸),16%,自制。
GXH-510型红外线分析仪,北京西比仪器有限责任公司。
1.2 实验装置
动力学反应实验装置为容量为500 mL的钛材质智能高压反应釜。设计压力0~3.5 MPa,釜内压力由背压阀控制。油浴升温,温度范围0~250 ℃,用热阻丝装置测定釜内温度,利用精密温控仪和循环冷却油协同控制反应釜温度,实验过程中温度波动范围控制在±0.5 ℃内,由数控仪显示温度示数。搅拌转速为0~1 000 r/min,搅拌器由磁力驱动器驱动,由数字智能控制仪控制转速并且显示转数。高压釜上有一个冷凝水进口,一个冷凝水出口,用来冷却磁力搅拌器,防止搅拌器摩擦过热。气体经过盘管冷凝器将醋酸冷凝回反应釜,用乙酸吸收罐吸收未冷凝的乙酸,再通过尾气进化罐,最后通入在线分析仪。如图1所示。
1.3 实验方法
准确称出一定量的乙酸、催化剂、水,将其投入高压釜中,密封好。通入氮气进行保护,当尾氧分析仪的读数变为0、压力为1.1 MPa时,开始加热升温,同时打开搅拌器使反应物料受热均匀。当反应釜温度达到指定温度时,切换为空气(或氧气),同时打开冷却油,控制反应温度,反应开始进行。当尾氧分析仪读数长时间无变化时切换为氮气,同时停止加热,反应结束。
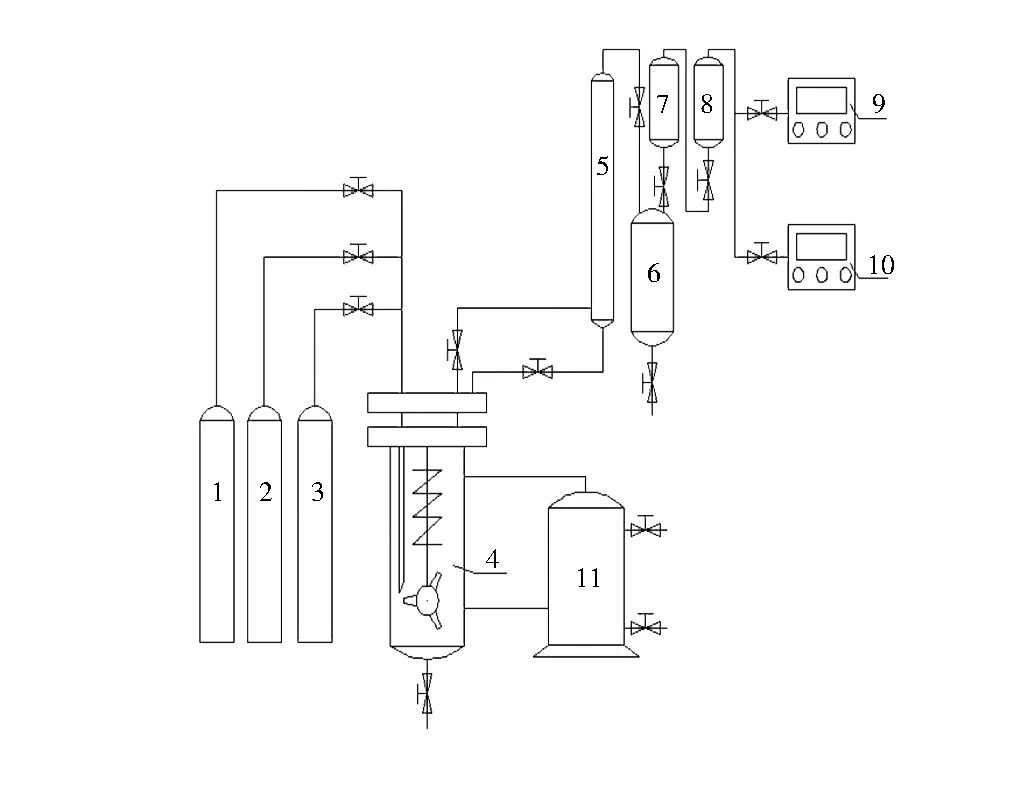
图1 装置流程1,2,3—空气、氧气氮气钢瓶;4—500 mL反应釜;5—冷凝器;6—吸收醋酸罐;7,8—尾气净化罐;9,10—CO2、CO、O2在线分析仪;11—循环冷却油罐
1.4 分析方法
采用GXH-510红外线气体分析仪分析尾气。
1.5 数据处理
在空气通量不变时,N2的量是固定的,故以N2为基准物质。因此COx的生成速率为:
其中,Ccox是分析仪测定值,空气通量单位为(L/min),反应速率以氮气量为基准。
2 反应机理与动力学模型的建立
2.1 乙酸液相氧化反应机理
Ariko[6]认为,乙酸溶剂会受到活泼自由基或高价态金属离子的攻击而失去氢,可分为两部分生成CH2·COOH和CH3COO·。

(1)

(2)
反应(2)发生几率较小,其中CH3COO·大部分夺取其他含氢反应物的氢原子还原成乙酸,少量的则发生脱羧反应生成CO2。反应(3)和反应(4)是一个平行反应过程, 按反应(3)进行反应的可能性比反应(4)要大。

(3)

(4)
反应(1)生成的CH2·COOH一般也会部分发生深度氧化生成CO、CO2和水。

(5)

(6)

(7)
反应(5)为控制步骤,从反应(7)可以得出乙酸燃烧副反应生成CO、CO2。
2.2 Zr的催化活化机理
Zr离子所拥有的催化活性和具有的强Lewis酸性密切相关的。Lewis酸性具有两方面的效应:一是本身就能够加速体系中某些分子内发生电子转移;二是Zr离子能够和钴、锰离子结合生成催化活性更高的簇合物,这种簇合物加速了某些中间产物的电子转移。
2.3 动力学模型的建立
总结以上部分可以推出:

(8)
该机理反应式复杂,若建立实用的数学模型需要进行简化,乙酸为溶剂,其浓度可看做定值。因此数学模型可简化为:
rcox=k[I·]n[O2]m
式中[I·]是指反应体系中的各种活泼自由基或高价态金属离子。动力学常数k与温度的关系符合Arrhenius方程,上式可表示为:
3 结果与数据处理
在研究各因素对反应的影响之前,做了预备实验。结果表明:当反应釜搅拌转速为800 r/min、空气进量为3 L/min时,基本消除了传质对反应的影响。
3.1 氧含量对乙酸液相氧化的影响
取在250 mL混合液、在m(PX)∶m(Hac)为1∶5、温度为187 ℃、压力为1.1 MPa、搅拌转速800 r/min、水含量为8%、m(Co)∶m(Mn)∶m(Br)=10∶5∶10(Co占溶液的质量分数为0.05%),保证通氧量一定的条件下,考察进气氧含量对乙酸燃烧反应的影响,结果如图2所示。
由图2可以看出:随着进气氧含量的增加,CO2、CO的生成速率并没有明显变化,说明在进气氧含量为21%~25%时,不影响乙酸的燃烧反应。因为在该条件下,氧的溶解与传递不再是该反应的控制步骤,所以进气氧含量已不再影响COx的生成速率。
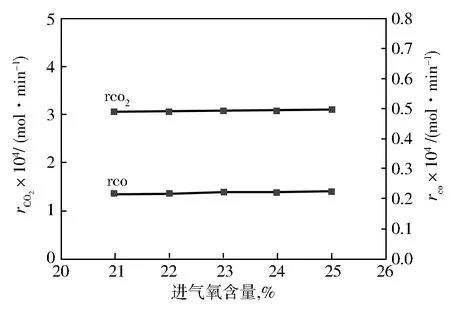
图2 氧含量对rCOx的影响
3.12反应温度的影响
其他条件不变的条件下,考察温度对乙酸燃烧反应的影响,结果如图3所示。
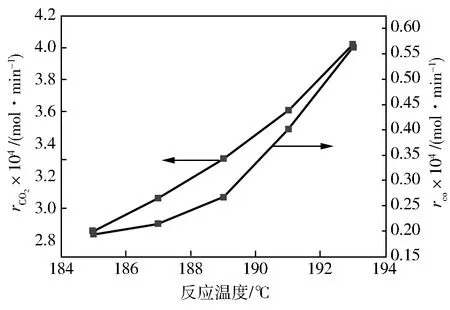
图3 反应温度对rCOx的影响
由图3可知:CO2,CO的生成速率随着温度的升高而明显升高。从185 ℃到189 ℃时,CO2、CO的增幅分别为15.9%和38.8%,而从189 ℃到193 ℃时,CO2、CO的增幅分别为21.6%和110.5%。可知温度的升高明显加剧了乙酸燃烧反应。
3.3 Zr添加剂的影响
MC催化体系有效的第四催化组分不断被发现, 其中最引人注目的是各种金属离子催化添加剂, 如Ni、Mo、Zr、Hf、Ce、Sm、K、Na 等金属可溶盐类化合物[10]。笔者研究的基础上研究了锆添加剂对乙酸损耗过程的影响。
固定其他反应条件,考察不同Zr浓度对乙酸燃烧反应的影响,实验结果如图4和图5所示。
由图4可以看出:随着Zr添加剂质量分数为(50~80)×10-6时,CO2的生成速率明显增加,当Zr质量分数为(80~150)×10-6时,CO2的生成速率无明显变化,这有可能与Zr的强L酸性质有关。只需添加一定量的Zr,其活性就能达到反应的需求。由图5可以看出:CO的生成速率随着Zr浓度的增加而增加,图4、图5再一次印证了温度对醋酸燃烧的影响比较显著,80 ×10-6Zr添加剂下,醋酸氧化反应温度从187 ℃到189 ℃,CO2和CO的生成速率分别增加了31.76%、20.04%。
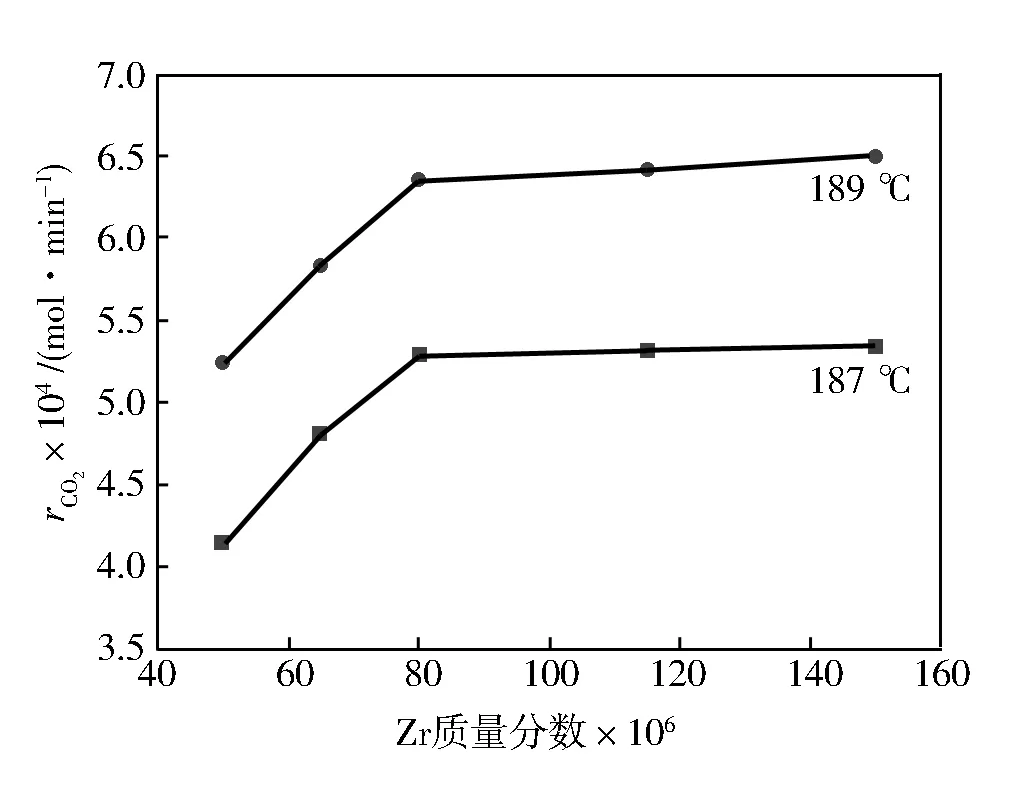
图4 Zr浓度对rCO2的影响

图5 Zr浓度对rCO的影响
3.4 模型参数回归
根据动力学模型(10)式,利用matlab软件用最小二乘法[11]进行非线性回归,得到了富氧、Zr催化添加剂,在温度分别为185,188 ℃,191,194 ℃条件下醋酸液相氧化的动力学方程:
CO2的生成速率:
(4)
CO的生成速率:
(5)
为验证所得动力学模型的可信度,选取187 ℃和189 ℃时的动力学模型计算值与实验值进行比较。由图6、图7所示,其相关系数分别为0.946和0.995,说明得到的动力学模型合理可用。
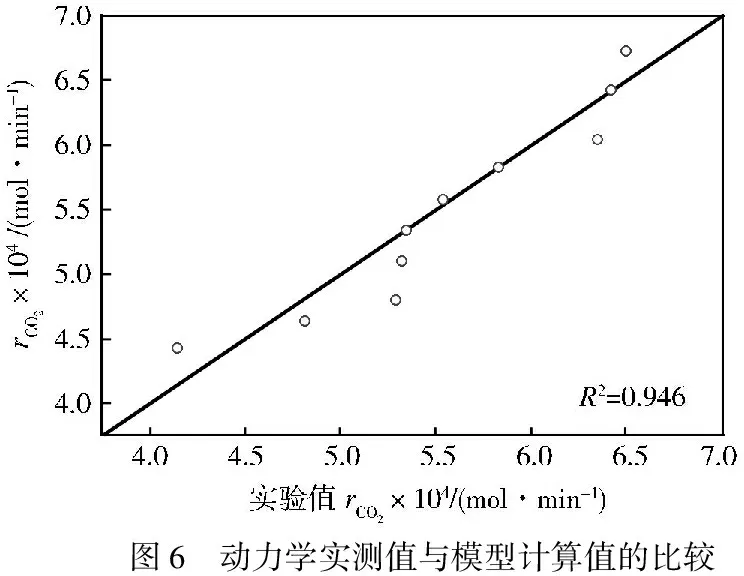
图6 动力学实测值与模型计算值的比较
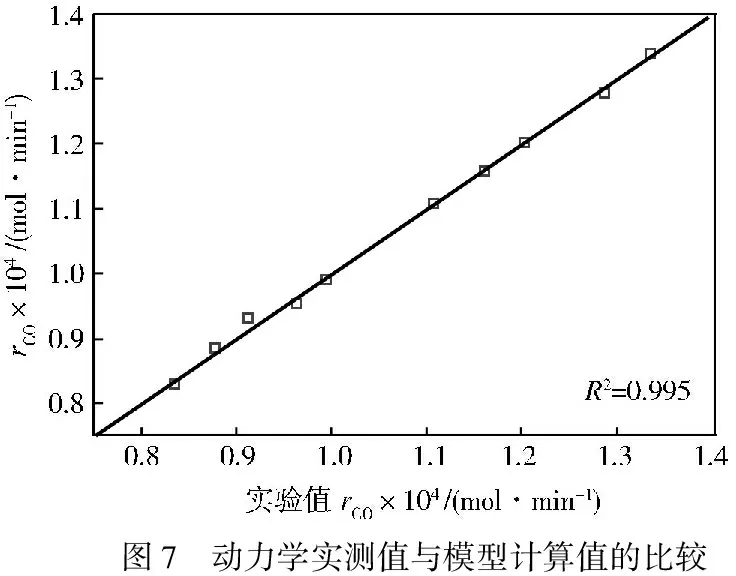
图7 动力学实测值与模型计算值的比较
4 结 论
a.进气氧含量为21%以上时,氧的溶解与传递不再是该反应的控制步骤。其大小已不再影响COx的生成速率。
b.乙酸的氧化受温度的变化比较显著,因此降低温度能够有效的降低乙酸的氧化损失速率。
c.乙酸的氧化损失速率随着Zr浓度的增加而先快速增加后缓慢增加,这可能与Zr的强L酸性质有关。
d.得到了富氧Zr添加剂下简单的COx的生成速率方程。为PX氧化工艺改进提供一定依据。
参 考 文 献
[1] Hindmarsh E, Turner J A, Ure A M. Process for Producing an Aromatic Carboxylic Acid[P].US, 5510521. 1996-04-23
[2] Hindmarsh E, Turner J A, Ure A M. Process for Producing an Aromatic Carboxylic Acid: US, 5510521[P]. 1996-04-23.
[3] Sheppard R B, Sumner C E, Tennant B A. Two Stage Oxidation Process for Production of Aromatic Dicarboxylic Acid: WO, 02098834[P]. 2002.
[4] Sheppard R B, Tennant B A, Woodruff T E. Process for the Oxidative Purification of Terephthalic Acid: WO, 04052822[P]. 2004.
[5] 刘悦.中纯度对苯二甲基生产技术[J].合成纤维工业, 1999, 22(1): 36-38.
[6] 成有为,王丽军,谢刚. MC(Mid Century)催化氧化过程的研究进展[J]. 化工进展, 2005, 24(8): 837-840.
[7] Ariko N G. Effect of Deuteration of Solvent on Process of Catalytic Oxidation of Xylene and Associated Decarboxylation of Acetic Acid Kinetics and Catalysis[J]. Oxidation Communication, 1992, 32:757-761.
[8] Hronec M, Gvengrosoca Z. Study ofp-xylene reaction with Co-Br-pyridine catalyst: Part I. Reaction in acetic acid[J]. Journal of Molecular Catalysis, 1986, 37(2-3): 349-358.
[9] 盖旭东.乙酸液相催化氧化动力学的研究[J].化学反应工程与工艺,1994,10(2):132-138.
[10] 成有为,李希,司马坚.对二甲苯液相催化氧化动力学研究(Ⅳ)[J].化工学报,2004, 55(11):1894-1899.
[11] Nelder J A, Mead R. A simple method for function minimization[J]. Comput, 1965,7(4):308-313.
