母猪饲粮中添加精氨酸对仔猪肠道免疫细胞数量的影响
2014-03-14佳琪
寇 涛 吕 佳琪 李 伟 王 恬
(南京农业大学动物科技学院,南京 210095)
仔猪初生重是后天生长发育的一项重要指标,宫内发育迟缓(intrauterine grow th retardation,IUGR)可多方面影响出生后的生长发育。肠道是动物消化吸收的主要场所,也是体内最大的免疫器官,因此增强仔猪肠道免疫功能是提高机体抗病力、促进仔猪健康发育的重要手段。研究发现,饲粮中添加酶制剂、酸化剂、中草药、寡糖和谷氨酰胺等营养物质可改善仔猪肠道环境,增强机体免疫功能[1-2]。精氨酸(Arg)具有重要的生理代谢和营养作用,在促进肌肉蛋白质合成、增强机体的免疫力和细胞分裂等生理过程中具有重要的作用,并且Arg是幼龄哺乳动物达到最大生长性能所必需的一种氨基酸[3-4]。而猪胚胎在宫内发育过程中处于Arg营养缺乏状态。Wu等[5]的研究发现,精氨酸氮在羊水、尿囊液中占总氮的比例很高,这提示Arg代谢在宫内营养中占有重要地位。有报道称Arg强化的肠内营养可增加肠黏膜厚度及小肠绒毛数量,降低肠黏膜的通透性,减少肠道细菌易位的机会[6]。但目前有关于Arg的母体效应对IUGR仔猪空肠及回肠内免疫细胞数量的研究报道不多,因此,本试验通过在妊娠母猪饲粮中添加1%Arg测定其后代中IUGR仔猪的生长性能、小肠中免疫细胞的数量来研究Arg的母体效应对IUGR仔猪肠道的调控作用,为该方面的研究提供理论依据。
1 材料与方法
1.1 试验动物、饲养管理及分组
本试验选取妊娠母猪(长白×大白,试验开始于妊娠30 d)20头,随机分2组饲养,分别为基础饲粮组和基础饲粮添加1%Arg组,每组10头母猪,母猪单栏饲养,自由采食。待母猪产后,从基础饲粮组母猪所生产仔猪中选8头正常初生重母猪和8头IUGR母猪,分别为对照组和IUGR组,从基础饲粮添加1%Arg组母猪所生产仔猪中选8头IUGR母猪,为Arg+IUGR组,共3组,每组4个重复,每个重复2头仔猪,各组仔猪随母猪哺乳至屠宰。IUGR仔猪选择标准为初生重低于平均值的2个标准差。母猪基础饲粮组成及营养水见表1。
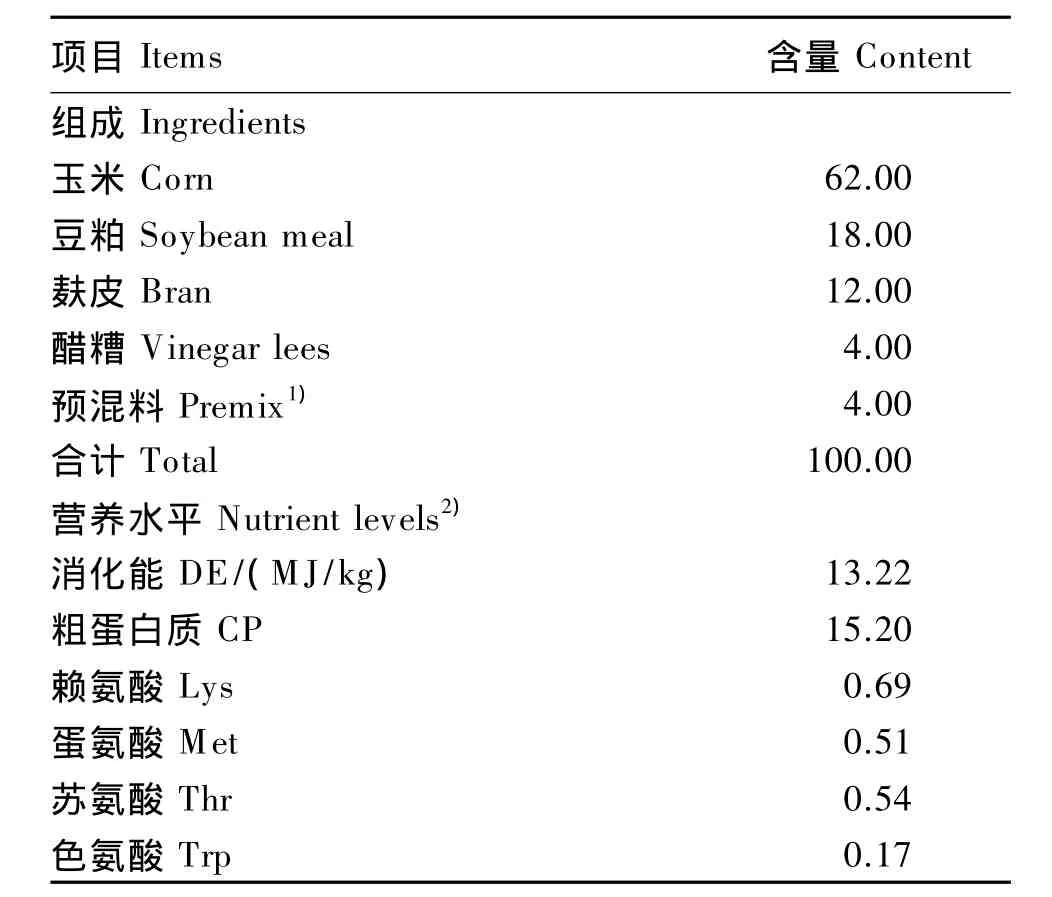
表1 母猪基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet for sow s(air-dry basis) %
1.2 样品采集
仔猪在屠宰前(7及21日龄)进行称重,每组各选取4头仔猪进行屠宰。屠宰前12 h停食,随后颈动脉放血致死,迅速打开腹腔,取出肠道,用磷酸盐缓冲液(PBS)冲洗,从小肠中分离出空肠和回肠。在各段肠道1/2处取1.5 cm的肠段并用4%的多聚甲醛进行固定。
1.3 肠道组织形态学观察
1.3.1 制作石蜡切片
组织样用多聚甲醛固定24 h后,制作石蜡切片。组织切片程序为:取材固定8~12 h→修样→洗涤→70%酒精脱水45~60 m in→85%酒精脱水45~60 m in→95%酒精脱水45~60 m in→100%酒精脱水2次→透明(二甲苯15~20 m in)2次→透蜡3次,各40 m in→包埋→切片→贴片→烤片。
1.3.2 石蜡切片染色
1.3.2.1 阿利新兰-高碘酸雪夫氏(AB-PAS)染色
染色程序为:切片脱蜡至水→入0.5%~1.0%高碘酸水溶液氧化5 m in→蒸馏水速洗1次→Schiff氏液染色30~60 m in→经 Schiff氏液后,以亚硫酸水洗2~3次,每次约30 s至1m in→蒸馏水速洗2次→苏木精复染核→苏木精复染色后,经0.5%盐酸酒精溶液分色(5~10 s),以镜检为准,用自来水蓝化→经95%酒精及其无水酒精脱水,各1~2 m in→二甲苯透明→中性树胶封固。ABPAS染色主要用于观察杯状细胞。
1.3.2.2 甲苯胺蓝染色
染色程序为:切片脱腊至水→蒸馏水浸洗3次→切片从水中取出,甲苯胺蓝液浸染30 s→蒸馏水浸洗(洗净甲苯胺蓝染液为止)→95%酒精分色,在镜下观察控制→100%酒精脱水→二甲苯透明→中性树胶封固。甲苯胺蓝染色主要用于观察肥大细胞。
1.3.3 肠道免疫细胞的观察与计数
在Nikon ECLIPSE-80i和Olympus BX-51显微镜光镜下分别详细观察和检测每组的空肠和回肠黏膜上皮肥大细胞和杯状细胞数量和分布。具体检测方法是:1)统计观察每根肠管横断面的肠壁全层,包括黏膜及黏膜下层、肌层及浆膜层的肥大细胞数量和分布;2)取每根肠管横断面,统计观察5根最长且排列整齐的绒毛,计数每100个肠黏膜上皮柱状细胞间内杯状细胞的数量和分布。
1.4 数据统计
试验结果用平均值±标准误表示,采用SPSS 16.0软件进行组间方差分析和多重比较。以P<0.05作为差异显著的判断标准,以 P<0.01作为差异极显著的判断标准。
2 结果与分析
2.1 母猪饲粮中添加Arg对仔猪平均日增重的影响
在整个试验期间各组均无仔猪死亡。由表2可知,Arg+IUGR组仔猪初生重极显著低于对照组和 IUGR 组(P<0.01),但 Arg+IUGR 组与 IUGR组仔猪7及21日龄体重差异不显著(P>0.05);IUGR组和Arg+IUGR组仔猪1~7日龄平均日增重均显著低于对照组(P<0.05);各组仔猪8~21日龄及1~21日龄平均日增重均差异不显著(P>0.05),且Arg+IUGR组仔猪平均日增重高于 IUGR 组,分别比 IUGR 组提高14.29%和10.53%,但差异不显著(P>0.05)。
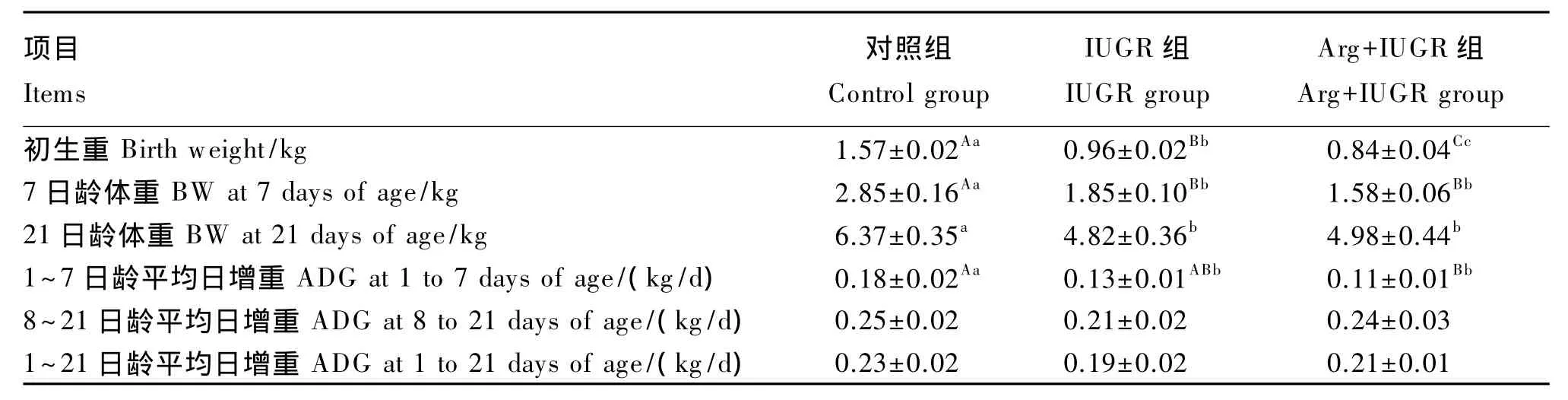
表2 母猪饲粮中添加Arg对仔猪平均日增重的影响Table 2 Effects of sow diet supplemented w ith Arg on average daily gain of piglets
2.2 母猪饲粮中添加Arg对肠道黏膜免疫细胞的影响
2.2.1 小肠黏膜上皮肥大细胞的数量分布变化
由表3可知,对于7日龄仔猪,Arg+IUGR组空肠肥大细胞数量极显著高于对照组和IUGR组(P<0.01),分别提高 94.29%和 140.40%;各组回肠肥大细胞数量差异不显著(P>0.05),Arg+IUGR组较IUGR组肥大细胞数量有所提高,但低于对照组(P>0.05)。
对于21日龄仔猪,Arg+IUGR组空肠肥大细胞数量较对照组和IUGR组分别提高45.09%和50.46%,差异显著(P<0.05),但对照组和 IUGR组之间差异不显著(P>0.05);回肠肥大细胞数量各组间差异不显著(P>0.05),但 Arg+IUGR组的细胞数量比对照组和IUGR组有所提高。
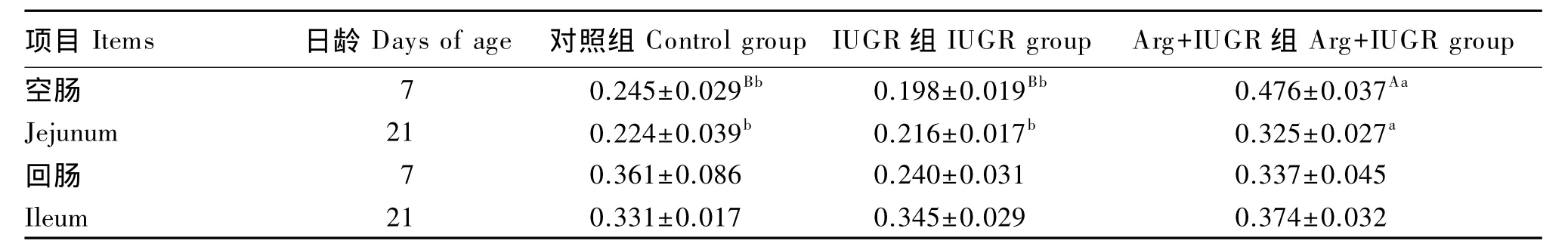
表3 仔猪小肠黏膜上皮肥大细胞数量Table 3 The number of intestinalmucosa epithelialmast cells of piglets 个/1 000μm2
图1中箭头所指细胞为上皮内肥大细胞,经甲苯胺蓝染色后,肥大细胞呈紫红色;形状多样,有圆形、椭圆形或梭形,大小不一。胞浆内颗粒丰满,部分细胞呈脱颗粒状。

图1 各组7日龄仔猪空肠及回肠黏膜上皮肥大细胞Fig.1 The jejunum and ileum mucosamast cells of piglets at 7 days of age in each group(×40)
2.2.2 小肠黏膜上皮杯状细胞的数量分布变化
由表4可知,对于7日龄仔猪,IUGR组空肠杯状细胞数量显著低于对照组(P<0.05),Arg+IUGR组与IUGR组相比杯状细胞数量提高了37.76%,但差异不显著(P>0.05);Arg+IUGR 组回肠杯状细胞数量极显著高于IUGR组(P<0.01),并且提高至与对照组差异不显著(P>0.05)。
对于21日龄仔猪,Arg+IUGR组空肠杯状细胞数量与对照组相比差异不显著(P>0.05),但与IUGR组相比得到显著提高(P<0.05)。Arg+IUGR组回肠杯状细胞数量显著高于IUGR组(P<0.05),也高于对照组,但差异不显著(P>0.05)。

表4 仔猪小肠黏膜上皮杯状细胞数量Table 4 The number of intestinalmucosa epithelial goblet cells of piglets 个/100 columnar cells
图2中箭头所指细胞为上皮内杯状细胞,杯状细胞散在分布于柱状细胞之间,一般靠近肠腺部位分布集中。杯状细胞排列紧密,靠近绒毛顶端的杯状细胞呈散在分布;经AB-PAS染色后杯状细胞呈紫红色,高脚杯状。

图2 各组7日龄仔猪空肠及回肠黏膜上皮杯状细胞Fig.2 The jejunum and ileum mucosa epithelial goblet cells of piglets at7 days of age in each group(×40)
3 讨论
3.1 母猪饲粮中添加Arg对仔猪平均日增重的影响
新生仔猪的胃肠道在短期内迅速发育,但IUGR仔猪消化器官的发育程度普遍不及正常仔猪,IUGR后代的消化器官较小,并伴有消化系统功能障碍,常造成生长缓慢或死亡[7-8]。Arg对于幼龄仔猪是一种必需氨基酸,Arg缺乏是限制哺乳仔猪获得最佳生长性能的主要因素。但内源合成的Arg不能使早期断奶的仔猪达到最佳生长性能,Arg的供应可能会促进新生仔猪的生长性能达到最佳[9]。研究表明在哺乳母猪饲粮中分别添加0.80%Arg 和 0.03%、0.06%精氨酸生素降低了母猪血浆尿素氮含量,提高了仔猪断奶窝重和断奶均重[10]。
Mateo等[11]发现在妊娠 30~114 d的母猪饲粮中添加1%Arg可以防止IUGR的发生,从而使活仔数增加22%,窝产平均活仔数从9.37头提高到11.40头。而王琤[12]在妊娠期母猪饲粮中添加1%Arg后能有效提高初生仔猪窝产活仔数和成活率。本试验发现Arg+IUGR组仔猪初生重极显著低于IUGR组与对照组,这可能是由于Arg的母体效应提高了母猪窝产仔猪数,导致妊娠期间IUGR仔猪通过胎盘获得母体营养相对减少,从而加剧了IUGR仔猪的营养不良,导致初生重显著降低。但本试验结果显示Arg+IUGR组仔猪在7和21日龄体重提高至与IUGR组差异不显著;并且8~21日龄、1~21日龄的平均日增重3组间差异不显著,尤其与对照组差异不显著,这提示Arg的母体效应对IUGR的发育具有补偿生长的作用。Arg的母体效应对仔猪组织器官发育造成影响的同时,亦可能改变仔猪的代谢程序化模式,有研究发现母猪妊娠期营养素水平显著影响了子代猪血清胰岛素样生长因子-Ⅰ(IGF-Ⅰ)、生长激素、瘦素、胰岛素等激素水平。而Arg可促进胰岛素、生长激素、泌乳素和IGF-Ⅰ的分泌,这些激素参与了Arg对仔猪免疫功能的调节作用[13]。并且饲喂Arg的母猪妊娠期间产生的IGF-Ⅰ可以增加仔猪的体重并且增强胎盘的转运能力,通过影响胎盘的活性改变仔猪的生长发育。Arg的母体效应可能通过影响IGF-Ⅰ及IGF-Ⅰ受体 mRNA转录后的加工而提高产后IUGR仔猪IGF-Ⅰ基因的表达及增加可与IGF-Ⅰ结合而发挥生物学效应的受体的量,通过IGFs家族的协同作用,对仔猪补偿生长起促进作用[14]。此外,Arg也参与了DNA的甲基化过程,从而影响印记基因的甲基化状态,导致印记基因胰岛素样生长因子-Ⅱ(IGF-Ⅱ)在IUGR仔猪体内表达水平升高,促进了Arg+IUGR组IUGR后天的补偿生长。这可能是Arg的母体效应导致IUGR仔猪发生补偿生长的原因,但是具体机制还有待进一步研究确认。
3.2 母猪饲粮中添加Arg对仔猪肠道免疫细胞数量的影响
肠道的屏障功能主要由肠黏膜屏障来实现的,包括机械屏障、生物屏障、化学屏障、免疫学屏障和肠黏膜固有层筛等部分[15]。Gaskins[16]报道,肠上皮细胞是仔猪抵抗饲料毒素及外来致病菌的第一道防线,其表面含有毒素及细菌受体,且包含具有一定免疫功能的淋巴细胞和杯状细胞。Ziegler等[17]发现仔猪断奶前肠道的发育主要依赖细胞的增殖。而IUGR会导致肠道上皮细胞凋亡增多,造成肠道生长和形态发生改变。由于Arg及其代谢产物如一氧化氮,在免疫防御和调节、肠道黏膜功能的保护以及肿瘤特异性免疫等方面发挥着重要作用,因此可将Arg添加到饲粮中以提高动物的免疫功能。
肥大细胞是抗感染免疫的第一线细胞,能通过所分泌的细胞因子参与获得性免疫,是重要的免疫活性细胞[16,18]。杯状细胞可通过特异性免疫机制和非特异性免疫机制参与并调节肠道局部免疫机能,它能分泌一种酸性物质到达黏膜表面,从而形成一层保护膜而发挥屏障作用[19]。因此,肥大细胞和杯状细胞在IUGR仔猪肠道免疫机能的调节中起重要作用。本试验结果发现Arg的母体效应主要影响空肠肥大细胞的数量,可显著提高IUGR仔猪的空肠肥大细胞数量,并且细胞数量显著高于对照组。这说明提高妊娠母猪饲粮中的Arg水平可以显著提高肠道中肥大细胞的数量,从而改善IUGR仔猪的肠道免疫功能。本试验还发现与IUGR组相比,Arg+IUGR组仔猪7日龄回肠、21日龄空肠及回肠中杯状细胞数量显著提高,而7日龄空肠杯状细胞数量与IUGR组相比无显著差异,但有所提高,这可能是由于初生和哺乳阶段IUGR仔猪肠道内极低的精氨酸酶活性使仔猪肠细胞对Arg的代谢能力有限所致[20]。Arg+IUGR组空肠和回肠杯状细胞数量与对照组差异均不显著,这说明Arg的母体效应确实能提高IUGR仔猪小肠中杯状细胞数量到正常仔猪水平。本试验Arg的母体效应能提高IUGR仔猪小肠的免疫细胞数量的机制与Arg的多种营养生理特性有关。Sukhotnik等[21]研究发现补充Arg能提高小肠黏膜厚度,提高黏膜DNA含量和蛋白质含量,促进大鼠小肠细胞的增殖和受损黏膜的修复。Arg的母体效应可能提高了IUGR小肠黏膜中胰岛素的水平,胰岛素与受体结合后,导致胞内胰岛素受体底物的多个酪氨酸残基发生磷酸化,激活磷脂酰肌醇3-激酶(PI3K)和蛋白激酶B(Akt)信号,Akt又促进了下游分子哺乳动物雷帕霉素靶蛋白(m TOR)的磷酸化,从而调节蛋白合成、细胞迁移和肠道复原,在细胞蛋白合成和生长中发挥重要作用[22-24]。此外,在肠道上皮细胞中,PI3K 可促进肠道黏膜细胞的增殖,Arg对PI3K信号的激活,可能促进了肠上皮免疫细胞的增殖[25]。这可能使得Arg抑制了肠道表皮中肥大细胞和杯状细胞的凋亡,促进了细胞的增殖,从而提高了IUGR仔猪肠道的免疫功能。
IUGR仔猪的小肠组织生长在出生后1周内能部分实现补偿,而且补偿生长的实现是随着日龄增加逐步完全的[26]。本试验A rg+IUGR组仔猪的初生重极显著低于对照组和IUGR组,但Arg+IUGR组仔猪7及21日龄体重增至与IUGR组仔猪差异不显著。这提示Arg对于IUGR的生长补偿有促进作用。而Arg+IUGR组仔猪肠道各项指标均高于对照组或与对照组相当,这说明Arg的母体效应在仔猪妊娠期间对于IUGR仔猪肠道免疫细胞的增殖显示出很好的补偿作用,但是A rg的作用没有明显提高IUGR仔猪初生重和7和21日龄的体重至正常仔猪水平,这可能是由于Arg的补偿生长作用仅恢复了IUGR仔猪肠道免疫细胞的数量和肠道的正常功能,而Arg对肠道免疫功能促进作用却不足以弥补IUGR仔猪初生重低的不足,才使得IUGR仔猪的体重没有明显提高。此外,Muaku等[27]研究发现,外源促生长因子能促进IUGR幼鼠在生后23 d完全实现补偿生长。本试验Arg的母体效应并未实现完全补偿生长,这可能是由于试验期太短,Arg的补偿作用还未完全实现。
4 结论
在妊娠母猪饲粮中添加1%的Arg可促进哺乳期低初生重IUGR仔猪的补偿生长,并提高IUGR仔猪的平均日增重至正常仔猪水平。Arg的母体效应能显著地提高7及21日龄IUGR仔猪小肠黏膜上皮肥大细胞和杯状细胞的数量,提高IUGR仔猪的免疫功能,改善肠道免疫机能。
[1] KONG X F,WU G Y,LIAO Y P,et al.Dietary sup-plementation w ith Chinese herbal ultra-fine pow der enhances cellular and humoral immunity in earlyweaned piglets[J].Livestock Science,2007,108(1/2/3):94-98.
[2] 冷向军,王康宁,杨凤,等.酸化剂对早期断奶仔猪胃酸分泌、消化酶活性和肠道微生物的影响[J].动物营养学报,2002,14(4):44-48.
[3] 周锡红,朱燕午,吴信.仔猪精氨酸营养及精氨酸生素在仔猪中的应用进展[J].饲料博览,2010(3):6-8.
[4] FLYNN N E,MEININGER C J,HAYNES T E,et al.Themetabolic basis of arginine nutrition and pharmacotherapy[J].Biomedicine & Pharmacotherapy,2002,56(9):427-438.
[5] WU G,OTT T L,KNABE D A,et al.Am ino acid composition of the fetal pig[J].The Journal of Nutrition,1999,129(5):1031-1038.
[6] ADJEIA A,YAMAUCHI K,NAKASONE Y,et al.A rginine-supplemented diets inhibit endotoxin-induced bacterial translocation in m ice[J].Nutrition,1995,11(4):371-374.
[7] RAFIEE M,BARA M,STEPHENS C,et al.Application of ERIC PCR for the com parison of isolates of Haemophilus parasuis[J].Australian Veterinary Journal,2000,78(12):846-849.
[8] 蔡旭旺,刘正飞,陈焕春,等.副猪嗜血杆菌的分离培养和血清型鉴定[J].华中农业大学学报,2005,24(1):55-58.
[9] 罗彬,黄兴国.精氨酸的营养功能及在仔猪生产中的应用[J].湖南饲料,2008(3):24-26.
[10] 刘星达,彭瑛,吴信,等.精氨酸和精氨酸生素对母猪泌乳性能及哺乳仔猪生长性能的影响[J].饲料工业,2011,32(8):14-16.
[11] MATEO R D,WU G,BAZER F W,et al.Dietary L-arginine supplementation enhances the reproductive performance of gilts[J].The Journal of Nutrition,2007,137(3):652-656.
[12] 王琤.精氨酸对仔猪宫内发育及N-氨甲酰谷氨酸对断奶仔猪生长的影响[D].博士学位论文.南昌:江西农业大学,2012:36-38.
[13] JOBGEN W S,FRIED SK,FU W J,et al.Regulatory role for the arginine-nitric oxide pathway in metabolism of energy substrates[J].The Journal of Nutritional Biochem istry,2006,17(9):571-588.
[14] 卢岩,刘晓梅,李书琴.L-精氨酸对宫内发育迟缓胎鼠胰岛素样生长因子及其结合蛋白表达的影响[J].中国当代儿科杂志,2006,8(4):319-322.
[15] 徐辉,粟永萍.黏膜免疫调节的研究进展[J].免疫学杂志,2004(2):155-157.
[16] GASKINSH R.The intestinal immune system:gut reaction(or lack thereof)and grow th of the pig[J].Journal of Animal Science,1996,74(Suppl.1):169.
[17] ZIEGLER T R,ESTIVARIZ C F,JONAS C R,et al.Interactions between nutrients and peptide grow th factors in intestinal grow th,repair,and function[J].Journal of Parenteral and Enteral Nutrition,1999,23(Suppl.6):S174-S183.
[18] 郝振荣,朱志宁,王明,等.大豆异黄酮对奶牛泌乳后期泌乳性能、免疫功能和乳腺肥大细胞白介素-4水平的影响[J].动物营养学报,2010,22(6):1679-1686.
[19] 唐秀莹,陈正礼,罗启慧,等.大豆异黄酮对大鼠肠道上皮内淋巴细胞、杯状细胞及瘦素长型受体的影响[J].浙江大学学报:农业与生命科学版,2013,39(3):343-350.
[20] 吴琛,刘俊锋,孔祥峰,等.仔猪内源性精氨酸合成研究进展[J].动物营养学报,2011,23(1):5-9.
[21] SUKHOTNIK I,MOGILNER J,KRAUSZ M M,et al.Oral arginine reduces gutmucosal injury caused by lipopolysaccharide endotoxem ia in rat[J].Journal of Surgical Research,2004,122(2):256-262.
[22] INOKIK,LIY,ZHU T,et al.TSC2 is phosphorylated and inhibited by Akt and suppressesm TOR signalling[J].Nature Cell Biology,2002,4(9):648-657.
[23] MARANDIS,DE KEYSER N,SALIEZ A,etal.Insulin signal transduction in rat small intestine:role of MAP kinases in expression ofmucosal hydrolases[J].American Journal of Physiology-Gastrointestinal and Liver Physiology,2001,280(2):G229-G240.
[24] SARBASSOV D D,GUERTIN D A,ALISM,et al.Phosphorylation and regulation of Akt/PKB by the rictor-m TOR complex [J].Science,2005,307(5712):1098-1101.
[25] SHENG H,SHAO J,TOWNSEND C M,et al.Phosphatidylinositol 3-kinase mediates proliferative signals in intestinal epithelial cells[J].Gut,2003,52(10):1472-1478.
[26] 周根来,王恬,霍永久,等.胎儿宫内发育迟缓对新生仔猪小肠组织发育的影响[J].动物营养学报,2006,18(1):19-25.
[27] MUAKU SM,THISSEN JP,GERARD G,etal.Postnatal catch-up grow th induced by grow th hormone and insulin-like grow th factor-Ⅰin rats w ith intrauterine grow th retardation caused by maternal protein malnutrition1[J].Pediatric Research,1997,42(3):370 -377.
