人间充质干细胞活性因子鞘内注射治疗新生儿中-重度缺氧缺血性脑病1例
2014-03-14王凤,栾佐
王 凤,栾 佐
我国新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)发生率为活产儿的 3‰~6‰,其中15%~20%在新生儿期死亡,存活者中25%~30%可能留有不同类型和程度的远期后遗症[1]。在原有常规对症支持治疗基础上,目前治疗进展涵盖了亚低温及神经干细胞移植。亚低温的治疗对象多局限在大于34周、适应证为中-重度脑损伤[2-3]。越来越多的证据表明,新生儿脑部缺氧损伤后,很难再生性修复,这可能与脑损伤后神经细胞数的损失、神经血管生长及分化因子的表达受到影响有关。在过去的几年,干细胞移植尤其是间充质干细胞在增强新生儿神经元再生能力方面取得了长足的进步,通过增强不成熟大脑内源性再生能力,修复病变,改善远期肌张力及运动发育水平。比起成人脑病,新生儿脑病用干细胞治疗效果更好[4]。而在前期动物实验中,数据显示脂肪干细胞分泌的具有生物活性的因子如胰岛素样生长因子以及脑源性神经营养因子无论是在体外还是体内神经损伤模型中,均表现出对神经元的保护作用[5-6]。2013年10月5日,我科为1例中-重度缺氧缺血性脑病患儿成功进行了人间充质干细胞活性因子鞘内注射治疗,近期疗效满意,现报道如下。
1 资料与方法
1.1 临床资料 患儿,男性,生后1.5 h因“窒息复苏后呼吸急促、肤色青紫”入院。病史:羊水Ⅲ度粪染、脐带呈螺旋状扭转。生后Apgar评分1 min 4分(呼吸-2分,反射-1分,肤色-1分,肌张力-1分,心率-1分),立即予气管插管胎粪吸引,之后给予复苏囊正压通气及刺激呼吸;5 min 6分(呼吸-1分,反射-1分,肤色-1分,肌张力-1分);10 min 9分(肤色-1分)。入院时神经系统查体:嗜睡、易激惹,前囟平软,瞳孔缩小,四肢肌张力高,原始反射减弱;血气分析(鼻导管吸氧为60%、流量0.5 L/min):pH 7.14,动脉氧分压155 mmHg,二氧化碳分压31 mmHg,乳酸>15 mmol/L,碱剩余-17.1 mmol/L,钙离子1.37 mmol/L,血糖 7.8 mmol/L,碳酸氢根10.6 mmol/L。治疗前头颅CT示脑实质呈弥漫性低密度影伴脑室变窄。脑电图呈现低电压。生后第6天脑电图在睡眠中可见一过性额区尖波,且可见非连续图形(trace discontinuous,TD)、交替性图形(trace alternant,TA)。诊断:新生儿窒息;新生儿缺氧缺血性脑病;胎粪吸入综合征;新生儿代谢性酸中毒。
1.2 方法
1.2.1 细胞因子来源 干细胞活性因子来源于体外培养的脂肪干细胞。吸脂术后吸取的脂肪组织经Ⅰ型胶原酶消化后接种培养,培养条件为37℃、5%CO2,适度传代后进行干细胞活性因子的收集,因子富集后行微生物检测证实其无污染,并采用酶联免疫吸附测定法检测主要因子含量(脑源性神经营养因子、胰岛素样生长因子-1、血管内皮生长因子、碱性成纤维细胞生长因子)。
1.2.2 操作过程 经医院伦理委员会批准。术前签署知情同意书。根据其窒息缺氧病史、神经系统症状、完善头颅CT明确缺氧缺血性脑病诊断各类检查,于患儿出生12 h予干细胞活性因子自L4-L5椎间隙行鞘内注射,每次0.75 mL缓慢注入,每24 h 1次,连续3次,同时抽吸等量的脑脊液,后常规消毒、覆盖无菌辅料。1.2.3 评估方法 形态学:头颅MRI;电生理:脑电图;临床评价:症状体征观察、神经行为评分(neonatal behavior neurological assessment,NBNA,大于 35分为正常范围),智力及运动发育量表评估;智力:贝利评估量表;运动评估:Peabody运动发育评估量表。
2 结果
2.1 临床疗效 患儿接受干细胞活性因子注射前处于嗜睡状态、肌张力高、自主活动少,在接受干细胞活性因子鞘内注射后48 h内神志及肌张力逐渐改善,注射后第3天神志清楚、自主活动增多,治疗后第7天自主活动正常,治疗后第14天肌张力正常(表1)。随访至生后9个月,患儿可独站、扶走,寻找盒子里面的东西,遵照命令将方木放入茶杯,模仿乱写、模仿用勺子、推动小汽车、能说2个词。无其他不良反应。
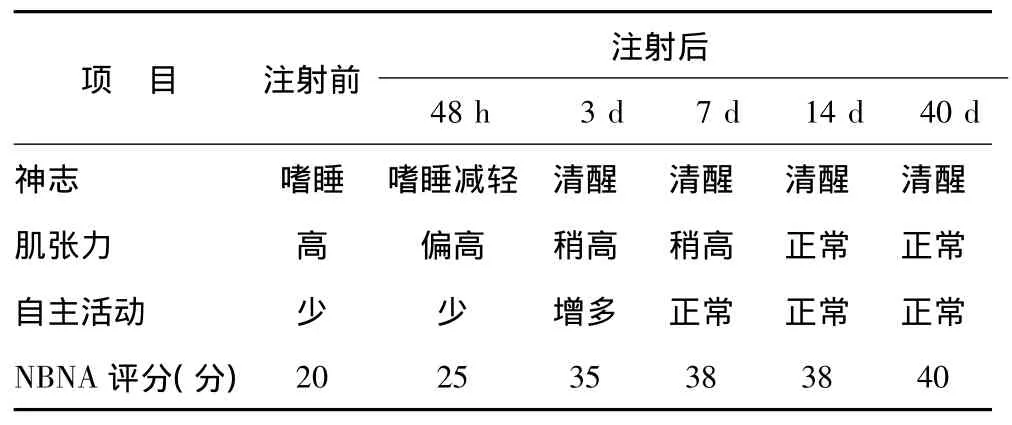
表1 鞘内注射干细胞活性因子前后临床症状观察
2.2 辅助检查 患儿注射干细胞活性因子前脑电图呈现低电压表现,注射后脑电波幅改善,睡眠中可见一过性额区尖波,可见TA、TD(图1)。注射后第28天复查头颅MRI可见脑室大小及灰白质成像(图2)。
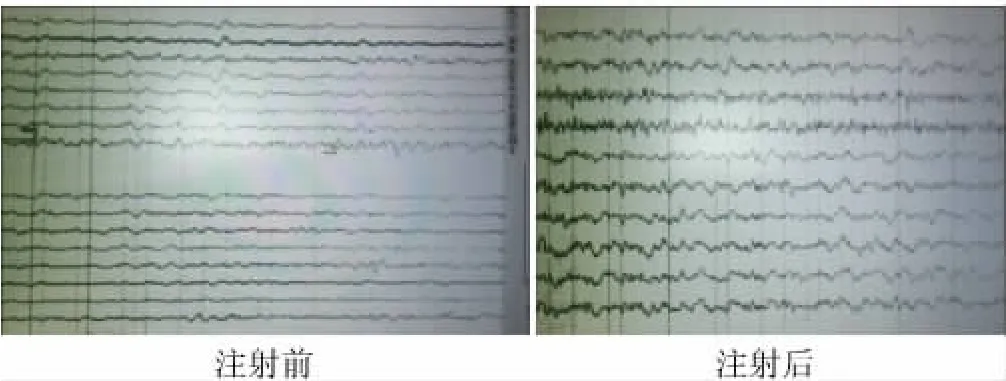
图1 鞘内注射干细胞活性因子前后脑电图
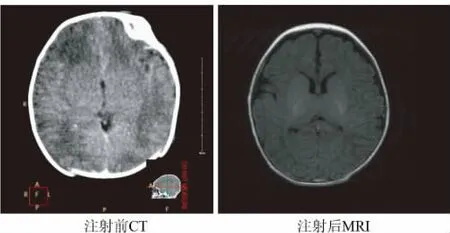
图2 鞘内注射干细胞活性因子前头颅CT与注射后颅脑MRI
3 讨论
新生儿HIE是由于缺氧窒息导致的脑缺血性损害。缺氧后脑血流动力学改变、脑细胞能量代谢衰竭、自由基损伤、细胞内钙超载、兴奋性氨基酸的“兴奋毒”作用及炎症细胞、炎症细胞因子的作用均导致脑细胞损伤,引起临床一系列脑病的表现。本例有明确可导致胎儿宫内窘迫的异常产科病史,以及严重的胎儿宫内窘迫表现(胎心<100/min,持续5 min以上;羊水Ⅲ度污染);出生时有窒息史,Apgar评分1 min 4分,出生后5 min仍需要继续复苏;生后不久出现神经系统症状,并持续24 h以上,意识改变(嗜睡)、肌张力改变(增高),原始反射减弱,且7 d后神经系统症状未完全消失:可诊断为中-重度缺氧缺血性脑病。为避免患儿脑损伤后遗症发生,对患儿急性期进行了人间充质干细胞活性因子鞘内注射治疗,疗效较好。
近年来,大量临床研究均表明,人神经干细胞在多种系统治疗方面具有较好疗效,但其移植路径、治疗时间窗、体内植入水平控制、伦理学、移植细胞种类、远期致瘤性均仍存在争议[7-11]。动物研究资料表明,间充质干细胞分泌多种细胞生长因子如粒-巨噬细胞集落刺激因子、脑源性神经营养因子、血管内皮生长因子、肝细胞生长因子、碱性成纤维细胞生长因子、转化生长因子 β、胰岛素样生长因子-1[12-13]。胰岛素样生长因子-1及脑源性神经营养因子能通过阻断细胞凋亡、拮抗兴奋性神经毒素作用来修复、保护缺氧、缺血时的各类神经元,减少神经元数目的丢失[4-5,14-15]。
对比直接移植神经干细胞,干细胞活性因子可能具有以下优势:①神经元细胞在经过缺氧缺血性损伤后可出现细胞凋亡及细胞坏死,多在生后7 d之内,尤其是损伤72 h之内。目前各类研究中大部分人神经干细胞移植都在脑损伤48 h或72 h后进行,因为在此时间之前植入干细胞的丢失可达70%。相比之下,干细胞活性因子注射的时机不需避开细胞水肿高峰期,可尽早注入发挥作用。②干细胞活性因子的相对分子质量小,经腰椎穿刺进入蛛网膜下腔后,更易随脑脊液循环到达中枢神经系统各部位,从而无需侧脑室穿刺,不同于直接注入异体细胞。③作为提纯的干细胞活性因子,而非异体细胞本身,伦理学上更容易被接受。
根据循证医学各证据表明,亚低温治疗能减轻神经元的缺氧缺血性损害,目前亚低温为治疗新生儿缺氧缺血性脑病主要手段[1-3]。但亚低温仅能减轻细胞损伤进一步加重,做到防止细胞凋亡。而神经细胞因子对处于凋亡程序中的神经元细胞有逆转作用。
文献曾报道,使用药物经侧脑室穿刺可对缺氧后的脑细胞产生保护作用[17-18]。本例使用的制剂含有多种浓缩的干细胞活性因子,可达到增强作用的效果。
人间充质干细胞活性因子治疗新生儿缺氧缺血性脑病鲜见报道。本研究为个案报道,可能不能代表同类疾病患者,且很难断定人间充质干细胞活性因子在新生儿缺氧缺血性脑病完全康复中所起作用;同时,干细胞活性因子为生物治疗,安全性与疗效同样需后续的大样本的临床研究,予以进一步的研究验证尚需更多病例积累。尤其是干细胞活性因子对已经死亡、损耗的神经元细胞无法补充,是否提示此类治疗对中-重度脑损伤、早期损伤治疗效果更好,对于重度缺氧缺血性改变合并神经干细胞移植效果更好。而目前所使用的干细胞活性因子制剂中含多种细胞因子,考虑胰岛素样生长因子-1及脑源性神经营养因子对神经元保护作用最明显[5],是否在后期进一步纯化或者明确其他因子作用水平,均需继续深入研究。
[1]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2011:702.
[2]卫生部新生儿疾病重点实验室,复旦大学附属儿科医院,《中国循证儿科杂志》编辑部,等.足月儿缺氧缺血性脑病循证治疗指南:2011-标准版[J].中国循证儿科杂志,2011,6(5):327-335.
[3]孙金峤,陈燕琳,周文浩.亚低温治疗新生儿缺氧缺血性脑病临床效果的Meta分析[J].中国循证儿科杂志,2009,4(4):340-348.
[4] Donega V,van Velthoven CT,Nijboer CH,et al.The endogenous regenerative capacity of the damaged newborn brain:boosting neurogenesis with mesenchymal stem cell treatment[J].J Cereb Blood Flow Metab,2013,33(5):625-634.
[5] Wei X,Du Z,Zhao L,et al.IFATS collection:the conditioned media of adipose stromal cells protect against hypoxia-ischemia-induced brain damage in neonatal rats[J].Stem Cells,2009,27(2):478-488.
[6] Nakagami H,Maeda K,Morishita R,et al.Novel autologous cell therapy in ischemic limb disease through growth factor secretion by cultured adiposetissue-derived stromal cells[J].Arterioscler Thromb Vasc Biol,2005,25(12):2542-2547.
[7] Liu X,Ye R,Yan T,et al.Cell based therapies for ischemic stroke:from basic science to bedside[J].Prog Neurobiol,2014,115:92-115.
[8] Castillo-Melendez M,Yawno T,Jenkin G,et al.Stem cell therapy to protect and repair the developing brain:a review of mechanisms of action of cord blood and amnion epithelial derived cells[J].Front Neurosci,2013,7:194.
[9]刘卫鹏,屈素清,栾佐,等.人神经前体干细胞移植治疗重度脑瘫患儿疗效观察[J].中国当代儿科杂志,2012,14(10):759-762.
[10] Kim KS,Lee HJ,An J,et al.Transplantation of human adipose tissue-derived stem cells delays clinical onset and prolongs life span in ALS mouse model[J].Cell Transplant,2013[Epub ahead of print].
[11] Chen G,Wang Y,Xu Z,et al.Neural stem cell-like cells derived from autologous bone mesenchymal stem cells for the treatment of patients with cerebral palsy[J].J Transl Med,2013,11:21.
[12] Rehman J,Traktuev D,Li J,et al.Secretion of angiogenic and antiapoptotic factors by human adipose stromal cells[J].Circulation,2004,109(10):1292-1298.
[13] Sadat S,Gehmert S,Song YH,et al.The cardioprotective effect of mesenchymal stem cells is mediated by IGF-Ⅰand VEGF[J].Biochem Biophys Res Commun,2007,363(3):674-679.
[14] Escartin C,Boyer F,Bemelmans AP,et al.Insulin growth factor-1 protects against excitotoxicity in the rat striatum[J].Neuroreport,2004,15(14):2251-2254.
[15] Sun X,Zhou H,Luo X,et al.Neuroprotection of brain-derived neurotrophic factor against hypoxic injury in vitro requires activation of extracellular signal-regulated kinase and phosphatidylinositol 3-kinase[J].Int J Dev Neurosci,2008,26(3/4):363-370.
[16]新生儿行为协作组.应用20项新生儿行为神经测定预测窒息儿的预后[J].中华儿科杂志,1994,32(4):210-212.
[17]万国兰,任行勤,刘锋伟,等.头部药物注射疗法对大鼠缺氧缺血性脑损伤后学习记忆的影响[J].郑州大学学报:医学版,2007,42(2):255-257.
[18]柴斌英,刘家浩.脑室注射N-苯甲基氧化碳酰-缬氨酸-丙氨酸-天冬氨酸-氯化丙酮对新生鼠缺氧缺血性脑损伤的保护作用[J].实用儿科临床杂志,2006,21(2):75-77.
