高效液相色谱-串联质谱法测定粮油食品中α-玉米赤霉烯醇和玉米赤霉烯酮
2014-03-13魏春雁孟繁磊樊慧梅牛红红宋志峰
魏春雁,孟繁磊,樊慧梅,牛红红,宋志峰
(吉林省农业科学院农业质量标准与检测技术研究所/农业部农产品质量安全风险评估实验室 长春 130033)
玉米赤霉烯酮(Zearalenone,ZON)又称F-2毒素,是由镰刀菌产生的一种类雌激素样真菌毒素,具有遗传毒性、能致癌、导致DNA收敛和染色体失常等危害[1]。在动物及人体内,ZON可以代谢为α-玉米赤霉烯醇(α-Zearalenol,α-ZOL)和β-玉米赤霉烯醇(β-Zearalenol,β-ZOL)及其他产物,而在植物体内ZON主要代谢为α-ZOL[2-4]。
国内外报道的ZON及其代谢产物检测方法主要有液相色谱法(HPLC)[3-9]、气相色谱质谱联用(GC-MS)[10]、毛细管电泳法 (CE)[11]、薄层色谱法(TLC)[12]、液相色谱质谱联用法(HPLC-MS)[13]等。其中单独测定ZON时,HPLC使用最为广泛。高效液相色谱-串联质谱法(HPLC-MS/MS)由于其具有检测灵敏度高、定性定量兼顾和可多组分同时检测等优点,因此近年来成为多种真菌毒素同时测定研究的热点[14-18]。真菌毒素检测中一个十分关键的步骤是样品提取液的净化,它将直接影响到分析结果的准确性。目前文献报道的净化技术大多采用固相萃取的方法,这种净化方法虽然操作简便,但是成本较高,尤其是通常使用的免疫亲和柱价格更是昂贵,使一般实验室很难接受。本文通过参考文献[19],采用经典的液液萃取方法对样品进行提取和净化,经HPLC-MS/MS分离和检测,实现了粮油食品中α-ZOL和ZON快速准确测定。
1 实验部分
1.1 仪器和试剂
Agilent 1200高效液相色谱仪(HPLC)、6410B三重四级杆串联质谱仪 (美国 Agilent公司);BT124S电子分析天平,感量0.1mg(德国Sartorius公司);PL602电子分析天平,感量0.01 g(梅特勒托利多仪器 (上海)有限公司);RVO6-ML全自动旋转蒸发仪(德国IKA公司);HSC-24B氮吹仪(天津市恒奥科技发展有限公司);NR常温振荡提取器 (日本TAITEC公司);VORTEX3000涡旋混匀器(德国 WIGGENS公司);125 mL分液漏斗(天津天玻玻璃仪器有限公司)。
HPLC级乙腈(赛默飞世尔(中国)有限公司);分析纯二氯甲烷、三氯甲烷、无水硫酸钠、氯化钠、一水合柠檬酸(国药集团化学试剂有限公司);α-玉米赤霉烯醇(α-ZOL)、玉米赤霉烯酮(ZON),纯度≥99%(国家标准物质研究中心);0.22μm有机滤膜(天津津腾实验设备有限公司)。
1.2 溶液配制
饱和氯化钠溶液:称取36 g氯化钠容于100 mL水中。2%氢氧化钠溶液:称取20 g氢氧化钠用水溶解并定容至1 L。106 g/L柠檬酸溶液:称取106 g一水合柠檬酸用水溶解并定容至1 L。50%乙腈溶液:取500 mL乙腈和500 mL水混合。
标准储备液:分别准确称取α-ZOL和ZON标准物质适量(精确至0.000 1 g)用乙腈溶解,配制成浓度为1 000 mg/L的标准储备液。0~4℃避光保存,有效期为6个月。
标准工作液:分别准确量取α-ZOL和ZON标准储备液适量(精确至0.000 1 g),于一组容量瓶中,用50%乙腈溶液至刻度,配制成浓度为1.0 ng/mL、5.0 ng/mL、10 ng/mL、25 ng/mL、50 ng/mL的标准工作液。此溶液现用现配。
1.3 HPLC-MS/MS分析条件
1.3.1 HPLC条件
色谱柱:ZORBAX SB-C18(Rapid Resolution HT 100 mm×2.1 mm,1.8μm)。柱温:40℃。流动相A:10%乙腈(v/v)水溶液;流动相B:乙腈(色谱纯);梯度洗脱程序:0~5 min,流动相B由50%~75%;5~5.1 min,流动相 B由 75%~100%;5.1~10.1 min,流动相B保持为 100%;10.1~10.2 min,流动相 B由 100%~50%;10.2~18 min,流动相B保持为50%。流速:0.3 mL/min。进样量:20μL。
1.3.2 质谱条件
电离方式:电喷雾电离;扫描方式:负离子扫描;检测方式:多反应监测(MRM);离子源温度:350℃;干燥气流量:10 L/min;监测离子、去簇电压及碰撞能量等见表1。

表1 α-玉米赤霉烯醇(α-ZOL)和玉米赤霉烯酮(ZON)监测离子、去簇电压及碰撞能量
1.4 样品前处理
1.4.1 提取
称取样品10 g(精确至0.01 g)于100 mL具塞锥形瓶中。固体加入50 mL三氯甲烷,植物油脂等液体样品加入35 mL三氯甲烷,盖紧塞子,于振荡提取器上室温振荡(180 r/min)提取30 min。
1.4.2 净化
使用中速滤纸过滤提取液并用三氯甲烷定容至50 mL。吸取25.0 mL提取液至125 mL分液漏斗中,加入5 mL饱和氯化钠溶液,混匀。加入25 mL 2%氢氧化钠溶液,剧烈振荡1 min,静置分层,弃去三氯甲烷层。用25 mL三氯甲烷重复萃取一次,弃去三氯甲烷层。加入25 mL 106g/L柠檬酸溶液,混匀。加入25 mL二氯甲烷,剧烈振荡1 min,静置分层。将二氯甲烷层溶液通过装有5 g无水硫酸钠的漏斗。用25 mL二氯甲烷重复萃取一次,操作同上。用5 mL二氯甲烷冲洗无水硫酸钠,合并二氯甲烷萃取液至浓缩瓶中,40℃以下于旋转蒸发仪上浓缩至近干。残留物用5 mL二氯甲烷溶解并转移至玻璃离心管中,于40℃以下用氮气吹干,残留物用1.0 mL 50%乙腈溶液溶解,于漩涡混合器上漩涡混匀后,过0.22 μm有机滤膜,供HPLC-MS/MS测定。
1.5 定性和定量
1.5.1 定性分析
按照1.3的分析条件对标准工作液和样品进行测定,当样品目标化合物的色谱峰与标准工作液色谱峰保留时间偏差±5%范围内、定性离子对的相对丰度符合欧盟关于食品中污染物的确认要求[20],则可判定样品中存在相应的化合物。α-ZOL和ZON标准工作液多反应监测(MRM)色谱图见图1。
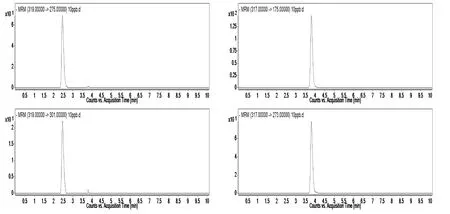
图1 10μg/L标准工作液中α-ZOL(a、b)和ZON(c、d)特征离子质量色谱图
1.5.2 定量分析
按浓度由小到大的顺序,按照1.3的分析条件依次对标准工作液进行测定,以浓度为横坐标,峰面积为纵坐标,绘制标准工作曲线。同时按相同条件对样品测定液进行测定,利用标准工作曲线对样品中目标化合物按照外标法进行定量。高浓度样品应适当稀释,保证被测组分在标准工作曲线范围内。
2 结果与讨论
2.1 质谱条件的优化
对扫描方式、离子源温度和干燥气温度等进行了优化,确定出最佳的质谱条件。对α-ZOL和ZON去簇电压、碰撞能量等进行了优化,同时参考文献[15-16]筛选出最佳的定性和定量离子对。
2.2 色谱条件的优化
2.2.1 流动相的选择
比较了甲醇和水、乙腈和水作为流动相的洗脱效果,发现两者相当。由于使用窄径色谱柱分离,甲醇和水作为流动相时系统压力较高,对系统易造成损害,因此选择了乙腈和水系统作为流动相。
2.2.2 洗脱方式的选择
对于α-ZOL和ZON,采用50%乙腈等度系统和梯度洗脱时分离效果相当,等度洗脱时分析时间较长,同时梯度洗脱可有效除去极性较弱的杂质,因此选择了梯度洗脱的方式。
2.2.3 色谱柱的选择
比较了50 mm、100 mm和150 mm 3种不同规格的窄径C18色谱柱,发现100 mm分离效果较好,且分析较短,4 min之内α-ZOL和ZON便可得到良好的分离,因此选择了100 mm×2.1 mm(粒径1.8μm)的C18色谱柱作为分析柱。
2.3 前处理条件的优化
2.3.1 提取溶剂的选择
在空白玉米样品中加入一定浓度的α-ZOL和ZON标准物质,比较了三氯甲烷、乙腈、无水乙醚三种提取溶剂的提取效率。结果发现:三氯甲烷和乙醚对α-ZOL与ZON提取效率较高且相当,乙腈稍差,考虑到乙醚挥发性高,操作过程中不易控制,因此选择了三氯甲烷作为提取溶剂。
2.3.2 提取时间的选择
在空白玉米样品中加入一定浓度的α-ZOL和ZON标准物质,以三氯甲烷为提取溶剂,在室温振荡条件下提取,比较了10 min、20 min、30 min、45 min、60 min的提取效果。结果发现:随着提取时间的增加,α-ZOL与ZON的提取效率不断提高,30 min以后提取效率达到最高,以后不再增加,因此确定30 min作为提取时间。
2.3.3 萃取剂的选择
α-ZOL和ZON在弱碱性水溶液中的溶解性高于有机溶剂,因此选择氢氧化钠作为第一次萃取的溶液,以除去脂类和色素等脂溶性的杂质。在空白玉米样品中加入一定浓度的α-ZOL和ZON标准物质,用三氯甲烷室温下振荡提取30 min,以二氯甲烷为反萃取溶剂,对0.5%、1%、2%和3%4种浓度的氢氧化钠的萃取效率进行了比较。结果发现氢氧化钠的浓度为2%时较为合适。
2.3.4 反萃取溶剂的选择
在空白玉米样品中加入一定浓度的α-ZOL和ZON标准物质,用三氯甲烷室温振荡提取30 min,以2%氢氧化钠为萃取剂,比较了分别以二氯甲烷、三氯甲烷、乙腈、甲醇作为反萃取溶剂时的萃取效率。结果发现二氯甲烷与三氯甲烷反萃取的效率最高,且两者相当,考虑到二氯甲烷沸点更低便于旋蒸浓缩,因此选择二氯甲烷作为反萃取溶剂。
2.4 线性关系、检出限、回收率及精密度
配制了 0.20 ng/mL、0.50 ng/mL、1.0 ng/mL、5.0 ng/mL、10 ng/mL、20 ng/mL、50 ng/mL、100 ng/mL 等浓度的α-ZOL和ZON混合标准溶液上机测定,结果发现0.50 ng/mL~50 ng/mL 2个化合物线性范围良好,线性回归方程分别为Y=183.72X-11.04(r2=0.999)和 Y=337.59X+21.21(r2=0.998);以定性离子的信噪比≥3时确定2个化合物的检出限分别为1.5μg/kg和 1.0 μg/kg。
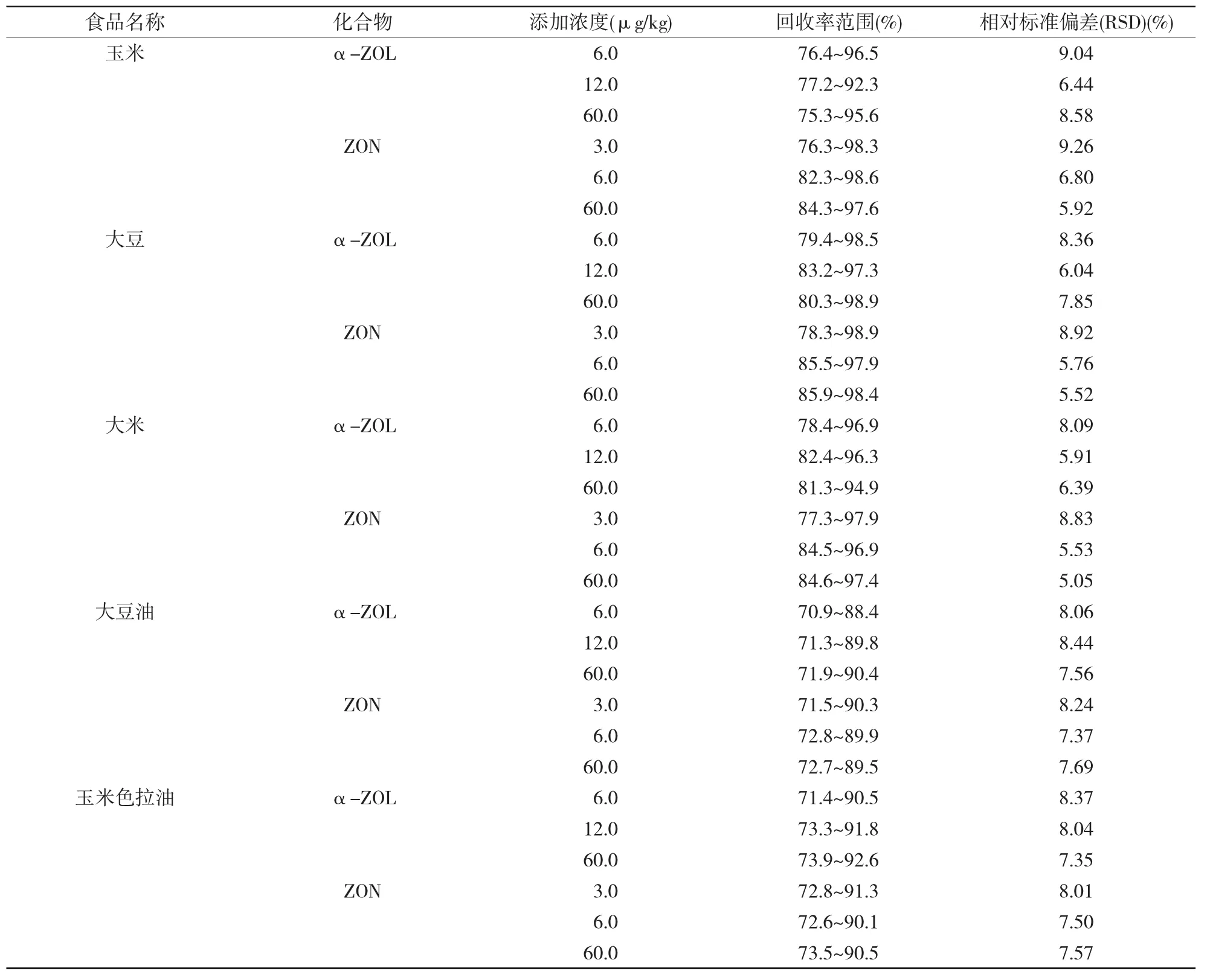
表2 不同基质空白样品中α-ZOL和ZON添加回收率及精密度(n=6)
在玉米、大豆、大米、大豆油、玉米色拉油等空白样品中加入3倍检出限、6倍检出限和30倍检出限左右浓度的α-ZOL和ZON标准物质,按照优化后的前处理和仪器分析条件进行回收率与精密度实验,结果见表2。由表2可以看出,2个化合物的不同水平加标回收率在70%~100%之间,相对标准偏差(RSD)在5%~10%之间,满足准确定量分析的要求。
2.5 实际样品测定
在市场上采集了吉林省内生产的玉米、大豆、大米、大豆油和玉米色拉油等样品各3份,按照建立的分析方法对15份样品进行了α-ZOL和ZON残留量的测定。其中1份明显发霉玉米检出了α-ZOL和ZON,含量分别为 12.1μg/kg和220.3μg/kg,另有 1份大米仅检出了 ZON,含量为5.0μg/kg,其他样品均未检出。
3 结论
本文利用HPLC-MS/MS仪器建立的粮油食品中α-ZOL和ZON检测方法,灵敏度高、重现性好、准确可靠,能够满足粮油食品中痕量污染物的检测要求。经典的液液萃取和净化方法,降低了检测成本,有利于本方法的推广和应用。
利用本方法对采集自吉林省内生产的玉米等15份样品测定的结果表明,1份发霉玉米样品检出了较高含量的α-ZOL和ZON,1份大米样品检测含量较低的ZON,其他样品均未检出。这可能是由于北方气温和空气湿度相对较低,在贮藏和加工条件适宜的情况下,粮油食品中一般不会发生α-ZOL和ZON的污染。
[1]邓有田,袁 慧.玉米赤霉烯酮毒性机理研究进展[J].动物医学进展,2007,28(2):89-92.
[2]Krska R,Josephs R.The state-of-the-art in the analysis of type-A and-B trichothecene mycotoxins in cereals[J].Fresenius J.Anal.Chem,2001(371):285-299.
[3]Kruger SC,Kohn B,Ramsey CS,et al.Rapid immunoaffinity-based method for determination of zearalenone in corn by fluorometry and liquid[J].J.AOAC Int,1999(82):1364.
[4]Visconti A,Pascale M.Determination of zearalenone in corn bu means of immunoaffinity clean-up and high-performance liquid chromatography with fluorescence detection [J].J.Chromatogr.A,1998(815):133.
[5]Urraca J L,Marazuela M D,Moreno-Bondi M C.Analysis for zearalenone and α-zearalenol in cereals and swine feed using accelerated solvent extraction and liquid chromatography with fluorescence detection [J].Analytical Chimica Acta,2004(524):175-183.
[6]GB/T 23504-2009,食品中玉米赤霉烯酮的测定免疫亲和层析净化高效液相色谱法[S].
[7]SN/T1772-2006,进出口粮谷中玉米赤霉烯酮的测定免疫亲和柱-液相色谱法[S].
[8]Nuryono N,Noviandi C T,Bohm J,et al.A limited survey of zearalenone in Indonesian maize-based food and feed by ELISA and high performance liquid chromatography[J].Food Control,2005(16):65-71.
[9]Trenholm H L,Warner R M,Farnworth E R.High performance liquid chromatographic method using fluorescence detection for quantitative analysis of zearalenone and alpha-zearalenol in blood plasma[J].J.AOAC Int,1981(64):302-310.
[10]Stan H J,Abraham B.Determination of residues of anabolic drugs in meat by gas chromatography-mass spectrometry[J].J.Chromatogr,1980(195):231-241.
[11]曾红燕,黎源倩,晋 军,等.毛细管电泳法测定玉米赤霉烯酮及其代谢物 [J].四川大学学报 (医学版),2003,34(2):333-336.
[12]罗雪云,胡 霞,李玉伟 .小麦、小麦制品中玉米赤霉烯酮的薄层色谱测定[J].卫生研究,1993,22(2):112-114.
[13]Horie M.Nakazawa H.Determination of trenbolone and zeranol in bovine muscle and liver by liquid chromatogrphy-electrospray mass spetrometry.(Special issue:Chromatography and electrophoresis in food analysis,PartⅢ)[J].J.Chromatogr.A,2000,882:53-62.
[14]孟 娟,张 晶,张 楠,等.固相萃取-超高效液相色谱-串联质谱法检测粮食及其制品中的玉米赤霉烯酮类真菌毒素[J].色谱,2010,28(6):601-607.
[15]GB/T 21982-2008,动物源食品中玉米赤霉醇、β-玉米赤霉醇、α-玉米赤霉烯醇、β-玉米赤霉烯醇、玉米赤霉酮和玉米赤霉烯酮残留量检测方法液相色谱-质谱/质谱法[S].
[16]GB/T 22963-2008,河豚鱼、鳗鱼和烤鳗中玉米赤霉醇、玉米赤霉酮、乙烯雌酚、已烷雌酚、双烯雌酚残留量的测定液相色谱-串联质谱法[S].
[17]彭 涛,李晓娟,陈冬东,等.高效液相色谱-串联质谱法同时测定动物肝脏中玉米赤霉烯醇及其类似衍生物残留量[J].分析化学,2010,38(4):469-474.
[18]李 鹏,董广彬,顾鑫荣,等.液相色谱-串联质谱法测定食用油中的玉米赤霉烯酮[J].分析仪器,2009(5):27-29.
[19]AOAC Official Method 985.18,α-Zearalenol and zearalenone in corn-Liquid chromatographic method [S].Final action 1988.
[20]2002/657/EC,Implements council directive 96/23/EC concerning the performance of analytical methods and the interpretation of results[S].
