枯草芽孢杆菌同种相食现象及生防应用
2014-03-12裘娟萍杨明欣
裘娟萍,杨明欣
(浙江工业大学生物工程与环境学院,杭州 310014)
生物防治现已成为植物病害防治的主要手段之一,具有环境友好等优点。耐旱、耐热、抗逆性强的芽孢杆菌休眠体-芽孢,成为生防菌制剂主要材料[1-3]。枯草芽孢杆菌为植物根际有益微生物,通过分泌多种抗菌物质,在植物病害防治方面具有重要作用[4-7],成为广泛应用的生物农药,例如用于水稻纹枯病、三七根腐病、烟草黑胫病防治的纹曲宁、根腐消、百抗等。
近年来,Gonz等研究发现枯草芽孢杆菌在芽孢形成起始阶段,准备形成芽孢细胞产生并释放细菌毒素,即致死因子(Killing factor),杀死尚未准备形成芽孢的同类细胞,释放致死因子的细胞对细菌毒素具免疫力。尚未形成芽孢的细胞可利用死亡细胞释放的营养继续生长,推迟其芽孢形成,该过程称为“同种相食”(Cannibalism)[8-9]。枯草芽孢杆菌“同种相食”的生物现象及其产生的细菌毒素-芽孢形成致死因子(Sporulation killing factors,SKF)、芽孢形成延迟蛋白(Sporulation delaying protein,SDP)引起广泛的研究。Lin等研究发现“同种相食”产生的细菌毒素SKF和SDP具有广谱杀菌性[8,10-12],作为新型生物农药用于生物防治。
本文综述枯草芽孢杆菌“同种相食”现象及所产细菌毒素基因调控机制、产毒素细胞自身免疫机制及相应毒素生防应用前景。
1 “同种相食”现象及其分子调控机制
在营养条件匮乏或其他不利环境中,枯草芽孢杆菌启动“同种相食”和芽孢形成过程,磷酸化Spo0A(Spo0A~P)是关键调控因子。
1.1 Spo0A~P的二元调控机制
Molle等研究发现,直接被Spo0A~P调控的基因达121个[13],其中包括“同种相食”相关基因skf、sdp和芽孢形成基因spoIIA、spoIIE、spoIIG等,这些基因受高浓度Spo0A~P调控,或受低浓度Spo0A~P的调控,形成Spo0A~P二元调控机制。
Fujita等研究发现,参与芽孢形成的相关基因spoIIA、spoIIE、spoIIG等与Spo0A~P亲和力较弱[14],需高浓度Spo0A~P启动芽孢生成;参与“同种相食”相关基因skf、sdp与Spo0A~P亲和力较强,胞内低浓度Spo0A~P可调控该基因表达,促使细胞发生“同种相食”现象。低浓度Spo0A~P对abrB基因表达具抑制作用,其编码AbrB蛋白是全局调节因子,可抑制skf和sdp表达。因此,低浓度Spo0A~P可解除AbrB对skf和sdp抑制作用(见图1)。

图1 不同浓度的Spo0A~P调控“同种相食”和芽孢形成Fig.1 Different levels of Spo0A~P control cannibalism and sporulation
1.2 Spo0A~P对“同种相食”现象的分子调控机制
在芽孢形成初期,菌群中少部分细胞Spo0A因磷酸化而被激活,Spo0A激活细胞内低浓度Spo0A~P启动skf、sdp表达,产生毒素及免疫因子;Spo0A未激活细胞中,调节蛋白AbrB抑制免疫基因表达,使其无法合成免疫蛋白而被毒素杀死。死亡细胞释放营养供Spo0A激活细胞再次生长;待到营养再次匮乏时,重复“同种相食”过程,导致芽孢形成推迟,见图1。
1.3 skf基因簇及各基因功能
枯草芽孢杆菌skf基因簇包括skfA~H8个结构基因,各基因的功能见表1。基因skfA编码由55个氨基酸组成的skfA多肽,skfA经翻译后修饰为26个氨基酸组成的毒性多肽skf。

表1 枯草芽孢杆菌“同种相食”过程中相关基因的功能Table 1 Functions of related genes in cannibalistic behavior of B.subtilis
Flühe等研究发现,skfB表达的skfB蛋白催化skfA4位的半胱氨酸和12位的甲硫氨酸α-C间形成硫脂键[15]。skfH编码的skfH蛋白催化skfA多肽中在1位和16位半胱氨酸间形成二硫键[10,16]。Liu和Pei等研究推断,最后环化步骤可能是由skfC催化,因为skfC是skf基因簇编码唯一具蛋白酶功能的蛋白质,推测其降解29个氨基酸后,将余下26个氨基酸头尾相连形成skf[10,17]。skf合成过程及结构见图2。
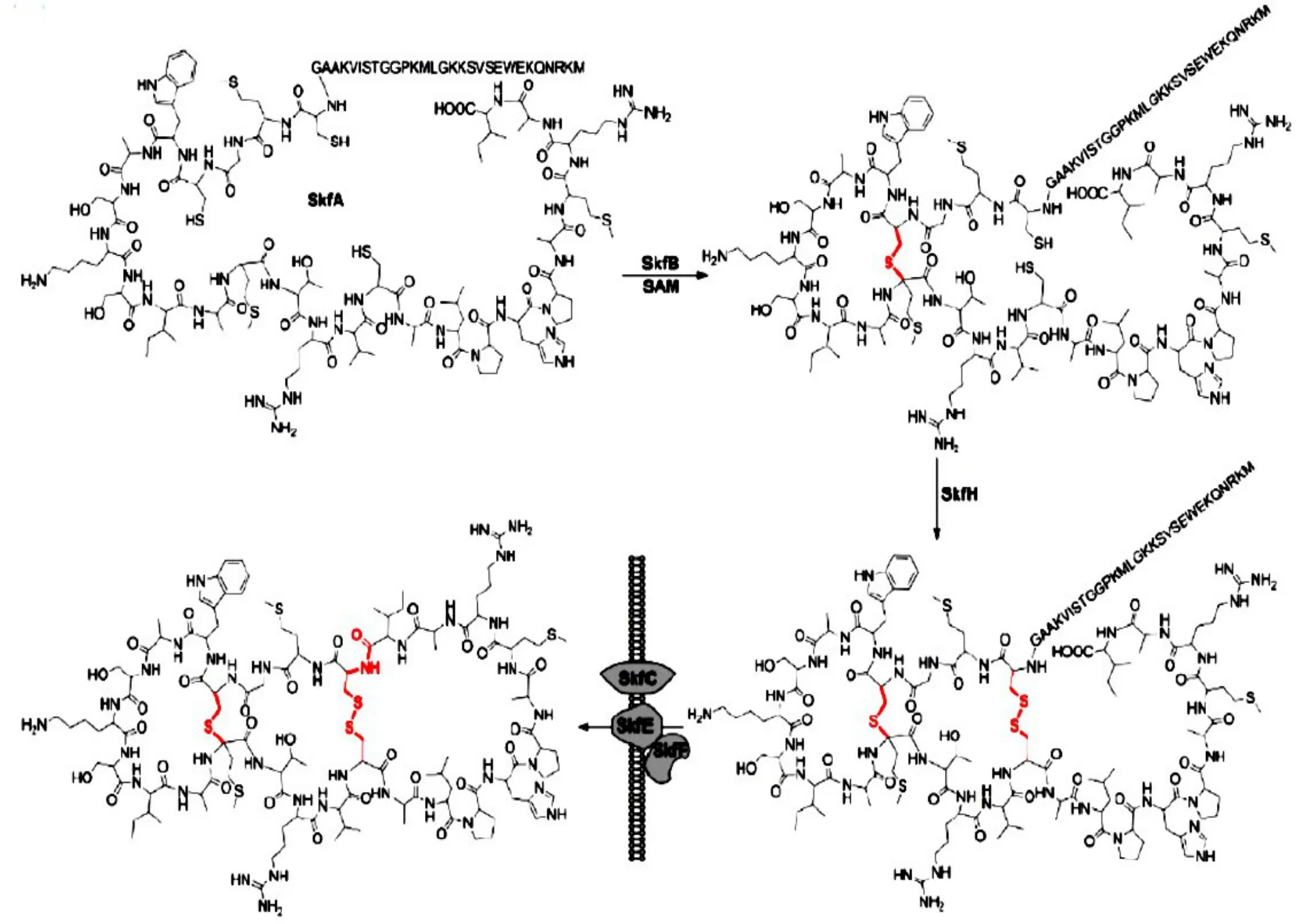
图2 枯草芽孢杆菌中skf结构及其推测的合成途径[10]Fig.2 Proposed biosynthetic pathway and structure of skf in B.subtilis
skfD表达的skfD蛋白具有肽链内切酶保守区域,Morales推断其参与多肽skfA修饰,或具有毒素skf的酶解功能,使细胞获得免疫能力[17-18]。skfE和skfF表达产物SkfEF蛋白作为毒素skf的转运体,将细菌毒素分泌到胞外。
1.4 sdp基因簇及各基因功能
1.4.1 操纵子sdpABC
sdp基因簇含有sdpABC和sdpRI两个操纵子5个结构基因,各基因功能见表1。在sdpABC操纵子中,sdpC表达由203个氨基酸组成的多肽prosdpC1-203,pro-sdpC1-203经修饰形成含42个氨基酸的毒性多肽sdp,其结构式见图3。

图3 毒素sdp结构[10]Fig.3 Structure of sdp
pro-sdpC1-203修饰过程分3步[18]:①细胞将prosdpC1-203分泌至胞外,在信号肽酶作用下,将N端的信号肽切除,形成sdpC33-203;②sdpC33-203肽链中C141和C147之间二硫键由一种巯基二硫键氧化还原酶—芽孢杆菌二硫键合成酶(Bacillusdisulfide bond,Bdb)BdbB和(或)BdbC催化形成。Perez Morales研究发现,该二硫键存在具增强SDP毒性或信号活性作用,但活性非必须。③在sdpC33-203的C140-C141和C181-C182处可能由未知蛋白酶剪切,形成含42个氨基酸、具毒素活性sdp141-181。
sdpA编码158个氨基酸组成的胞质蛋白sdpA,该蛋白与已知功能蛋白无同源性。sdpB表达sdpB系以维生素K为辅酶,具羧化酶活性跨膜蛋白,当细胞缺乏sdpAB时,pro-sdpC转运需要伴侣CsaA的参与[23]。当细胞缺少sdpAB中任何蛋白时,细胞无法产生毒素。Morales等推测,sdpA作为分子伴侣,参与pro-SdpC转运。sdpA与sdpB形成复合体,参与sdpC修饰[20],对其功能有待进一步研究。
1.4.2 操纵子sdpRI
操纵子sdpRI含有sdpR和sdpI两个结构基因。在sdp诱导下sdpRI表达产生自身调节因子sdpR和免疫蛋白sdpI[19]。
sdpR是由90个氨基酸组成的阻遏蛋白,其N端含有一个螺旋-环-螺旋(Helix-turn-helix,HTH)的DNA结合区域和一个二聚体区域,能与自身启动子结合,阻止sdpRI表达[19,21]。其C端能感应并结合不同种类的金属离子,当sdpR与金属离子结合时,HTH区域无法与DNA序列结合,对sdpRI不能产生阻遏效应[24]。
sdpI是一种有六个跨膜结构域的免疫蛋白[25],对感应sdp的存在具有重要意义[18,22]。Ellermeier等研究发现,当枯草芽孢杆菌细胞外无毒素sdp时,阻遏蛋白sdpR定位于sdpRI操纵子启动子上,抑制sdpRI基因表达。当细胞外存在毒素sdp时,SdpI受到感应,发生构象变化,与sdpR结合并发生转移,解除sdpR对sdpRI阻遏作用,大量合成sdpI[19](见图4)。

图4 sdp诱导sdpRI操纵子表达模型Fig.4 Model of how sdp induces expression of the sdpRI operon
sdpRI表达受调节蛋白AbrB阻遏作用。在Spo0A激活细胞中,Spo0A~P抑制AbrB表达,sdpI大量合成;在Spo0A未激活细胞中,AbrB不受抑制,大量AbrB抑制sdpRI表达,虽有胞外sdp诱导,但因AbrB蛋白抑制作用,细胞不能合成免疫蛋白sdpI,而被毒素杀死(见图1)。
2 枯草芽孢杆菌产毒素细胞的自身免疫机制
枯草芽孢杆菌“同种相食”过程中产毒素细胞,因存在自身免疫机制,而不受毒素侵害;而不产毒素细胞因无相应免疫蛋白,而被毒素杀死。
2.1 细胞对skf的免疫机制
2.1.1 skfEF将skf泵出细胞
Gonz'alez-Pastor等研究发现,野生型的枯草芽孢杆菌细胞能够杀死skf突变株。如果突变株和野生菌株共培养时,在细胞生长初期数量比维持在一定数值,但进入芽孢形成阶段,突变株菌落数快速减少。当skfEF基因在skf突变株中过量表达时,这些细胞又能抵御这些致死因子[8]。Perez Morales推测其原因是受Spo0A~P调控,skf基因簇产生skf毒素,同时产生自身免疫蛋白——skfE和skfF。skfE和skfF类似ABC(ATP-binding cassette)转运体,将skf毒素泵出胞外,使产毒素细胞免受损伤[8,18]。
2.1.2 skfD对skf的剪切
Claverys和Pei等研究发现,许多细菌毒素免疫蛋白(PlnP、PlnI、PlnT、PlnU和BlpY)均存在肽链内切酶功能,skfD与其具有同源区域,推测skfD具有类似的肽链内切酶活性,可能通过降解skf,而引起自身免疫作用[9,17]。
2.2 细胞对SDP的免疫机制
由sdpI编码的跨膜蛋白SdpI对sdp具有免疫功能,可能与毒素sdp相结合,但其免疫机制尚不清楚[18]。
3 枯草芽孢杆菌同种相食现象生物意义
3.1 维持菌群平衡、推迟芽孢形成
枯草芽孢杆菌形成芽孢需消耗一定能量和时间。如果菌群细胞同时形成芽孢,将消耗大量能量,不利于菌群生长。正在形成或已形成芽孢的细胞也将难以恢复或萌发为营养细胞。“同种相食”过程中释放的营养和能量有利于维持菌群的平衡与稳定。
Nandy等发现当混合枯草芽孢杆菌和大肠杆菌(Escherichia coli)培养时,细菌毒素会先作用大肠杆菌[11]。“同种相食”或“异种相害”,通过杀死其他细胞获取营养,维持多数细胞为营养状态,尽可能地推迟进入芽孢形成阶段,使菌群可继续生长。若营养条件进一步匮乏,多数细胞再“被迫”形成芽孢。因此,“同种相食”现象推迟芽孢形成,有利于菌群生长。
3.2 促进生物被膜形成
生物被膜是指细菌通过分泌多糖基质、纤维蛋白、脂质蛋白等物质,将自身包裹其中,形成大量细菌聚集的膜状物结构粘附于表面。生物被膜是细菌为适应自然环境,有利于自身生存的一种生命现象。López等研究发现[26],枯草芽孢杆菌菌群中,杀死同类的细胞也是产生生物被膜的细胞。被膜基质的形成和“同种相食”均由信号分子脂肽引发,死亡细胞释放的营养首先用于被膜基质的形成。因此,“同种相食”过程促进生物被膜形成,有利于细菌的生存。
4 skf和sdp毒素作为新型生物农药应用前景
4.1 skf毒素的应用前景
Lin等发现skf多肽能杀死水稻白叶枯病的致病菌-水稻白叶枯黄杆菌(Xanthomonas oryzae)[12],它是一种G-菌,寄生于水稻叶片内部深处叶脉内,一般农药不易达到这个位置[27]。这是首次发现枯草芽孢杆菌代谢产物能够抑制水稻白叶枯黄杆菌,自1884年在日本福冈地区首先发现以来,该病发病范围不断扩大,早已遍及世界各水稻产区,尤其对南亚和东南亚稻米生产国造成严重危害[28],目前对该病的防治主要采用噻唑类有机铜杀菌剂,通过对skf深入研究今后有望取代化学农药用于水稻白叶枯病防治。
4.2 sdp毒素的应用前景
Liu等研究发现sdp能够抑制致病菌金黄色葡萄球菌(Staphylococcus aureus)和表皮葡萄球菌(Staphylococcus epidermidis)的生长,其抑制耐甲氧西林金黄色葡萄球菌(MRSA)能力与万古霉素相当[10]。Lamsa等研究表明,sdp对多种人体致病菌具有抗菌活性,其抗菌机制为破坏细胞膜的质子动势(proton motive force)[29]。
目前,通过破坏细胞膜质子动势而起到杀菌作用的主要是G+菌细菌素,如硫醚抗生素、非羊毛硫氨酸细菌素等,其对李斯特菌等致病菌有抑制能力[30]。李斯特菌可侵染多数果蔬使人体致病,因此推测sdp也可通过破坏致病菌细胞膜的质子动势抑制此类致病菌。
目前skf、sdp尚未在农业生产中应用,但由于其具有广谱杀菌性及良好安全性,未来可开发生产新型生物农药。
5 展望
枯草芽孢杆菌在芽孢形成的初期阶段通过形成不同类型的细胞而发生“同种相食”现象,由此产生细菌毒素skf和sdp。
本文在研究提高枯草芽孢杆菌芽孢形成率过程中发现,用显微镜计数细胞数大于平板菌落计数细胞数,前者芽孢形成率低于后者,除平板计数法中菌体没有充分分散外[31],“同种相食”现象也是原因之一。“同种相食”现象研究对认识芽孢形成及生物农药制备有指导作用:若以芽孢为主要生物农药制剂,可阻断“同种相食”现象发生,缩短芽孢形成时间、提高芽孢产量、节约经济成本;通过研究毒素skf和sdp抑菌机理,扩大抗菌谱以及相关基因对产量影响等,可为枯草芽孢杆菌在植病生物防治等领域的开发与应用奠定基础。
[1] 刘雪,穆常青,蒋细良,等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J].中国生物防治,2006,S1(22):179-184.
[2] 李晶,杨谦.生防枯草芽孢杆菌的研究进展[J].安徽农业科学,2008,36(1):106-111.
[3] 程洪斌,刘晓桥,陈红漫.枯草芽孢杆菌防治植物真菌病害研究进展[J].上海农业学报,2006,22(1):109-112.
[4] 姜莉莉,陈彦闯,辛明秀.枯草芽孢杆菌在防治植物病害上的应用及研究进展[J].安徽农学通报,2009,15(7):37-39.
[5] 黄曦,许兰兰,黄荣韶,等.枯草芽孢杆菌在抑制植物病原菌中的研究进展[J].生物技术通报,2010,1(6):24-29.
[6] Yánez-mendiz BAL V,Zeriouh H,Vlas I,et al.Biological control of peach brown rot(MoniliniaSpp.)byBacillus subtilisCpa-8 Is based on production of fengycin-like lipopeptides[J].European Journal of Plant Pathology,2012,132(4):609-619.
[7] Lee G W,Ko J A,Oh B T,et al.Biological control of postharvest diseases of apples,Peaches and nectarines byBacillus subtilisS16 isolated from halophytes rhizosphere[J].Biocontrol Science and Technology,2012,22(3):351-361.
[8] Gonz lez-pastor J E,Hobbs E C,Losick R.Cannibalism by sporulating bacteria[J].Science,2003,301(5632):510-513.
[9] Claverys J P,H Varstein L S.Cannibalism and Fratricide:mechanisms and raisons D'etre[J].Nature Reviews Microbiology,2007,5(3):219-229.
[10] Liu W T,Yang Y L,Xu Y,et al.Imaging mass spectrometry of intraspecies metabolic exchange revealed the cannibalistic factors ofBacillus subtilis[J].Proceedings of the National Academy of Sciences,2010,107(37):16286-16290.
[11] Nandy S K,Bapat P M,Venkatesh K.Sporulating bacteria prefers predation to cannibalism in mixed cultures[J].FEBS Letters,2007,581(1):151-156.
[12] Lin D,Qu L J,Gu H,et al.A 3.1 ku Genomic fragment ofBacillus subtilisencodesthe protein inhibiting growth ofXanthomonas Oryzae Pv.Oryzae[J].Journal of Applied Microbiology,2001,91(6):1044-1050.
[13] Molle V,Fujita M,Jensen S T,et al.The Spo0A regulon ofBacillus subtilis[J].Molecular Microbiology,2003,50(5):1683-1701.
[14] Fujita M,Gonz LEZ-PASTOR J E,Losick R.High-and lowthreshold genes in the Spo0A Regulon ofBacillus subtilis[J].Journal of Bacteriology,2005,187(4):1357-1368.
[15] Flühe L,Burghaus O,Wieckowski B M,et al.Two[4Fe-4S]clusters containing radical sam enzyme skfB catalyze thioether bond formation during the maturation of the sporulation killing factor[J].Journal of the American Chemical Society,2013,135(3):959-962.
[16] Dorenbos R,Stein T,Kabel J,et al.Thiol-disulfide oxidoreductases are essential for the production of the lantibiotic sublancin 168[J].Journal of Biological Chemistry,2002,277(19):16682-16688.
[17] Pei J,Grishin N V.Type П CAAX prenyl endopeptidases belong to a novel superfamily of putative membrane-bound metalloproteases[J].Trends in Biochemical Sciences,2001,26(5):275-277.
[18] Perea Morales T G.Production of and response to the cannibalism peptide sdp inBacillus subtilis[J].Bibliography,2013,163:146-163.
[19] Ellermeier C D,Hobbs E C,Gonzalez-pastor J E,et al.A threeprotein signaling pathway governing immunity to a bacterial cannibalism toxin[J].Cell,2006,124(3):549-559.
[20] Morales T G P,Ho T D,Liu W T,et al.Production of the cannibalism toxin sdp is a multistep process that requires SdpA and SdpB[J].Journal of Bacteriology,2013,195(14):3244-3251.
[21] Marchler-bauer A,Zheng C,Chitsaz F,et al.CDD:Conserved domains and protein three-dimensional structure[J].Nucleic Acids Research,2013,41(D1):D348-D352.
[22] Sievers F,Wilm A,Dineen D,et al.Fast,Scalable generation of high-quality protein multiple sequence alignments using clustal omega[J].Molecular Systems Biology,2011,7(1):539-546.
[23] Linde D,Volkmer-engert R,Schreiber S,et al.Interaction of theBacillus subtilischaperone CsaA with the secretory protein YvaY[J].FEMS Microbiology Letters,2003,226(1):93-100.
[24] Busenlehner L S,Pennella M A,Giedroc D P.The SmtB/ArsR family of metalloregulatory transcriptional repressors:Structural insights into prokaryotic metal resistance[J].FEMS Microbiology Reviews,2003,27(2-3):131-143.
[25] Povolotsky T L,Orlova E,Tamang D G,et al.Defense against cannibalism:The sdpI family of bacterial immunity/signal transduction proteins[J].The Journal of Membrane Biology,2010,235(3):145-162.
[26] LóPEZ D,Vlamakis H,Losick R,et al.Cannibalism enhances biofilm development inBacillus subtilis[J].Molecular Microbiology,2009,74(3):609-618.
[27] 韦日清,林德炘,陈志和.对水稻白叶枯黄杆菌有效药剂筛选和测定方法的研究[J].植物保护学报,1983,10(2):115-117.
[28] Mew T.Current status and future prospects of research on bacterial blight of rice[J].Annual Review of Phytopathology,1987,25(1):359-382.
[29] Lamsa A,Liu W T,Dorrestein P C,et al.TheBacillus subtiliscannibalism toxin sdp collapses the proton motive force and induces autolysis[J].Molecular Microbiology,2012,84(3):486-500.
[30] 谢建华,吴锦瑞,张日俊.细菌素的生物学特性,作用机理和应用[J].饲料工业,2009,30(16):1-5.
[31] 刘宝生,余占桥.一株高度黏连的枯草芽孢杆菌的活菌计数[J].黑龙江畜牧兽医,2011,5:19-21.
