发酵白术对断奶仔猪生长性能和血清生化免疫指标的影响
2014-03-12刁新平王利军陈美霞叶应建武洪志
刁新平,王利军,陈美霞,叶应建,武洪志
(东北农业大学动物科学技术学院,哈尔滨 150030)
近年来,随着养猪技术水平的提高,仔猪普遍早期断奶。而早期断奶会使仔猪受到营养、心理和环境三重应激,导致断奶仔猪出现生长停滞、腹泻(PWD)、免疫功能低下等问题。传统治疗断奶仔猪腹泻常用的方法是在仔猪饲料中添加抗生素,抗生素的滥用会出现病原微生物产生耐药性、动物机体免疫力降低、药物残留等问题[1]。中草药饲料添加剂依据中医药理论,增强机体免疫功能,改善动物产品质量,且无残留、无抗药性、无毒副作用,是抗生素、激素类饲料添加剂的有效替代品。
白术系菊科多年生草本植物根茎,主产于浙江、安徽、江西、湖南、湖北等地,其性温,味甘苦,脾益气,燥湿利水,固表止汗功效[2]。近年研究表明,多糖具有促进机体免疫力、抗菌、抗病毒以及改善动物生产性能等一系列作用,邹云等研究不同条件下添加牛膝多糖对断奶仔猪肠道吸收功能的影响,结果表明,在断奶仔猪日粮中添加中草药牛膝多糖,具有提高仔猪肠道吸收能力和缓解LPS刺激所致肠道吸收功能下降的作用,促进动物的生产效率提高和保健效果[3]。侯伟革等对黄芪多糖和黄芩苷对断奶仔猪生产性能、血液指标和免疫机能影响进行研究,结果表明,日粮中添加黄芪多糖、黄芩苷均可改善断奶仔猪的生产性能。白术多糖能够对机体的免疫机能起到调节和增强作用,常用作中草药饲料添加剂[4]。发酵作为中草药炮制方法之一,能改变药物原有性能,产生新治疗作用,扩大药用品种[5-7]。发酵白术饲料添加剂在养禽业中有较多的研究应用,而对断奶仔猪的研究鲜有报道。本试验通过研究发酵白术饲料添加剂对早期断奶仔猪生长性能、血清生化指标及免疫指标影响,为新型绿色饲料添加剂在仔猪饲养上的合理应用提供理论依据。
1 材料与方法
1.1 材料
白术(Atractylodes macrocephalaKoidz)购自哈尔滨市三棵树药材市场。
枯草芽孢杆菌(Bacillus subtilis)购自中国工业微生物菌种保藏管理中心。
发酵白术添加剂:东北农业大学动物营养实验室制备,采用单因素和正交试验相结合对枯草芽孢杆菌发酵白术发酵工艺进行优化,制得发酵白术添加剂。
采血器材:针头、肝素钠真空管。
试验仔猪:为96头28日龄大×长二元杂交断奶仔猪,体况相近[断奶重(6.0±0.5)kg],公母各半。由哈尔滨市三元种猪场提供。
日粮组成:试验基础饲粮参照2011年农业部公布猪饲养标准,并结合生产实践进行配制,为不含抗生素的玉米—豆粕型饲粮,基础饲粮组成及营养水平见表1。

表1 基础日粮组成和营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets
1.2 试验设计
选用96头健康的(28±2)日龄断奶仔猪(长白×大白),随机分为6个处理,每个处理4个重复,每个重复4头仔猪,公母各半。本试验共33 d,其中预试期为5 d,正式试验期为28 d。采用单栏饲养。第一组饲喂基础日粮+0.1%白术多糖;第二组饲喂基础日粮+0.2%白术多糖;第三组饲喂基础日粮+0.3%白术多糖;第四组饲喂基础日粮+0.2%未发酵白术;第五组饲喂基础日粮+抗生素(杆菌肽锌+硫酸粘杆菌素);第六组为对照组,仅喂基础日粮。
1.3 饲养管理
试验在同一栋封闭猪舍内进行,定时定点投料、自由饮水,免疫消毒程序按猪场常规方法进行。以重复栏为单位饲喂,并做好喂量记录。试验猪采用群饲,料型为粉料,整个试验期为33 d,其中预试期5 d,正试期28 d。在预试期,逐步改变饲料种类与饲养方式,直至饲料更改完全。按猪的采食量调整给料量,使每次给料后都能食尽。在预试期结束正试期开始时对试验猪重新称重,个别调整使组间差异不显著(P>0.05)。试验期前14 d每天喂4次,第15天到试验结束每天喂3次,均采取粉料干喂,自由饮水。转入正式试验期后,各试验组的猪接受试验设计中不同试验因子日粮,饲喂制度和方式不变。每天观察记录试验猪的食欲、腹泻率等情况。驱虫和防疫处理根据猪场统一要求实施。
1.4 指标测定
1.4.1 生长性能指标及测定
于断奶第1、14、28天早饲前对各组仔猪进行称重,并对各组饲料称重,以计算各组平均日增重、平均日采食量和料肉比。试验期间,每天早上8:00前观察并记录仔猪粪便形态及健康状况,以计算仔猪腹泻率。计算公式如下:
平均日增重=阶段总增重/(阶段时间×各组仔猪头数);
平均日采食量=阶段采食量/(阶段时间×各组仔猪头数);
料肉比(%)=(平均日采食量/平均日增重)×100%;
腹泻率(%)=(各组水样粪仔猪头数×腹泻天数/各组仔猪总头数×试验天数)×100%。
1.4.2 血清免疫指标及测定
在试验第14、28天早晨,每个重复随机选取1头体重相近的仔猪,前腔静脉采血5 mL,置于肝素钠真空管中,3000 r·min-1离心15 min,分离血清,-80℃保存,待测血清免疫指标。测定指标如下:免疫球蛋白A(IgA),免疫球蛋白G(IgG),免疫球蛋白M(IgM)。采用全自动生化分析仪测定血清免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)含量,试剂盒均购自南京建成生物工程研究所。测定仪器为CX9ALX-全自动生化分析仪,由上海金马试剂有限公司协助完成。测定过程按试剂盒说明书进行操作。
1.4.3 血清生化指标及测定
在试验第14、28天早晨,每个重复随机选取1头体重相近的仔猪,前腔静脉采血5 mL左右,置于肝素钠真空管中,3000 r·min-1离心15 min,分离血清,-80℃保存,待测血清生化指标。测定指标如下:血清中总蛋白(TP)、白蛋白(ALB)谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)。试剂采用上海丰惠生物公司试剂盒,在BECKMAN全自动生化分析仪(美国贝克曼仪器公司)上测定,由黑龙江省电力医院协助完成。测定过程按试剂盒说明书进行操作。
1.5 统计分析
试验数据采用SPSS 17.0软件中Anova模型进行单因子方差分析,进行LSD多重比较,结果以“平均值±标准误”表示。
2 结果与分析
2.1 生长性能指标
2.1.1 添加发酵白术对仔猪断奶后1~14 d生长性能的影响
由表2可知,在0~14日龄阶段,在平均采食量和日增重方面,一、二、三组添加发酵白术与四组未发酵组和六组基础日粮组之间差异显著(P<0.05),与基础日粮组相比平均采食量分别增加15.79%、17.41%、30.56%,日增重分别增加42.21%、38.64%、60.39%。在料肉比方面,添加0.1%和0.3%发酵白术组与其他组差异显著(P<0.05),添加0.2%发酵白术组较四、五、六组也差异显著(P<0.05),但是没有与一、三组的差异性显著。在腹泻率方面,添加0.2%、0.3%发酵白术时,其腹泻率均较低但两者之间差异不显著(P>0.05),添加0.1%发酵白术与四、五、六组相比差异显著(P<0.05)。添加未发酵白术组其日增重、日采食量均低于基础日粮组。综合以上分析,在断奶0~14期间,添加0.3%发酵白术其效果均优于其他组。

表2 日粮中添加发酵白术对仔猪断奶后1~14 d生长性能的影响Table 2 Effect on the growth performance of fermented Atractylodes of weaned piglets after 1-14 days
2.1.2 添加发酵白术对仔猪断奶后15~28 d生长性能的影响
由表3可知,各试验组断奶仔猪日采食量显著提高(P<0.05),添加0.2%和0.3%发酵白术组较其他组均差异显著(P<0.05),但此两组之间差异不显著(P>0.05)。在平均日增重方面,添加0.2%发酵白术和抗生素组较其他组均差异显著(P<0.05),但此两组之间差异不显著(P>0.05)。在料肉比方面,添加0.2%发酵白术、抗生素和基础日粮组较其他组均差异显著(P<0.05),但是添加0.2%发酵白术和基础日粮组差异不显著。在腹泻率方面,添加0.2%和0.3%发酵白术组较其他组均差异显著(P<0.05),但此两组之间差异不显著(P>0.05)。结合各处理组并从经济角度考虑,在断奶15~28 d期间添加0.2%发酵白术其效果均优于其他组。

表3 日粮中添加发酵白术对仔猪断奶后15~28 d生长性能的影响Table 3 Effect on the growth performance of fermented Atractylodes of weaned piglets after 15-28 days
2.1.3 添加发酵白术仔猪断奶后1~28 d生长性能的影响
由表4可知,从试验全期来看,采食量随着发酵白术添加量的增加而增加且各组之间差异显著(P<0.05),说明在日粮中添加适量的发酵白术可提高断奶仔猪采食量,减缓断奶应激。但未发酵组均低于各发酵组和抗生素组。不同添加量发酵白术组其日增重均显著高于未发酵组、抗生素组和基础日粮组,且三个不同水平的添加量间差异显著(P<0.05),其中0.2%发酵白术组日增重最高。在料肉比方面,0.1%和0.2%发酵白术组较其他组均差异显著(P<0.05),但添加0.1%和0.2%发酵白术组两组之间差异不显著(P>0.05)。在腹泻率方面,0.2%和0.3%发酵白术组较其他组均差异显著(P<0.05),但添加0.2%和0.3%发酵白术组两组之间差异不显著(P>0.05)。由此可见,饲料中添加发酵白术有助于提高饲料转化率,降低生产成本。综合考虑,以添加0.2%发酵白术组最佳。
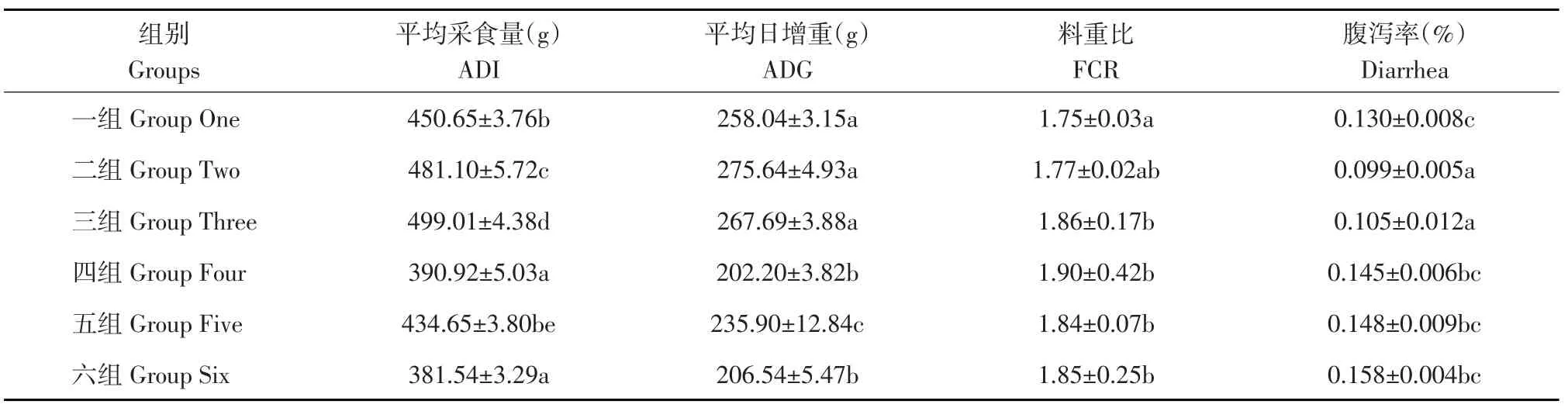
表4 日粮中添加发酵白术仔猪断奶后1~28 d生长性能的影响Table 4 Effect on the growth performance of fermented Atractylodes of weaned piglets after1-28 days
2.2 血清免疫指标
由表5可知,在1~14日龄阶段,个试验组均优于对照组,且免疫球蛋白IgG、IgM各个试验组与对照组差异显著(P<0.05),仔猪血清中IgA的含量,除试验一组和未发酵四组外,二、三组与基础日粮组相比有显著提高(P<0.05),其中添加0.2%发酵白术(二组)与抗生素组相比也显著提高(P<0.05);对于IgG,与对照组相比,发酵白术一组、二组、三组IgG的水平含量均有显著提高(P<0.05),未发酵组也有提高趋势,其中添加0.2%发酵白术组最好;试验二组、三组IgM水平含量与对照组和抗生素组相比均显著提高(P<0.05),其中三组IgM水平含量高于二组,发酵白术二组、三组与未发酵白术组相比显著提高(P<0.05)。综合IgA、IgG、IgM三个指标的含量,在1~14日龄,添加0.2%发酵白术为最佳;在1~28 d整个试验阶段,0.2%发酵白术组和0.3%发酵白术组IgA含量与基础日粮组和抗生素组相比均显著提高(P<0.05),但两者之间差异不显著(P>0.05),未发酵白术组介于基础日粮组和抗生素组之间,与两者差异不显著(P>0.05);对于IgG,0.2%发酵白术组和0.3%发酵白术组以及抗生素组三者之间差异不显著(P>0.05),而与其他三组相比差异显著(P<0.05),0.1%发酵白术组与基础日粮组差异不显著,未发酵组与基础日粮组相比显著降低;中草药发酵白术组(一组、二组、三组)IgM水平含量与基础日粮组相比均显著提高(P<0.05),但与抗生素组相比差异不显著(P>0.05),其中发酵白术二组、三组与未发酵组相比IgM水平含量显著提高(P<0.05),但发酵白术二组和三组差异不显著(P>0.05)。综合考虑,添加0.2%发酵白术为最优选择。

表5 日粮中添加发酵白术对仔猪断奶后1~14 d和1~28 d免疫指标的影响Table 5 Effect on the growth performance of fermented Atractylodes of weaned piglets after 1-14 days and 1-28 days
2.3 血清生化指标
2.3.1 添加发酵白术对仔猪断奶后1~14 d血清生化指标的影响
由表6可知,在断奶后1~14 d内,0.2%发酵白术试验组TP含量与抗生素组差异不显著(P>0.05),与其他组相比均显著提高(P<0.05)。ALB含量0.2%发酵白术组最高,显著高于0.1%发酵白术组和未发酵白术组,与其他组相比有增加趋势。0.2%发酵白术组BUN含量显著(P<0.05)低于未发酵白术组和基础日粮组,与基础日粮组相比降低22.57%,与抗生素组相比降低13.74%;ALT含量,各个试验组、对照组及抗生素组之间差异不显著(P>0.05),试验组与对照组相比分别降低:13.04%、14.37%、14.87%,其中,0.2%白术发酵组和0.3%白术发酵组与抗生素相比有所降低;AST含量,各个试验组、对照组及抗生素组之间差异不显著(P>0.05),但是试验组与对照组及未发酵白术组相比有降低趋势,三个试验组与对照组相比分别降低3.05%、14.60%、8.11%。综合以上分析,0.2%发酵白术添加量为最佳。

表6 日粮中添加发酵白术对仔猪断奶后1~14 d血清生化指标的影响Table 6 Effect on the growth performance of fermented Atractylodes of weaned piglets after 1-14 days
2.3.2 添加发酵白术对仔猪断奶后1~28 d血清生化指标的影响
由表7可知,在断奶后1~28d整个试验阶段,试验一组、二组血清中TP含量均高于对照组,试验三组和未发酵组与对照组相比没有提高,其中试验二组与对照组相比提高12.34%;与对照组相比,试验二组、三组血清中ALB含量均高于对照组,其中,试验二组与对照组和抗生素组相比血清中ALB含量分别增加:16.11%和2.60%,未发酵白术组和试验一组比对照组低;BUN含量,各试验组与对照组相比均有所降低,其中,0.2%发酵白术组与对照组和未发酵组相比分别显著(P<0.05)降低:26.10%和21.93%,与抗生素组相比降低不显著(P>0.05);各试验组血清中ALT含量之间差异不显著(P>0.05),0.2%发酵白术试验组血清中ALT含量与对照组相比显著(P<0.05)降低28.00%,与未发酵白术组相比降低20.20%(P<0.05),与抗生素组相比降低21.36%;血清中AST含量,0.1%和0.2%发酵白术试验组与对照组相比有降低趋势。0.3%发酵白术试验组与对照组相比显著降低(P<0.05),与抗生素组和未发酵白术组相比有降低趋势,但差异不显著(P>0.05)。

表7 日粮中添加发酵白术对仔猪断奶后1~28 d血清生化指标的影响Table 7 Effect on the growth performance of fermented Atractylodes of weaned piglets after 1-28 days
通过以上分析,可知添加0.2%的发酵白术为最佳选择。
3 讨论
中草药饲料添加剂存在用药成分复杂,含量低,适口性差,效果不稳定,用量大、难以掌握、及毒副作用等问题,阻碍中草药饲料添加剂的规模化推广应用。发酵作为中草药炮制方法,能改变药物原有性能,产生新的治疗作用,扩大药用品种,微生物发酵中草药是利用微生物降解作用,将中草药中有效成分、活性物质最大限度地释放出来,并对中草药活性成分进行修饰产生新的活性物质,消除其自身的抗营养因子。因此白术经发酵后能有效促进断奶仔猪的消化吸收,提高其药用价值。
3.1 发酵白术对断奶仔猪生产性能的影响
本试验表明,白术多糖对断奶仔猪腹泻、生长停滞等有治疗作用。植物多糖所含免疫活性物质具有多靶点,增强机体免疫机能,提高动物抗应激、抗疾病能力,改善动物生产性能,具有低残留、不易产生耐药性等优点[8-9]。刁新平等对发酵茯苓研究表明[10],茯苓多糖对断奶仔猪生长性能及腹泻有影响,经发酵后茯苓多糖含量增加,降低茯苓添加量。侯伟革等研究表明[4],日粮中添加黄芪多糖、黄芩苷均可以改善断奶仔猪的生产性能,添加剂量为0.05%的黄芪多糖与0.05%的黄芩苷效果最好。而白术多糖作为具备免疫调节中草药多糖,在临床上的应用和研究亦有报道。胡晓蕾等研究表明,在SD大鼠基础日粮中添加一定剂量的白术及白术多糖均能有效提高SD大鼠的生长性能,尤其在日增重和料肉比方面[11]。赵燕飞等研究表明[12],在日粮中添加0.2%白术多糖能显著提高断奶仔猪的日增重及降低腹泻率。本试验研究表明,在断奶仔猪日粮中添加发酵白术对断奶仔猪的日增重、料重比均显著提高。
本试验添加0.2%未发酵白术组与发酵白术组相比差异显著,表明发酵可改善白术药效特性,使其最大限度释放,提高断奶仔猪采食量。各个发酵组的腹泻率与未发酵组和基础日粮组均显著降低。而本试验使用枯草芽孢杆菌发酵白术,芽孢杆菌添加剂具有类似于泰乐菌素的效果,明显改善机体内菌群组成并具有促生长功效,芽孢杆菌在颗粒料、粉料的加工过程中以及酸性环境中具有较高稳定性,在肠道内环境中增殖而发挥作用,分泌较强活性的蛋白酶及淀粉酶,促进饲料营养物质的消化。还可减少粪和消化道中的大肠埃希氏菌数量[13],对白术多糖有辅助增强作用。仔猪断奶后15~28 d,仔猪自身消化系统逐渐完善,试验各组采食量均逐渐增高,但程度有所不同,添加0.2%和0.3%发酵白术组平均日采食量较其他各组均差异显著。添加0.2%发酵白术组较基础日粮组提高30.38%。本试验中仔猪断奶后2 d开始出现腹泻,对照组腹泻情况较重,添加0.2%发酵白术的腹泻率最低,各发酵白术组仔猪恢复较快。原因是白术多糖可抑制肠到大肠杆菌生长,减少活菌数量,起到调节肠道菌群平衡的作用[14],李继昌等研究乌连止泻颗粒剂由乌梅、黄连、白术、木香、干姜、甘草组成,是治疗腹泻病的纯中药制剂,其中白术有健脾益气、燥湿利水的作用等[15]。彭慧珍等研究表明,一定剂量的白术多糖能较显著降低盲肠中大肠杆菌的数量,显著提高乳酸菌和双歧杆菌的数量,降低肠道有害菌的增殖,提高有益菌数量,改善胃肠道微生物菌群比例,降低断奶仔猪腹泻率,增加消化率,增加采食量[8]。
3.2 发酵白术对断奶仔猪血清免疫功能的影响
免疫球蛋白是一类存在于机体内广泛参与体液免疫反应的球蛋白,免疫球蛋白主要包含IgG、IgA和IgM,其中由脾脏和淋巴结中产生的IgG与外分泌液中的IgA具有抗菌、抗病毒等免疫活性,初次体液免疫反应中出现的IgM具有激活补体等生物学功能[16]。
本试验研究表明,饲粮中适量添加白术多糖饲喂断奶仔猪,可不同程度提高仔猪IgG、IgA和IgM含量,其中,试验前期和试验全期0.2%发酵白术组的IgG、IgA和IgM含量均为最高,均与对照组差异显著(P<0.05)。在试验前期三个发酵白术试验组中IgA和IgM的含量显著高于抗生素组(P<0.05)。胡晓蕾等研究不同浓度白术多糖对SD大鼠血清IgG、IgA和IgM水平的影响,除0.5%白术多糖组外,其余各试验组在提高大鼠免疫球蛋白水平上均好于对照组[17]。0.2%白术多糖组与对照组相比,IgG、IgA、IgM水平分别提高19.1%、17.3%、和22%,本试验与此研究结果一致。彭新国研究发现白术对抗体形成细胞有刺激作用[18],能使抗体分泌量增高。宋海英等使用100%白术浸出液定期给小鼠灌胃[19],发现试验组可明显促进小鼠血清IgG含量增加,较之对照组提高37.59%,差异极显著(P<0.01)。蔡玉梅等用黄连、黄芪、黄芩、党参、白术、板蓝根等20味中药组成金鸡散[20],免疫当日采用2.5%的金鸡散拌料连用5 d对新城疫免疫有明显增效作用,可显著提高血清中ND抗体滴度及IgG的含量,使IgG高峰持续时间延长,并延缓IgA、IgM下降,其免疫增效作用优于左旋咪唑,提高机体的体液免疫功能。李玉在仔猪饲料中添加复方中药(党参、黄芪、茯苓、甘草)[21],在试验43 d时,血清 IgG、IgA 水平分别提高 12.7%(P<0.05)和24.44%(P<0.05)。
体液免疫是指由抗原刺激B淋巴细胞,引起B细胞活化、增殖与分化,形成浆细胞,并产生抗体,以及由抗体发挥一系列免疫效应的过程。动物机体的体液免疫由抗体介导,血清中抗体水平高低为评估其免疫状况的重要指标之一。所有哺乳动物血清内均含有IgG和IgM。IgG有抗菌、抗病毒作用,抗毒素也主要为IgG,能中和毒素使其失去毒性,调理、凝聚和沉淀抗原,在体液免疫中最为重要。IgM在体内最早产生,但是持续时间短,是机体初次接触抗原物质最早产生的抗体,有抗菌、抗病毒和中和毒素功能。在机体受到病原感染后与补体结合,溶解病原体的作用很强。因此,断奶仔猪血清中IgG和IgM提高,可减少仔猪腹泻发生。
生物活性多糖可作为疫苗佐剂,促进抗体产生,其多糖本身也可作为一种抗原,刺激机体产生相应的抗体,但作用较弱[22]。中草药多糖可解除环磷酰胺对抗体形成细胞抑制作用,增进B细胞功能,对淋巴细胞有较强活化作用,能提高IgG、IgM的含量[23]。白术多糖提高仔猪体液免疫功能的原因可能是由于淋巴细胞数量增加,提高淋巴细胞转化率,最终使体液免疫功能得到调节。但白术多糖提高仔猪体液免疫功能的机理有待进一步研究。
3.3 发酵白术对断奶仔猪血清生化指标的影响
血清TP和ALB浓度反映机体蛋白质的吸收、合成和分解状况及机体的免疫机能状态[24]。血清ALB参与机体组织蛋白合成,是血液缓冲剂,维持血浆胶体渗透压,可作为金属离子、脂肪酸、氨基酸和激素等的运输载体,ALB主要由肝脏合成,血清ALB反映肝功能状态和机体的免疫状态[25]。因此,当肝脏发生病变时,肝细胞合成蛋白质的能力下降,引起血液中的蛋白质发生质和量的改变。血清蛋白具有运输大分子营养物和免疫等功能。李香子等研究报道指出[26],当血清总蛋白、白蛋白含量升高时,猪的消化吸收、营养物质代谢加强,特别是蛋白质代谢,仔猪机体免疫力提高。本试验向断奶仔猪日粮中添加发酵白术,发现血清TP和ALB含量在试验前期和试验全期均高于抗生素组和基础日粮组,添加0.2%发酵白术组效果最佳。这表明发酵白术能促进仔猪对蛋白质的吸收与利用,在一定程度上改善仔猪的免疫机能,有利于仔猪生长,与田允波等研究白术多糖对仔猪生血清生化参数的影响报道一致[27]。
肝脏是异源物质在机体进行转化和代谢的主要场所。ALT和AST是评价肝细胞损伤或坏死的最可靠指标,是动物体内重要的转氨酶,在非必需氨基酸的合成和蛋白质分解代谢中起重要中介作用[28]。其中AST存在于肝脏细胞中,参与氨基酸代谢,是一种转氨基活性最高的酶。动物受应激或损伤时,会造成细胞、线粒体受损,AST和ALT逸出细胞进入血液,使其血液浓度升高[29]。本试验结果表明,在试验1~14 d,添加发酵白术组血清中ALT和AST含量与对照组相比均差异不显著,在试验1~28 d,添加0.2%发酵白术与对照组相比能显著降低血清中AST含量,而血清中ALT含量有降低趋势,差异不显著,白术多糖可提高仔猪肝脏蛋白质的合成,使体内各种非必需氨基酸的转化和生成增加,有利于氨基酸平衡。试验仔猪日增重和饲料报酬的改善,与其血液中GOT和GPT活性的提高、蛋白质代谢作用加强一致。
血清尿素氮为蛋白质代谢后产物。许多研究把血清尿素氮作为动物体内蛋白质代谢和日粮氨基酸平衡状况的反映指标[30-31]。血清中尿素氮水平反映血液中氨基酸合成蛋白质效率的高低,血清中尿素氮含量降低反映动物体内蛋白质合成增强,反之,表示动物体内蛋白合成代谢减弱[32-33]。血氨是蛋白质的代谢产物,在肝脏中合成尿素,所以血清中尿素氮水平反映肝脏机能状况。对机体蛋白质和脂类的合成与代谢,肝脏的机能具有正效应。本试验研究表明,日粮中添加各种水平发酵白术后随着日粮中发酵白术添加量的增加,断奶仔猪血清尿素氮含量下降。说明体内氨基酸分解减弱,氮存留增加,留存时间延长,试验猪蛋白质沉积增加。这与本试验中平均日增重提高的结果一致。
4 结论
在断奶仔猪饲粮中添加发酵白术能有效提高断奶仔猪生长性能和降低腹泻率,可调节断奶仔猪机体的氨基酸代谢,降低转氨酶活性,增强其部分免疫功能;综合分析日粮成本及营养物质浓度等因素,本试验认为,断奶仔猪日粮中0.2%发酵白术是适宜的添加剂量。
[1] 龙全江,徐雪琴,胡昀.白术的化学、药理与炮制研究进展[J].中国中医药信息杂志,2004,11(11):1033-1035.
[2] 杨光玲,吴梅艳,高洪斌,等.对大肠杆菌病的药敏试验报告[J].山东家禽,2001(1):10-11.
[3] 邹云,任芬芬,贺建华,等.不同条件下添加牛膝多糖对断奶仔猪肠道吸收功能的影响[J].湖南畜牧兽医,2012(4):5-7.
[4] 侯伟革.黄茂多糖和黄芬甙对断奶仔猪生产性能、血液指标和免疫机能影响的研究[D].保定:河北农业大学,2006,6.
[5] 王林,王玉红,章克昌.灵芝中药发酵液对慢性支气管炎疗效的研究[J].中国食用菌,2004,23(5):39-41.
[6] 戴万生,赵荣华.发酵法对大黄蒽醌类成分含量的影响[J].云南中医中药杂志,2005,26(1):38-39.
[7] 李国红,沈月毛,王启方,等.发酵三七中的皂苷成分研究[J].中草药,2005,36(4):499-500.
[8] 彭慧珍.白术粗多糖对断奶仔猪生长与免疫性能影响的研究[D].长沙:湖南农业大学,2006:6-10.
[9] 林文卫,陈迪华,高微微,等.中草药提取物的抑菌试验[J].中国饲料,1999,12(12):12.
[10] 刁新平,武洪志.发酵茯苓添加剂对断奶仔猪生长性能、腹泻率影响[J].东北农业大学学报,2013,44(6):8-11.
[11] 胡晓蕾,胡迎利,汪以真.白术及白术粗多糖对SD大鼠生长性能和免疫功能的影响[J].中国兽药杂志,2006,40(1):2-6.
[12] 赵燕飞,汪以真,王静华.白术、微米白术及白术多糖对断奶仔猪生长性能和免疫功能的影响[J].中国畜牧杂志,2012,48(13):56-59.
[13] 杨俊琦.枯草芽孢杆菌对断奶仔猪生长性能及免疫功能的影响[J].猪业科学,2012,42(6):42-43.
[14] 刘惠,李丽立.中草药复合粗多糖对断奶仔猪肠道消化生理影响的研究[D].长沙:湖南农业大学,2007:6-10.
[15] 李继昌,于文会,张秀英,等.乌连止泻颗粒剂中挥发油提取和包合工艺研究[J].东北农业大学学报,2010,41(12):86-90.
[16] 谢红兵.复方中草药免疫增强剂对断奶仔猪免疫功能的影响[D].福州:福建农林大学,2004:30-31.
[17] 胡晓蕾,胡迎利,汪以真.白术及白术多糖对SD大鼠生长性能和免疫功能的影响[J].中国兽药杂志,2006,40(1):2-6.
[18] 彭新国,邱世翠,李彩玉,等.白术对小鼠免疫功能影响的实验研究[J].时珍国医国药,2001,12(5):396-397.
[19] 宋海英,蒋桂,邱世翠,等.白术对抗体形成细胞的作用研究[J].时珍国医国药,2004,15(9):565-566.
[20] 蔡玉梅,吴绍强.金鸡散对鸡新成疫免疫的辅助效果研究[J].山东农业大学学报:自然科学版,2001,32(1):29-32.
[22] 李玉,陈亮,孟庆娟,等.复方中药制剂对仔猪生长性能及免疫机能的影响[J].动物营养与饲料科学,2001,38(10):9-13.
[22] 文贵辉,李丽立,张彬,等.白术及白术多糖在动物生产中的研究应用[J].湖南环境生物职业技术学院学报,2008,14(4):52-55.
[23] 张继东,王志祥.中草药多糖的免疫调节机制及其应用[J].饲料工业,2006,27(6):1-4.
[24] 高士争,葛长荣,田允波,等.中草药添加剂对生长肥育猪血液生理生化指标的影响[J].云南农业大学学报,2002,17(2):164-169.
[25] 欧阳五庆.动物生理学[M].北京:科学出版社,2006.
[26] 李香子,张敏,严昌国,等.新型猪用绿色饲料添加剂的开发与应用——对血液生化指标的影响[J].延边大学农学学报,2003,25(4):287-291.
[27] 田允波,周家容,李琦华,等.白术多糖对仔猪生长性能和血清生化参数的影响[J].营养饲料,2009,45(9):45-48.
[28] Song K,Shan A S,Li J P.Effect of different combinations of enzyme preparation supplemented to wheat based diets on growth and serum biochemical values of broiler chickens[J].Acta ZoonutrimentaSinica,2004(4):25-29.
[29] Bogin,Peh H.C,Avidar Y,et al.Sex and genotype dependence onthe effects of long term high environmental temperatures oncellular enzyme activities from chicken organs[J].Avian Pathol,1997,26:511-524.
[30] Borg B S.Effect of tryptophan supplementation of a low proteincorn-sunflower meal diet for young growing pigs[J].Anim Sci,1985,61(1):300.
[31] Malmolf K.Amino acid in farm animal nutrition metabolism,partition and consequences of imbalance[J].Swedish Journal of Agriculture Research,1988(4):191-193.
[32] Eggum R O.Blood urea measurement as a technique for assessing protein quality[J].Nutr,1970,24:983-989.
[33] Brown J A,Clinc T R.Urea excretion in pigs:an indicator of quality an anima acid requirements[J].Nutr,1974,104:542-553.
