猪组织中氟尼辛残留量的HPLC测定方法试验
2014-03-11周伟伟卜仕金
陈 未,周伟伟,卜仕金
(1.江苏农牧科技职业学院,江苏 泰州225300;2.扬州大学兽医学院,江苏 扬州225000)
氟尼辛(Flunixin)属于非甾体类抗炎药物(NSAIDs),主要通过抑制环氧化酶、减少前列腺素等炎性介质的生成而发挥解热、镇痛和抗炎作用,兽医临床应用广泛、效果确凿。目前,氟尼辛的相关制剂产品在国内兽医临床已批准使用,但针对动物源性食品中氟尼辛残留量的检测方法还鲜有报道。本试验研究建立了猪肌肉、皮脂肾脏、肝脏4种组织中氟尼辛残留检测的HPLC检测方法,为进一步加强动物源性食品中该药物的残留监控及消除规律研究提供了参考。、
1 试验材料
1.1 仪器与设备 Waters e2695高效液相色谱仪(美国Waters公司);R-210A型旋转蒸发仪(瑞士Buchi公司);组织匀浆机B-400(瑞士Buchi公司);CR22GⅡ高速冷冻离心机(Hitachi公司)等。
1.2 试剂与材料 乙腈,色谱纯(德国Merck公司);甲醇,色谱纯(德国Merck公司);磷酸,优级纯(天津市科密欧化学试剂开发中心);三乙胺,优级纯(天津市科密欧化学试剂开发中心);三氯乙酸,分析纯(国药集团化学试剂有限公司);PCX固相萃取小柱,300mg/6mL(美国Agilent公司)。
标准品:氟尼辛葡甲胺(flunixinmeglumine,FM),对照品:含量99%,批号81013,购自德国Augsburg公司。
2 试验方法
2.1 试料制备与保存 取适量新鲜或解冻的未用药空白猪组织(肌肉、肝脏、肾脏、皮肤及脂肪),绞碎并使均质。取均质后的供试样品,作为供试试料;取均质后的空白样品,作为空白试料;取均质后的空白样品,添加适宜浓度的标准溶液,作为空白添加试料。-20℃以下贮存备用。
2.2 试液的配置:
2.2.1 氟尼辛标准储备液(200μg/mL) 精确称取氟尼辛葡甲胺标准品8.30mg,置于50mL容量瓶中,用80%甲醇水溶液定容至刻度,配制成浓度为200μg/mL的氟尼辛标准储备液。-20℃以下保存,有效期6个月。
2.2.2 氟尼辛标准工作液(10μg/mL) 准确量取200μg/mL的氟尼辛的标准储备液5 mL,置于100 mL棕色容量瓶中,用80%甲醇水溶液定容,配制成浓度为10μg/mL的氟尼辛标准工作液。4℃保存,有效期3个月。
2.3 样品前处理 准确称取均质后试料5(±0.05)g于50mL聚丙烯带盖离心管中,加入无水硫酸钠5 g,再加15mL 1%TCA-乙腈溶液,高速涡动2min,5 000 r/min(10℃)离心5min,上清液入50mL聚丙烯带盖离心管中。下层残渣用15mL提取液重复提取1次,合并上清液,向离心管中加入10mL乙腈饱和的正己烷,高速涡旋1min后5 000 r/min(4℃)离心5min,弃上层液体,下层入100mL鸡心瓶,并加入5mL的正丙醇于45℃旋转蒸发至近干。向蒸至近干的鸡心瓶中加入3mL乙腈,涡旋振荡3min,溶解残渣后移至50mL聚丙烯带盖离心管中,加入9 mL 2%磷酸高速涡旋1min,4℃保存备用。采用PCX阳离子交换柱进行固相萃取,小柱依次用6mL甲醇活化、6mL水平衡,上样后依次用6mL水、6mL甲醇淋洗,待小柱干燥后用6mL 10%氨化甲醇洗脱,收集洗脱液于玻璃试管内,60℃下氮气吹干,残留物用1.0mL流动相复溶,过0.22μm有机滤膜,滤液供检测。
2.4 色谱条件 色谱柱:伊利特ODS-2色谱柱(250×4.6mm,5μm);流动相:甲醇-0.05mol/L磷酸三乙胺溶液(60/40,v/v,pH=3.8);波长:333 nm;流速:1mL/min;进样量:80μL;柱温:30℃。
2.5 标准曲线的绘制 准确吸取2.2.2配制的标准工作液适量,依次用流动相稀释成5、2、1、0.5、0.1μg/mL和0.02μg/mL的标准工作液。在选定的色谱条件下,按浓度从低到高的顺序分别进样80μL作HPLC分析。每个浓度重复5次。以氟尼辛浓度为横坐标,相应的峰面积为纵坐标绘制标准曲线。
2.6 检测限与定量限测定 配制系列浓度氟尼辛标准工作液添加于空白试料(肌肉、肾脏、肝脏、皮肤及脂肪)中,制得相应组织药物浓度,按2.3方法处理,重复5次,作HPLC测定。测得各样品的峰高与噪音(基线峰高),取信噪比(S/N)≥3时的浓度为检测限;结合准确性和精密度试验,取信噪比(S/N)≥10时的浓度为定量限。
2.7 准确性测定 准确称取空白试料,添加不同氟尼辛标准工作液,制得不同添加浓度的供测样品。经2.3方法处理后,作HPLC测定;同时用对应浓度的氟尼辛标准液作HPLC测定。每一浓度分别重复5次。回收率的计算公式为:
式中:A为预处理后组织中氟尼辛的实测峰面积;As为对应标准液中氟尼辛的峰面积。
2.8 精密度测定 按2.7操作对各浓度样品在同日内重复测定5次,测得氟尼辛峰面积,计算日内变异系数;在一周内不同日对4个浓度样品进行5次重复测定,测得氟尼辛的峰面积,计算日间变异系数。
2.9 计算方法 试样中氟尼辛的残留量(mg/kg)
计算式:
式中:X-试料中氟尼辛的残留量,mg/kg;C-试样溶液中氟尼辛的浓度,mg/L;V1-复溶用流动相的总体积,mL;V2-过PCX固相萃取柱所用备用液体积,mL;V-定容用流动相的总体积,mL;M-试料的质量,g。
3 试验结果
3.1 色谱行为 氟尼辛对照品、空白组织、药物添加样品色谱图分别见图1。
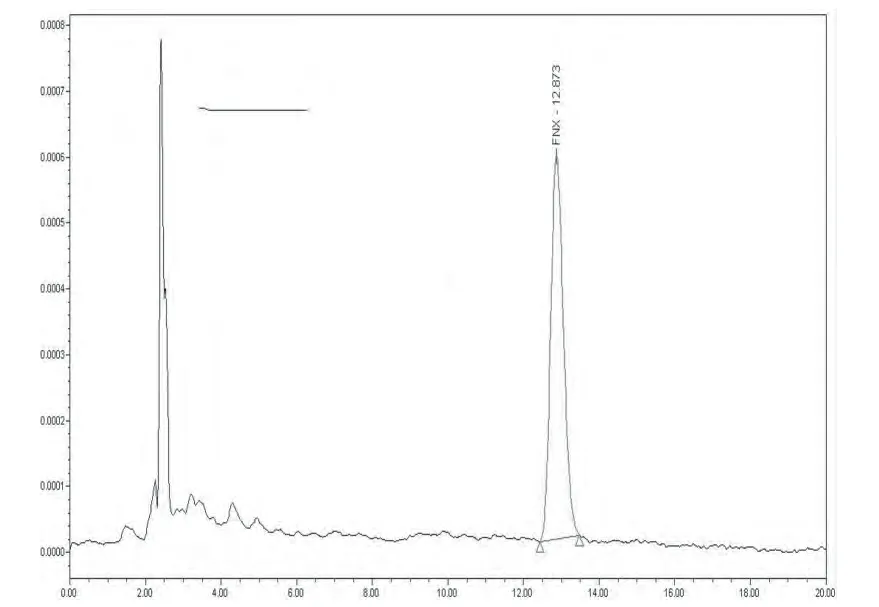
图1 标准溶液色谱图 (0.2μg/mL)
3.2 标准曲线和线性范围 在建立的色谱条件下,用HPLC测定氟尼辛标准工作液中各个浓度,药物浓度在0.02~5μg/mL范围内,各浓度与其响应值呈良好的线性关系(R2≥0.999),得到标准曲线线性回归方程。在建立的色谱条件下,氟尼辛的标准品平均浓度与其平均峰面积的回归方程为:
y=72604x+949.99(R2=0.9998)
3.3 检测限和定量限 根据5个空白样品的基线噪音值求其平均值,取信噪比S/N≥3时氟尼辛的最低浓度,测得氟尼辛在肌肉、皮脂、肾脏、肝脏4种组织的最低检测限分别为10、6、15、15μg/kg;根据精密度和准确度测定结果,取信噪比S/N≥3时氟尼辛的最低浓度,测得氟尼辛在肌肉、皮脂、肾脏、肝脏4种组织的最低定量限分别为25、10、30、30μg/kg。
3.4 添加回收率 猪肌肉在25、50、500μg/kg和1 000μg/kg4个添加浓度的平均回收率分别为83.66±3.97%、86.27±3.98%、82.76±5.37%、86.98±4.72%;猪皮肤及脂肪在10、20、500μg/kg和1 000 μg/kg 4个添加浓度水平的平均回收率分别为84.71±5.17%、86.62±4.11%、87.92±5.31%、90.69±4.32%;猪肾脏在30、60、500μg/kg和1 000μg/kg 4个添加浓度水平的平均回收率分别为79.55±5.33%、81.27±3.87%、84.56±7.27%、87.43±6.26%;猪肝脏在30、60、500μg/kg和1 000μg/kg 4个添加浓度水平的平均回收率分别为77.05±3.40%、78.98±5.50%、80.50±5.56%、78.49±3.06%。
3.5 精密度 猪肌肉、皮肤及脂肪、肾脏和肝脏中在3.4不同添加浓度的氟尼辛残留精密度见表1。

表1 猪组织样品精密度测定
4 讨论
氟尼辛含有羧基和氨基,极性较大,在酸性条件下容易形成正离子。因此,利用酸性溶液提取,并利用阳离子交换柱进行净化和富集就成了首选方法。猪组织中脂肪和蛋白质含量较高,如何除去脂肪和沉淀蛋白成为试验的关键。三氯乙酸(TCA)是常用的酸性蛋白沉淀剂[1],采用乙腈和TCA的混合提取液。空白添加试验发现,各组织中药物回收率在71.9%~98.6%之间,色谱图中杂质对于药物响应干扰程度小,满足检测要求。当三氯乙酸的质量体积分数大于1%时将会影响药物与交换柱之间的键合,故本试验采用1%TCA-乙腈溶液作为提取液。
有研究发现[2],C18柱对氟尼辛虽有较强的富集能力,但药物难以洗脱,添加回收率在50%~60%范围内,不能满足检测要求。SCX阳离子交换柱去杂质效果明显,对肌肉和皮脂空白添加的氟尼辛富集效果较好,但对肾脏及肝脏空白添加氟尼辛富集效果不理想。本试验最终选定Plexa PCX作为本检测方法的固相萃取柱。此种萃取柱结合了优秀的表面亲水性,并在聚合物基体的羟基化表面键合了磺酰基,孔内部为疏水特性,经过活化后具有独特的极性梯度表面,从而有效降低离子抑制效应,离子交换机理可以去除样品基质中的中性和酸性干扰物,对碱性分析物萃取浓缩,可以有效提高方法的灵敏度、定量和分析能力。
非甾体类药物残留检测方法中大多采用C18色谱柱及反相高效液相色潽法,以有机溶剂/水溶液体系做流动相[3]。余祖功等[4]建立的血浆中氟尼辛残含量测定高效液相色谱法,杂质峰对药物峰有较大干扰,不适合本研究的药物残留检测。康永峰等[5-7]建立的超声-波微波辅助提取-高效液相色谱法同时检测羊肉组织中4种非甾体抗炎药物残留方法能够将药物峰与杂质峰分开,峰形较好,氟尼辛的响应值(峰面积)比较大。本研究基于上述试验研究结果,经过优化,最终选择甲醇-0.05mol/L磷酸三乙胺(60∶40 v/v,用三乙胺调节pH=3.8)作为流动相,流动相中加入三乙胺能消除色谱柱填料表面硅羟基的作用,改善氟尼辛的峰形,增大了灵敏度,pH=3.8有利于色谱柱对药物的分离作用[8]。
[1]薛伟芳.甲砜霉素在健康及多杀性巴氏杆菌感染鸡的药动学[D];扬州:扬州大学,2008.
[2] 卜仕金.鸡组织中环丙氨嗪残留高效液相色谱检测方法[J].扬州大学学报(农业与生命科学版),2005,4.
[3]张桂君,贺利民,颜丹丹,等.喹烯酮在鸡体内的代谢及药物动力学研究[J].动物医学进展,2011,6(03):33-36.
[4]余祖功,蒋春茂,郭永刚,等.猪静注、肌注氟尼辛葡甲胺的药物动力学研究[J].中国农业科学,2007,09(4):107-110.
[5]谢恺舟,姚宜林,徐东,等.高效液相色谱荧光检测法同时检测鸡蛋中氟苯尼考及其代谢物氟苯尼考胺残留[J].中国兽医杂志,2011,47(3):33-36.
[6]Bowser P R,Kosoff R E,Chen C Y.Florfenicol residues in Nile tilapia after 10-d oral dosing in feed:effect of fish size[J].Journal of Aquatic Animal Health,2009(01):14-17.
[7]Chou K Y,Cheng T Y,Chen CM.Simultaneous determination of residual thiamphenicol and florfenicol in foods of animal origin by HPLC/electrospray ionization-MS/MS[J].Journal of Association of Official Analytical Chemists,2009(4):1225-1232.
[8]谢恺舟,张小杰,陈学森,等.氟苯尼考及其代谢物氟苯尼考胺在鸡肌肉中的残留消除规律[J].畜牧兽医学报,2012,43(8):100-103.
