龙岩市仔猪病毒性腹泻检测与分析
2014-03-11郑新添吴天兴戴爱玲李晓华杨小燕
郑新添,吴天兴,戴爱玲,李晓华,杨小燕
(1.龙岩学院生命科学学院,福建 龙岩364012;2.预防兽医学与生物技术福建省高等学校重点实验室,福建 龙岩364012)
腹泻是危害猪场最严重的疾病之一,尤以仔猪 腹泻发病更为严重。腹泻的病因有多种,其中传染病是一个主要因素,引起仔猪腹泻的传染病中,危害最大的是猪传染性胃肠炎(TGE),猪流行性腹泻(PED)及猪轮状病毒(RV)感染等病毒性腹泻。TGE是由猪传染性胃肠炎病毒(TGEV)引起的一种急性、高度接触性肠道传染病,发病急,传播快,各种年龄的猪都可感染,以引起7~10日龄仔猪呕吐、严重腹泻和高死亡率为特征。PED是由猪流行性腹泻病毒(PEDV)引起的高度接触性胃肠传染病,以水样腹泻、呕吐、脱水和新生仔猪高度死亡为特征。猪轮状病毒是人畜共患腹泻的重要病原之一,也是仔猪腹泻的重要病因。TGE、PED和RV在临床症状、流行病学和病理变化上无明显差异,目前尚无特效治疗药物,给猪场造成了很大损失[1]。近年来,仔猪这3种病毒性感染发病率呈上升趋势,流行病学规律发生较大变化,如病毒的混合感染日趋增多[2]。为了解龙岩市猪场病毒性感染情况,本文在前期建立多重RT-PCR鉴别诊断TGEV、PEDV以及RV感染的基础上[3],对龙岩市近两年仔猪的TGE、PED及RV病毒性腹泻进行检测与分析,为该病的预防、控制提供依据。
1 材料与方法
1.1 材料
1.1.1 样品来源 96份病料采集自2012年1月至2013年9月龙岩学院动物医学研究所接诊的45个猪场的腹泻粪便及小肠、淋巴结等组织。
1.1.2主要试剂与引物 TRIZol、RNA反转录酶、DNA Marker DL-2 000等,购自上海生工生物工程技术服务有限公司,其他试剂均为分析纯。3对扩增引物分别是TGEV(tgev-f 5′-CAACCCTGAAACTAACGCAATTCT-3′,tgev-r 5′GCCCATCCAGTCGCACTAC TT-3′)、PEDV(pedv-f 5′-AGGAACGTGACCTYAAA GACATCCC-3′,pedv-r 5′-CCAGGATAAGCCGGTC TAACATTG-3′),RV(RV-f5′-AAATCCGCAACTAT ACTGTGACTA-3′,RV-r 5′-TGGCCAACTGGTTCTGTCTA-3′)引物扩增长度分别为252 bp,540 bp和410 bp,引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 核酸提取及逆转录 RNA提取采用TRIZol试剂提取法。称取组织0.2 g(粪样预处理:取0.2 g,加入0.8mLPBS振荡混匀,10 000 r/m离心10min,取200μL上清),加入TRIZol Reagent600μL,室温作用5min后加入200μL氯仿,颠倒混匀。4℃,12 000 r/min离心10min,取上清至新的1.5mL离心管中,加等体积异丙醇,颠倒混匀。12 000 r/min(4℃)离心10min,弃上清,1mL 75%乙醇洗涤。12 000 r/min(4℃)离心10min,自然干燥,用20μLDEPC水溶解。逆转录过程为:在1.5mL离心管中加入:MMuLV 5×Buffer 4μL,Rnase Inhibitor(40 U/μL)0.5 μL,M-MuLV Reverse Transcriptase(5 U/μL)1μL,random primer 1μL,dNTPs(2.5mmol/L)1μL,RNA模板5μL,室温下混匀后,42℃水浴1 h,冰浴2min,10 000 r/min离心30 s,即得cDNA,-20℃保存备用。1.2.2 腹泻病毒PCR检测 用本实验室建立的多重RT-PCR法进行TGEV、PEDV和RV的病原检测[3]。以上述步骤1.2.1中合成的cDNA为模板进行PCR扩增。扩增体系为10×PCR Buffer 2.5μL,dNTPs(2.5mmol/L)1μL,TGEV、PEDV和RV等3对引物各1μL,rTaq(5 U/μL)0.5μL,cDNA模板2μL,ddH2O 16.5μL。95℃预变性5min后,进入95℃60 s,51℃和72℃60 s,共循环35次,最后72℃延伸5min。4℃保存PCR产物。PCR结束后,取5μL产物作琼脂糖凝胶电泳分析。
2 结果
2.1 TGEV、PEDV及RV的检出率 对96份腹泻病料进行TGEV、PEDV和RV病原检测,部分检测结果如图1,结果表明(表1),TGEV、PEDV和RV阳性率分别为25.0%(24/96)、22.9%(22/96)和14.6%(14/96);TGEV+PEDV、PEDV+RV及TGEV+RV混合感染阳性率分别为5.2%(5/96),7.3%(7/96)和4.2%(4/96),3者混合感染阳性率为2.1%(2/96)。
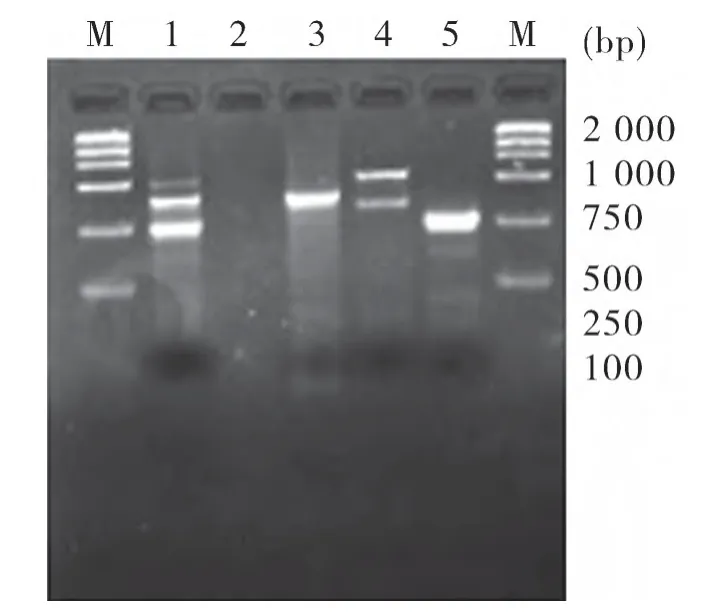
图1 部分样品PCR检测结果

表1 龙岩市TGEV、PEDV及RV感染情况
2.2 TGEV、PEDV及RV感染的月份分布 对所调查的96份样品,按其送检月份分成12-2月、3-5月、6-8月及9-11月,统计各阶段的感染率(表2),结果表明,TGEV在12-2月份阳性率(45.9%)较高,PEDV在3-5月份阳性率高达32.4%,RV不具有明显的季节性,除12-2月份未发现感染外,其他月份的阳性率相近。

表2 不同月份的阳性率分布
2.3 TGEV、PEDV及RV感染猪的年龄分布 对所调查的96份样品,送检猪按年龄分为1-4周龄和5-12周龄两类,统计两个阶段病毒性腹泻的阳性率,结果表明(表3),1-4周龄共71份样品,TGEV、PEDV和RV的阳性率分别为23.9%,22.5%和14.1%;5-12周龄共25份样品,TGEV、PEDV和RV的阳性率分别为28%,24%和16%。
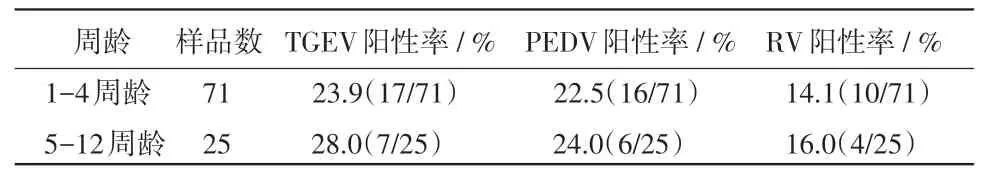
表3 不同周龄的阳性率分布
3 讨论
TGEV、PEDV及RV是仔猪病毒性腹泻的3种主要病原,3者导致的仔猪病毒性腹泻临床上难以区分,RT-PCR技术可对其进行敏感、特异的鉴别。笔者建立的可同时鉴别此3种病毒的多重RT-PCR技术为本次感染率调查的准确性提供了保证[3]。仔猪的此3种病毒性在不同地区的感染率不同,近两年国内报道的PEDV感染率较高[4-5],阳性率甚至高达87.9%[6],此次调查表明,我市的PED感染率相对较低,但阳性场比例仍然较高。96份粪便检测结果表明,TGEV、PEDV及RV阳性率分别为25.0%、22.9%和14.6%,因此笔者认为2012-2013年9月龙岩市以猪流行性腹泻和猪传染性胃肠炎为主,而轮状病毒感染率较低。此3种病毒间常呈单独感染或混合感染,近年来混合感染在我国猪场呈上升趋势[7-8]。此次检测表明,本市猪场TGEV和PEDV混合感染、PEDV和RV混合感染、TGEV和RV混合感染阳性率分别为5.2%(5/95)、7.3%(7/96)和4.2%(4/96),3者混合感染率为2.1%(2/96),其混合感染率与其他报道相近[8]。TGE,PED和RV等仔猪病毒性腹泻多发生于冬春和晚秋季节,近年来,在很多地区和规模化猪场,夏秋季也有猪病毒性腹泻的流行[9]。本文通过对小猪感染月份的统计和分析表明,龙岩市TGEV在12-2月份阳性率高达50%,PEDV在3-5月份阳性率高达32.4%。PEDV在我国以12月至次年2月为高发季节[10],而此次检测表明,PEDV的季节性有不明显趋势,这与国内对两种疾病的流行报道相近[11]。仔猪腹泻性疾病主要发生在出生后10日龄以内的哺乳仔猪,日龄较大的哺乳仔猪的发病率和病死率相对较低。本文研究表明,日龄较大的5-12周龄仔猪感染率有上升趋势。病毒性腹泻尚无有效治疗药物,疫苗免疫接种是预防猪病毒性腹泻的主要手段,应在制定免疫程序时加强母猪免疫,同时加强猪场中小猪阶段的保温和卫生管理,定期消毒。
[1] 陈少华,谢三星.猪三大病毒性腹泻区别诊断问题[J].中国动物检疫,1995,12(3):22-23.
[2]田冲,欧阳金旭,罗碧毅,等.仔猪病毒性腹泻的流行病学研究进展[J].长江大学学报(自科版)农学卷,2013,10(2):57-60,63.
[3]郑新添,杨小燕,戴爱玲,等.猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪轮状病毒三重PCR检测方法的建立[J].2011,29(5):55-58.
[4]刘云波,赵洪翠,王志成,等.猪病毒性腹泻分子流行病学调查[J].中国畜牧兽医,2013,40(2):204-207.
[5]黄毓茂.当前猪病毒性腹泻流行特点与防控建议[J].中国猪业,2012,9(11):21-22.
[6]吴学敏,陈如敬,王隆柏,等.猪流行性腹泻病毒RT-PCR检测方法建立及初步应用研究[J].中国农学通报,2012,28(26):59-62.
[7]于晓龙.猪流行性腹泻病毒和猪传染性胃肠炎病毒混合感染的调查[J].安徽农学通报,2007,13(14):156-157.
[8]秦谷雨,杨勇,李郁,等.安徽省仔猪腹泻5种病毒感染情况的调查研究[J].动物医学进展,2012,33(12):59-63.
[9]陈健雄.仔猪常见病毒性腹泻的流行特点和控制措施-警惕导致哺乳仔猪死亡严重的病毒性腹泻病[J].猪业科学,2011,28(10):94-98.
[10]甘振磊,汤德元,李春燕,等.猪流行性腹泻流行特点及流行现状的研究[J].猪业科学,2010,27(12):24-28.
[11]王先明.近期猪群病毒性腹泻的发病情况及防控措施调查[J].浙江畜牧兽医,2012,37(4):22-23.
