治疗类风湿关节炎骨破坏的生物制剂研究进展
2014-03-11王敏智何小鹃徐慧慧
罗 丹,王敏智,何小鹃,徐慧慧,肖 诚
(1.中日友好医院 临床医学研究所,北京 100029;2.北京中医药大学,北京 100029;3.中国中医科学院 中医临床基础医学研究所,北京 100700)
类风湿关节炎(rheumatoid arthritis,RA)是一种病因复杂的自身免疫炎性疾病,以慢性、对称性、多滑膜关节炎和关节外病变为主要表现,骨破坏可发生在疾病活动的早期,并逐步进展,是导致RA中晚期患者劳动能力丧失的主要原因之一,因此预防和阻断RA骨破坏也成为了治疗目标。随着研究深入,许多与RA骨破坏相关的细胞因子、信号通路及细胞被发现。针对于此,最近用于治疗RA骨破坏的相关生物制剂研究也在不断被推进,许多有价值的实验研究结果被报道,故本文试图在RA骨破坏机制基础上探讨生物制剂实验研究方面的最新进展。
1 RA骨破坏机制
骨破坏或骨侵蚀虽可经影像直接判定,但其发生机制却非常复杂。在骨组织中,维持骨内环境稳定细胞主要有成骨细胞、破骨细胞和骨细胞[1],破骨细胞是一种多核的骨吸收细胞,它起源于巨噬细胞/单核细胞系的前体细胞;成骨细胞起源于骨髓和骨膜内的前体细胞,分泌重要的细胞外基质成分——类骨质,尤其是胶原,并最终分化为骨细胞。在炎性因子、细胞因子和信号通路的调控下,骨形成与骨吸收失衡,使得后者占主导,进而引发RA骨破坏。
对于RA骨破坏的触发因素,有证据表明可能是抗瓜氨 酸蛋 白质抗 体 (anti citrullinated protein antibody,ACPA),在RA早期即可检测到,并长期存在[2]。而ACPA可结合到破骨细胞前体细胞表面,经肿瘤坏死因子(tumor necrosis factor,TNF)刺激,能够促使破骨细胞成熟分化(图1)[3]。随着病情进展,滑膜细胞增生和炎性细胞大量浸润,包括单核细胞和活化的白细胞,会在关节软骨和骨表面形成“血管翳”,不断分泌大量的炎性因子、组织蛋白酶等,除直接导致软骨、骨基质的破坏及影响骨形成外[4,5],也会诱导单核细胞分化为破骨细胞、促使破骨细胞增生与活化并抑制破骨细胞的凋亡[4]。
在RA骨破坏信号调控通路方面,核因子-κB(NFκB) 受 体 (receptor activator of nuclear factor kappaB,RANK)及其配体(receptor activator of nuclear factor kappaB ligand,RANKL)通路占主导,当RANKL与破骨细胞表达的同源RANK结合时,破骨细胞即被激活[5]。而一些骨吸收因子如TNF-α、白细胞介素-1(interleukin-1,IL-1)、IL-6、IL-17等又会上调RANKL的表达,增强破骨作用[4]。
在抗骨破坏方面,骨保护素(osteoprotegerin,OPG)作为RANKL可溶性诱导受体,可通过阻断RANK/RANKL交互作用,抑制RANKL的促破骨细胞形成作用[5],但在RA中其水平会相对下调,再加上DDK-1等对骨形成Wnt信号通路的阻断会抑制骨侵蚀部位成骨细胞功能[6],这些会导致骨形成在RA中被弱化。
2 生物制剂治疗RA骨破坏
目前,相对于传统的抗风湿药物,生物制剂能显著缓解RA的疾病活动和影像学进展,因而越来越受到关注,其在RA骨破坏中的研究也走在了前沿。随着RA骨破坏机制深入研究,许多小分子、细胞等被发现,相关生物制剂实验研究报道也渐增多。
2.1 趋化因子抑制剂及抗体
趋化因子是许多细胞表达的一种促炎细胞因子,能够调节免疫细胞的迁移分布,参与RA病理过程。其中,趋化因子MCP-1/CCL2可在RA关节内呈现高表达,能够促使白细胞迁移到滑膜组织,研究用内生MCP-1的新型抑制剂P8A-MCP-1对佐剂诱导性关节炎大鼠关节破坏和骨侵蚀有病理学上改善,关节炎症、单核细胞迁移、促炎因子、骨标记物和p-p38水平也随之下降[7]。TH-17细胞产生的IL-17,对RA疾病活动有调控作用,其所诱导的关节炎与血管形成增加密切相关,而血管形成又能促使白细胞浸润和血管翳生成,导致关节炎症和骨破坏永久存在。在其诱导的小鼠关节炎模型中,Pickens等[8]研究发现抗趋化因子CXCL5抗体单用或与抗CXCL1抗体联用,在病理学上能显著减轻骨侵蚀,这可能与下调TNF-α,减少内皮趋化性和NF-κB调节的血管形成有关,也进一步表明炎症反应参与到RA的骨破坏进程中。
2.2 TNF-α抑制剂
TNF是RA疾病进展的重要分子,能够诱导其它炎症因子的产生和破骨细胞的分化成熟等,目前已经有许多针对TNF的生物制剂上市。最近有研究报道,一类能在生物系统内释放少量CO的新药物一氧化碳释放分子(CO-releasing molecules,CORMs)中CORM-3能缓解在胶原诱导性关节炎(collagen induced arthritis,CIA)模型基础上行卵巢切除小鼠的软骨降解,可能的机制在于其对TNF-α抑制,Micro-CT显示其对骨小梁有保护,结果也暗示CORMs抗炎效果在于通过阻止关节骨侵蚀而对绝经后RA系统性骨质流失起到部分保护作用[9]。Jin等[10]用重组可溶性人TNF相关凋亡诱导配体发现在CIA小鼠中能以剂量依赖的方式明显减轻软骨破坏和骨侵蚀,并使促炎因子和抗胶原特异性抗体的血清水平下降或正常化,体外实验也表明其有明显的淋巴细胞毒作用和炎性因子释放减少作用。TNF-α能够诱导滑膜细胞、软骨细胞等间充质干细胞分泌基质金属蛋白酶(MMPs)并抑制金属蛋白酶组织抑制剂功能,从而导致软骨破坏[11]。在TNF-α抑制剂依那西普(etanercept)和来自人脐带的间充质干细胞联合治疗研究中,CIA小鼠的病理学改变能够得到明显缓解,对TNF-α的阻断,不仅可以抑制间充质干细胞免疫原性,下调CD90、人类白细胞抗原-G和IL-10水平,也增强了其迁移到软骨发挥一定骨修复的作用,这与减少了MMP-3的表达,促使人Ⅱ型胶原阳性细胞生成等直接相关[12]。后又有Tanida A等[13]在大鼠CIA模型基础上发现依那西普能抑制DDK-1表达,使Wnt表达增强,成骨细胞形成变得更加活跃且不依赖于破骨活动的调节,借助组织形态学分析表明骨的破坏减少,而且存在明显的骨形成。
2.3 蛋白酶抑制剂
MMPs直接参与到骨的侵蚀破坏过程,故报道[14]用针对MMP-7的反义寡核苷酸能减少K/BxN血清转移关节炎小鼠的骨侵蚀和软骨破骨,踝关节c-Jun氨基末端激酶磷酸化和c-Jun磷酸化程度下降,IL-1β、MMP-3和MMP-13基因表达水平下调可能是其作用机制所在。L-006235为组织蛋白酶K抑制剂,Svelander等[15]发现预先给药能减轻CIA小鼠关节的病理学改变,与其对骨破坏相关通路因子水平的调控有关。
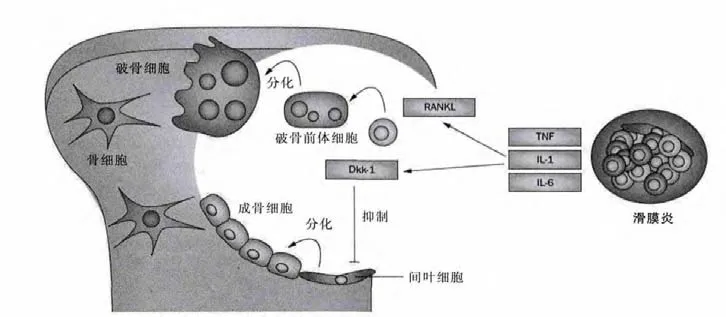
图1 [3]在RA滑膜炎的刺激下,炎症因子TNF、IL-L、IL-6等的释放以及对成骨细胞和破骨细胞分化成熟的干扰等,打破了骨的代谢平衡,使更倾向于骨的破坏。
2.4 粘附分子抑制剂及抗体
血小板/内皮细胞粘附分子1(platelet/endothelial cell adhesion molecule 1,PECAM)是白细胞和内皮细胞表达的分子,在白细胞黏附迁移中起着重要作用,用PECAM-Fc嵌合体治疗CIA能消除软骨和骨的破坏[16]。针对CD81的小干扰RNA也能缓解CIA大鼠骨侵蚀和关节软骨降解等病理学和放射学改变[17]。GU-4为白细胞整合素CD11b的抑制剂,X线和病理片显示其能轻微减轻CIA大鼠的骨侵蚀[18]。Oflazoglu等[19]又报道在CIA小鼠中,经抗小鼠CD70抗体治疗后,能从病理学上减轻小鼠关节骨与软骨的破坏,除阻断了CD70与其受体CD27的结合,也参与到抗体依赖的细胞细胞毒作用、吞噬作用等Fc依赖效应功能,调节体内的炎症反应来达到治疗目的。
2.5 其它
脂联素是全身脂肪细胞分泌的脂肪因子,已有研究发现其在RA患者关节滑液水平显著升高,并参与到RA炎症反应[20],报道[21]发现腺病毒介导的基因转移的脂联素减少CIA小鼠软骨破坏和骨侵蚀,同时体内促炎因子mRNA水平下降以及补体C1q和C3在关节沉积减少。IL-1也是RA病理过程的关键分子,Qi等[22]用人源化IL-1β抗体治疗CIA小鼠后,能够明显减轻关节的骨和软骨破坏,并伴随IL-1β、IL-6、TNF-α等在炎症组织中的水平下调。硬骨素,一种骨细胞特异蛋白,能够抑制骨的形成,在TNF-α转基因小鼠关节炎模型中发现[23],硬骨素单克隆抗体虽不能影响关节肿胀和滑膜炎症,但Micro-CT、病理等显示却可抑制模型鼠的骨和软骨侵蚀,阻止骨质流失,甚至出现部分逆转效应,起到一定的骨修复作用。在K/BxN血清转移小鼠模型中,使用磷脂酸受体抑制剂治疗后,病理学显示小鼠的软骨破坏得到显著缓解,尤其是骨的侵蚀,可能与其抑制破骨细胞的分化和骨吸收有关[24]。针对血管内皮生长因子-A(VEGF-A)和血管生成素的双重抗血管生成蛋白能从影像学和病理学上缓解骨破坏,可能与下调MMP-3、IL-1β和RANKL水平相关联[25]。Min等[26]报道直接关节腔内注射NF-κB抑制剂,也能从形态学上缓解CIA小鼠的骨破坏,其机制可能与IL-17、IFN-γ血清水平下调等对免疫系统的调节相关。
2.6 以细胞为靶标的研究
除了小分子,对细胞功能的调节,尤其对免疫细胞数量和功能的调节也是抑制RA病理进展的关键。有研究报道[27],一种细胞渗透的重组蛋白Hph-1-ctCTLA-4能从放射学和病理学上明显减轻CIA小鼠的软骨侵蚀,抑制T细胞受体特异性活化信号和炎症因子产生可能是其效应机制所在。由活化的中性粒细胞产生的牛磺酸氯胺能明显缓解CIA小鼠软骨破坏和骨侵蚀,减少酒石酸磷酸盐染色的阳性细胞数,其机制可能在于对淋巴细胞增殖和破骨细胞形成的抑制[28]。
3 展望
骨和软骨的破坏是RA患者致残的主要原因之一,给患者带来极大的痛苦和沉重的经济负担。促炎因子、RANK/RANKL等的上调和OPG等的下调,破骨细胞的过度活化,骨内微环境失稳等,都会引发RA患者关节骨破坏。先天免疫机制、自身免疫和滑膜炎至始至终参与了这个动态发展的过程[3]。关节的炎症弱化了成骨细胞形成矿化骨的能力,影响到RA患者的骨密度和局部骨侵蚀的修复[29],因此RA的骨破坏离不开炎症,有些生物制剂就是通过局部或系统的抗炎作用而发挥间接的抗骨破坏效果,但是关节炎症程度并不等同于关节骨破坏程度[30],研究[31]显示,RA临床症状的控制并不与放射学进展减缓有关,因此对RA的治疗除了考虑缓解其临床症状、实验指标等,对其骨破坏的检测以及早期诊断治疗也是必不可少的。
如上文所述,评估骨破坏病理观察、X线等客观指标需要被实施。有报道甚至采用了Micro-CT,已是一种相对成熟的技术,已经用于对小动物解剖学改变的分析,可以定量CIA模型小鼠骨变化,能从骨内三维结构上对骨质和骨强度进行评估,分析骨小梁结构,能作为疾病指数评估,更能说明药物的抗骨破坏效应[32,33]。
针对RA骨破坏机制,尤其是破坏通路,无论从基因水平,还是从分子、细胞水平,相关生物制剂研究均有报道,虽大多处于初步研究阶段,更为明确的作用机制还需进一步深入研究,走向临床应用还有很长一段路,但其靶向性强,在抗RA骨破坏方面会有不错的应用前景。进行联合用药[12]也是对已有抗RA生物制剂更全面的研究,探求缓解RA骨破坏的效应,使药物作用发挥到最大。
综上所述,对于RA骨破坏的生物制剂研究,多是预防或缓解骨破坏,能够起到骨修复甚则完全阻断骨破坏的生物制剂研究虽有报道,但依然很少,尤其从促进骨形成通路上进行生物制剂研究,故RA骨破坏机制和相关生物制剂的研究还有待进一步深入。
[1] Cao X.Targeting osteoclast-osteoblast communication[J].Nat Med,2011,17:1344-1346.
[2] Meyer O,Labarre C,Dougados M,et al.Anticitrullinated protein/peptide antibody assays in early rheumatoid arthritis for predicting five year radiographic damage[J].Ann Rheum Dis,2003,62:120-126.
[3] Schett G,Gravallese E.Bone erosion in rheumatoid arthritis:mechanisms,diagnosis and treatment[J].Nat Rev Rheumatol,2012,8:656-664.
[4] Bezerra MC,Carvalho JF,Prokopowitsch AS,et al.RANK,RANKL and osteoprotegerin in arthritic bone loss[J].Braz J Med Biol Res,2005,38:161-170.
[5] Karmakar S,Kay J,Gravallese EM.Bone damage in rheumatoid arthritis:mechanistic insights and approaches to prevention[J].Rheum Dis Clin North Am,2010,36:385-404.
[6] Walsh NC,Gravallese EM.Bone remodeling in rheumatic disease:a question of balance[J].Immunol Rev,2010,233:301-312.
[7] Shahrara S,Proudfoot AE,Park CC,et al.Inhibition of monocyte chemoattractant protein-1 ameliorates rat adjuvant-induced arthritis[J].J Immunol,2008,180:3447-3456.
[8] Pickens SR,Chamberlain ND,Volin MV,et al.Anti-CXCL5 therapy ameliorates IL-17-induced arthritis by decreasing joint vascularization[J].Angiogenesis,2011,14:443-455.
[9] Ibanez L,Alcaraz MJ,Maicas N,et al.Downregulation of the inflammatory response by CORM-3 results in protective effects in a model of postmenopausal arthritis[J].Calcif Tissue Int,2012,91:69-80.
[10] Jin CH,Chae SY,Kim TH,et al.Effect of tumor necrosis factor-related apoptosis-inducing ligand on the reduction of joint inflammation in experimental rheumatoid arthritis[J].J Pharmacol Exp Ther,2010,332:858-865.
[11] Song C,Luo L,Lei Z,et al.IL-17-producing alveolar macrophages mediate allergic lung inflammation related to asthma[J].J Immunol,2008,181:6117-6124.
[12] Wu CC,Wu TC,Liu FL,et al.TNF-alpha inhibitor reverse the effects of human umbilical cord-derived stem cells on experimental arthritis by increasing immunosuppression[J].Cell Immunol,2012,273:30-40.
[13] Tanida A,Kishimoto Y,Okano T,et al.Etanercept promotes bone rormation via suppression of dickkopf-1 expression in rats with collagen-Induced arthritis[J].Yonago Acta Med,2013,56:13-19.
[14] Lee SI,Boyle DL,Berdeja A,et al.Regulation of inflammatory arthritis by the upstream kinase mitogen activated protein kinase kinase 7 in the c-Jun N-terminal kinase pathway[J].Arthritis Res Ther,2012,14:R38.
[15] Svelander L,Erlandsson-Harris H,Astner L,et al.Inhibition of cathepsin K reduces bone erosion,cartilage degradation and inflammation evoked by collagen-induced arthritis in mice[J].Eur J Pharmacol,2009,613:155-162.
[16] Dasgupta B,Chew T,deRoche A,et al.Blocking platelet/endothelial cell adhesion molecule 1(PECAM)inhibits disease progression and prevents joint erosion in established collagen antibody-induced arthritis[J].Exp Mol Pathol,2010,88:210-215.
[17] Nakagawa S,Arai Y,Mori H,et al.Small interfering RNA targeting CD81 ameliorated arthritis in rats[J].Biochem Biophys Res Commun,2009,388:467-472.
[18] Fan J,Zhou H,Wang S,et al.Therapeutic effects of lactosyl derivative Gu-4 in a collagen-induced arthritis rat model[J].Glycoconj J,2012,29:305-313.
[19] Oflazoglu E,Boursalian TE,Zeng W,et al.Blocking of CD27-CD70 pathway by anti-CD70 antibody ameliorates joint disease in murine collagen-induced arthritis[J].J Immunol,2009,183:3770-3777.
[20] Presle N,Pottie P,Dumond H,et al.Differential distribution of adipokines between serum and synovial fluid in patients with osteoarthritis.Contribution of joint tissues to their articular production[J].Osteoarthritis Cartilage,2006,14:690-695.
[21] Ebina K,Oshima K,Matsuda M,et al.Adenovirus-mediated gene transfer of adiponectin reduces the severity of collagen-induced arthritis in mice[J].Biochem Biophys Res Commun,2009,378:186-191.
[22] Qi J,Ye X,Ren G,et al.Pharmacological efficacy of anti-IL-1beta scFv,Fab and full-length antibodies in treatment of rheumatoid arthritis[J].Mol Immunol,2014,57:59-65.
[23] Chen XX,Baum W,Dwyer D,et al.Sclerostin inhibition reverses systemic,periarticular and local bone loss in arthritis[J].Ann Rheum Dis,2013,72:1732-1736.
[24] Orosa B,García S,Martínez P,et al.Lysophosphatidic acid receptor inhibition as a new multipronged treatment for rheumatoid arthritis[J].Ann Rheum Dis,2014,73:298-305.
[25] Hah YS,Koh YJ,Lim HS,et al.Double-antiangiogenic protein DAAP targeting vascular endothelial growth factor A and angiopoietins attenuates collagen-induced arthritis[J].Arthritis Res Ther,2013,15:R85.
[26] Min SY,Yan M,Du Y,et al.Intra-articular nuclear factorkappaB blockade ameliorates collagen-induced arthritis in mice by eliciting regulatory T cells and macrophages[J].Clin Exp Immunol,2013,172:217-227.
[27] Choi JM,Kim SH,Shin JH,et al.Transduction of the cytoplasmic domain of CTLA-4 inhibits TcR-specific activation signals and prevents collagen-induced arthritis[J].Proc Natl Acad Sci USA,2008,105:19875-19880.
[28] Wang Y,Cha YN,Kim KS,et al.Taurine chloramine inhibits osteoclastogenesis and splenic lymphocyte proliferation in mice with collagen-induced arthritis[J].Eur J Pharmacol,2011,668:325-330.
[29] Walsh NC,Reinwald S,Manning CA,et al.Osteoblast function is compromised at sites of focal bone erosion in inflammatory arthritis[J].J Bone Miner Res,2009,24:1572-1585.
[30] Goldring SR.Bone and joint destruction in rheumatoid arthritis:what is really happening?[J].J Rheumatol Suppl,2002,65:44-48.
[31] Paget SA.Efficacy of anakinra in bone:comparison to other biologics[J].Adv Ther,2002,19:27-39.
[32] Le Goff B,Soltner E,Charrier C,et al.A combination of methotrexate and zoledronic acid prevents bone erosions and systemic bone mass loss in collagen induced arthritis[J].Arthritis Res Ther,2009,11:R185.
[33] Yang S,Hollister AM,Orchard EA,et al.Quantification of bone changes in a collagen-induced arthritis mouse model by reconstructed three dimensional micro-CT[J].Biol Proced Online,2013,15:8.
