大黄酸金属配合物的结构及对人肝癌HepG2细胞增殖的抑制作用
2014-03-11向晖潘晓丽熊永爱张仕瑾谭玉柱董小萍
向晖,潘晓丽,熊永爱,张仕瑾,谭玉柱,董小萍
·药理毒理·
大黄酸金属配合物的结构及对人肝癌HepG2细胞增殖的抑制作用
向晖,潘晓丽,熊永爱,张仕瑾,谭玉柱,董小萍
目的:以大黄酸和相应金属盐为原料,合成3种金属配合物,并对其结构进行表征,比较其抗癌活性大小。方法:采用核磁共振氢谱法、红外光谱法、紫外光谱法、滴定法、原子吸收光谱法进行结构表征;采用MTT法测试三种配合物对于人肝癌HepG2细胞的抑制作用。结果:通过光谱法证实有配合物生成,并推测出其可能结构。MTT测试显示配合物和配体均具有一定的抗癌活性,其中大黄酸-Fe(Ⅲ)抗癌活性最强,其IC50值达17.44 μg.mL-1,优于配体大黄酸(IC50= 116.741 μg.mL-1),大黄酸-Cu(Ⅱ)(IC50=54.427 μg.mL-1),大黄酸-Cr(Ⅲ)(IC50=63.584 μg.mL-1)。结论:大黄酸金属配合物抗癌活性相比配体增强。
大黄酸;金属配合物;HepG2细胞;抗癌
肝癌是临床上常见的恶性肿瘤,其发生发展较为隐匿,往往到了中晚期患者才能察觉[1],该病死亡率高,患者痛苦大。而目前许多药物抗癌活性并不理想,且部分药物副作用大,针对性不强,故寻找新型抗癌药物具有十分重要的意义。大黄酸来源于中药大黄、虎杖等,属于单蒽核类1,8—二羟基蒽醌衍生物[2]。大黄酸具有抗癌活性[3]。而作为金属配合物的顺铂是临床上一种重要的抗癌药物,它作为联合化疗的基础在多种疾病中表现出了极为优秀的抗肿瘤效果[4]。大黄酸(见图1)的1,8位羟基和9位羰基适于与金属离子配位。许多文献报道配合物的生物活性优于配体,如木犀草素形成锌配合物后其对抗DPPH自由基的能力增强[5],再如大黄素形成铜(Ⅱ)配合物后,其抑菌活性有一定程度提高[6]。大黄酸金属配合物的抗癌活性鲜有报道。MTT法灵敏度高,操作简便,被广泛用于抗肿瘤药物的筛选[7],本实验选择3种人体必需的微量的金属元素铁、铜、铬,与大黄酸形成配合物,采用红外光谱法、紫外光谱法、核磁共振氢谱法进行结构表征。采用MTT法进行活性筛选,找出其中抗癌活性相对优秀的配合物,以期对进一步研究和开发提供实验基础和依据。
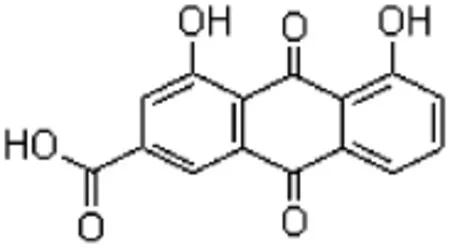
图1 大黄酸的化学结构
1 材料与方法
1.1 试剂
大黄酸(成都康邦生物生物科技有限公司,纯度大于98%,批号20121101);DMEM培养基(Hyclone,批号NYF0887);青链霉素混合液(北京索莱宝生物科技,批号20121009);胰蛋白酶(北京索莱宝生物科技,批号20130626);胎牛血清(北京平睿生物科技,批号20130129);MTT(sigma,M2128);PBS缓冲盐(北京索莱宝科技,批号P1022);顺铂(山东齐鲁制药,批号0040112DB),其余试剂均为国产分析纯。
1.2 细胞
人肝癌HepG2细胞由成都中医药大学基础医学院提供。
1.3 仪器设备
红外光谱采用BRUKER Tensor-27型傅立叶变换中红外光谱仪测定;UV-1700型紫外分光光度计;核磁共振氢谱采用BRUKER AM-400型超导核磁共振仪(DMSO-d6作溶剂测定);原子吸收光谱法采用contrAA 300原子吸收光谱仪,PHB-8型pH计;二氧化碳培养箱(MCO-15AC,三洋电机株式会社);双人单面垂直送风净化工作台(SW-SJ-2D,中国苏州智净净化设备有限公司);优普超纯水制造系统(UPH-Ⅱ-10T,成都超纯科技有限公司);BP211D型电子分析天平(十万分之一,德国Sartorius公司)。
2 方法
2.1 大黄酸金属配合物的合成
称取0.5 mmol 大黄酸,以40 mL无水乙醇溶解,加入0.25 mmol 相应金属盐(Cr(NO3)3•6H2O,Fe•6H2O,CuCI2•6H2O)的10 mL 无水乙醇溶液,逐滴加入氨水的乙醇溶液(1∶1, V∶V),调节配体溶液的pH 值为8~9, 溶液有紫红色沉淀生成,以38℃搅拌反应12 h, 将溶液静置后离心取沉淀,依次用无水乙醇,乙醚分别将沉淀洗涤数次后,在40℃下真空干燥72 h, 得粉末状固体产物。
2.2 配合物中金属元素含量测定
2.2.1 碘量法(Cu、Fe(Ⅲ)元素含量测定)
(1)滴定液的配制 取硫代硫酸钠26 g,与无水碳酸钠0.2 g,加入煮沸后的冷水溶解并稀释到1000 mL,摇匀,放置1个月后过滤。
(2)滴定液的标定 参照中国药典2010版第二部附录XV项下滴定液的配制和标定。取120℃下干燥至恒重的基准重铬酸钾0.15 g,加水50 mL 使之溶解,加碘化钾2 g,溶解后加稀硫酸40 mL摇匀,密闭。在暗处放置10 min后加水250 mL稀释。以滴定液滴定至终点时,加淀粉指示液3 mL,至蓝色消失而显示绿色,并作空白矫正。将所得滴定液稀释十倍即得0.01 mol.L-1的硫代硫酸钠。
(3)配合物的滴定 称取配合物60 mg,在700°C马弗炉中灼烧至恒重得金属氧化物粉末,以稀硫酸溶解,加水50 mL,加碘化钾2 g,摇匀,密闭。用标定好的硫代硫酸钠溶液滴定,接近终点时滴加淀粉指示剂显兰色,再滴加至兰色消失,记下体积数。同时做空白实验。
以上实验平行测定三次
2.2.2 原子吸收光谱法(Cr(Ⅲ)元素含量测定) 以12 mL HNO3(65%),3 mLHCIO4将配合物溶解,放置24 h后,加热使酸挥发至2 mL,以水稀释至25 mL, 取稀释后的溶液进行测定,以菠菜标准品里金属元素铬含量为对照,评价方法的准确性。
2.3 细胞系和培养条件
细胞培养在含10%胎牛血清的高糖DMEM培养基中,37℃,5%CO2,湿度饱和的条件下培养,每隔三天传代一次。实验所用细胞处于对数生长期。
2.4 药物配制
将大黄酸、大黄酸配合物、阳性对照药物顺铂分别用含血清的高糖DMEM培养基稀释,使其最终浓度均达到100、50、25、12.5 μg.mL-1。以0.22 μm无菌微孔滤膜过滤除菌,备用。
2.5 抑制肿瘤实验
将HepG2细胞用0.25%胰蛋白酶消化,以含胎牛血清的培养基将细胞配制成浓度为5×104/mL的混悬液,每孔160 μg接种于96孔板,在孵箱内培养24 h后,弃去培养基,每孔加入上述配置好的含药培养基160 μL,每个剂量设置4个复孔。同时做空白实验。细胞在含药培养基中培养48 h后,吸去培养基,加入无血清高糖培养基160 μL以及MTT20 μL(5 mg.mL-1),继续在37℃,5%CO2条件下培养4 h后,弃去上清液,每孔加入160 μL DMSO,在全自动酶标仪570 nm测定各孔吸光值。计算抑制率,将配合物对细胞抑制率与配体对细胞的抑制率做比较。
细胞抑制率计算公式:抑制率=1-加药组A值/对照组A值×100%
2.6 统计学方法
3 结果
3.1 配合物外观及一般性质
配合物外观与配体相比较发生了明显变化。铁和铬的配合物均呈现较深的紫红色,铜配合物呈现深黄色,且质地变硬,熔点明显增高。将配合物在700℃高温下灼烧至恒重可以得到金属氧化物粉末。配合物难溶于水、氯仿、乙醚、丙酮,石油醚等试剂,但较易溶解在DMSO(二甲基亚砜)、DMF(二甲基甲酰胺)等碱性试剂中。
3.2 紫外光谱
将大黄酸和大黄酸配合物配制成0.5×10-4mol.L-1的甲醇溶液,在200~600 nm范围内进行紫外全波长扫描,结果见表1。由数据可见,大黄酸配合物峰形与大黄酸基本一致,说明保留了其中的蒽醌基本结构。大黄酸在229、257、431处出现3个比较强的吸收带,分别由苯样结构、醌样结构以及蒽醌中的羰基引起,配合物仍然具有三个基本吸收峰,但大黄酸配合物吸收峰发生红移且强度增加。配合物在500 nm以上处出现一新的弱吸收峰,可能原因是羰基与与金属离子配位,分子内电子离域程度增加造成的。
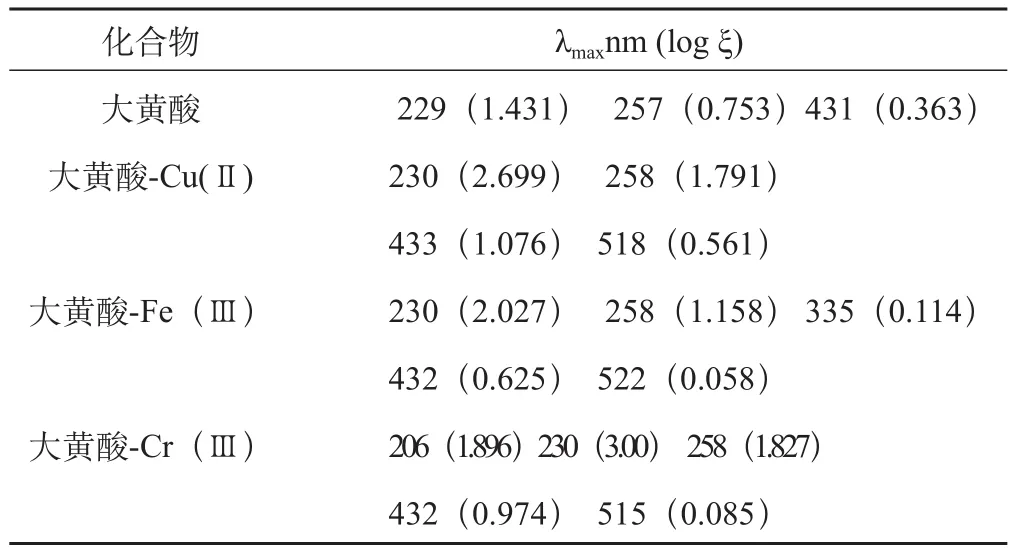
表1 大黄酸及其配合物的UV图谱数据
3.3 红外光谱
红外光谱数据见表2。与配体大黄酸相比较,配合物均在3425左右处有一宽峰,表明存在结晶水。配体大黄酸在3060处有一分子内氢键的吸收峰,而配合物中此吸收减弱或消失,表明配位后分子内氢键被破坏。羰基吸收峰发生了小幅度红移,并且吸收强度减弱,说明羰基参与配位。配体和配合物酚羟基中碳氧键都存在强吸收,但配合物的吸收峰显著弱于配体,说明酚羟基参与配位。同时配合物在511处出现了M-O伸缩振动。

表2 配体和配合物红外光谱IR(cm-1)数据
3.4 核磁共振氢谱
核磁共振氢谱以二甲基亚砜为溶剂,结果显示配合物和大黄酸相比,其核磁共振氢谱发生了明显变化,其中大黄酸δ:13.73(s,1H),11.89(s,2H),8.12 (d,J=4.0Hz,1H),7.84(t,J=8.0Hz,1H),7.75(d,J=1.2Hz,1H ),7.73(d,J=4.0Hz,1H),7.41(d,J=8.0Hz,1H);大黄酸-铜(Ⅱ)δ:8.09(s,1H),7.28~7.48(m,5H),7.70~7.83(m,4H),10.5~13.3(m,4H);大黄酸-铬(Ⅲ) δ:8.3~9.7(m,4H),6.8~8.3(m,10H);由于溶解性或其他原因,未得到清晰的大黄酸-铁(Ⅲ) 氢谱。从已测得的氢谱上看,配合物中氢个数加倍,多出现重峰。羰基两旁的羟基上均有孤对电子,均有通过羰基和金属离子形成配合物的可能。但羧基具有吸电子诱导效应,所以离羧基较近的羟基上的氢更活泼,故1位羟基失去一个质子,通过羰基和金属离子形成配合物。
3.5 金属元素含量测试结果
含量测试结果现实,基本符合两分子配体与一个金属离子配位的推测。
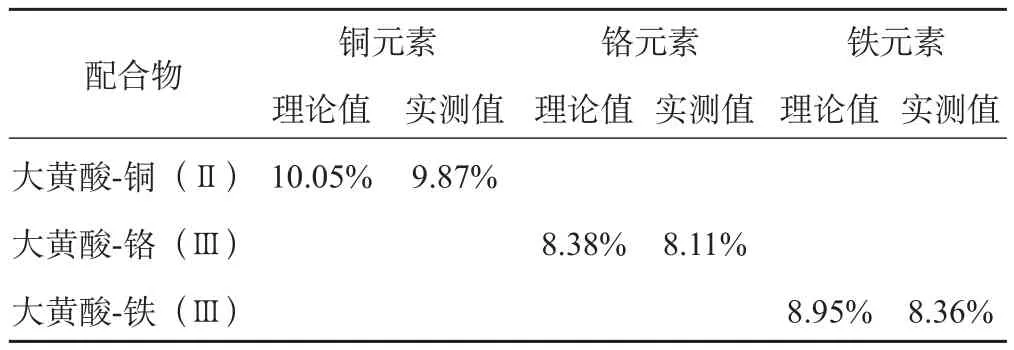
表3 金属元素含量测定结果
由结构表征分析,分析大黄酸金属配合物可能结构式为:两分子大黄酸和一分子金属离子通过大黄酸的1位羟基和9位羰基形成金属配合物。

图2 大黄酸金属配合物可能结构
3.6 配合物抗癌活性测试结果
顺铂是对HepG2具有抑制作用[8],作为本实验阳性对照。配合物、配体以及阳性对照药物在12.5~100 μg.L-1的浓度范围内均对癌细胞产生一定抑制作用,且随着药物浓度增加抑制率增加。方差分析显示,用药组与空白组相比P<0.05,表明差异显著。但不同金属离子的配合物对癌细胞作用强度存在差异。根据吸光值按照上述公式计算抑制率,见表1,再以spss软件计算IC50值。配体和配合物IC50值依次为大黄酸(116.741);大黄酸-Cu(Ⅱ)(54.427);大黄酸-Cr(Ⅲ)(63.584);大黄酸-Fe(Ⅲ)(17.44);;由IC50值可知,大黄酸-Fe(Ⅲ)具有较强的抗癌活性,但低于顺铂。且金属配合物抗癌活性基本高于配体大黄酸。金属配合物、配体抗癌活性大小顺序为:
大黄酸-Fe(Ⅲ)>大黄酸-Cu(Ⅱ)≈大黄酸-Cr>大黄酸

表4 大黄酸金属配合物对人肝癌HepG2细胞作用48 h增殖的影响
4 结论
肝癌是一种十分常见的恶性肿瘤,严重危害人类健康。大黄酸本身具有抗癌作用,文献报道其可以通过抑制肿瘤细胞DNA的合成和核苷转运从而诱导其凋亡[9]。虽然顺铂显示出较强的抗癌活性,但它具有肾毒性,耳毒性,以及神经毒性使其临床应用受到限制[10]。天然成分的优势就在于毒副作用相对较小。中药配位学说认为中药有效成分是有机成分和金属离子形成的配合物[11]。而初步实验结果显示,大黄酸金属配合物的抗癌活性相对于配体有一定程度提高,配体和金属离子之间对抑制HepG2细胞呈现协同作用。本实验通过比较IC50值,筛选出来抗癌活性最优的大黄酸金属配合物。本实验显示金属配合物在抗癌方面具有十分良好的开发前景,为探索治疗肝癌新药物提供了初步的依据。但大黄酸金属配合物抑制肿瘤细胞增殖的机制是否相同于大黄酸,尚需进一步研究。
[1] 范仁根,单湘湘,宋长志.大黄素在体外诱导人肝癌细胞smmc -7721凋亡的实验研究[J].河北医学,2008,(14)11:1264.
[2] 陈美姿,徐海荣.大黄酸药理作用的研究进展[J].国外医学中医中药分册,2002,24(3):139.
[3] 余佳,吴晓晴,孙海峰,等.大黄酸及其衍生物的生物活性研究进展[J].药学与临床研究,2008,16(2):125.
[4] 柳萌,杨迪生.顺铂耐药机制的研究进展[J].现代中西医结合杂志,2007,16(6):856.
[5] 侯魏,楚婧,侯丽然,等.木犀草素与锌配合物的合成及其DPPH自由基清除活性的研究[J].黑龙江医药科学,2012,35(4):16.
[6] 汪显阳,孙作民.大黄素铜(Ⅱ)配合物的合成、表征及抑菌活性[J].中国现代实用医学杂志,2004,3(23):5.
[7] 司徒镇强,吴军正.细胞培养[M].北京:世界图书出版公司, 2003:181.
[8] 禹莉,凌云志.顺铂对肝癌细胞株HepG2增殖和SATB1表达的影响[J].蚌埠医学院学报,2012,8,37(8):877.
[9] 黄云虹,甄永苏.大黄酸诱导肿瘤细胞凋亡及与丝裂霉素的协同作用[J].药学学报,2001,36(5):334.
[10] 丁大连,亓卫东,张梅.顺铂及其耳毒性[J].中华耳科学杂志,2008, 6(2):125.
[11] Ding Dalian,Qi Weidong, Zhang Mei.Cisplatin and its ototoxicity[J].Chinese Journal of Otology,2008,6(2):125.
[12] 曹治权,王秀萍,曹广智,等.中药中微量元素的存在状态与生物活性关系的研究[J].广东微量元素科学,1995,2(10):181.
(责任编辑:陈思敏)
The study on structure and inhibiting capacity of Rhein metal complex on human live tumor HepG2 cell proliferation
XIANG Hui, PAN Xiao-li, XIONG Yong-ai, ZHANG Shi-jin, TAN Yu-zhu, DONG Xiao-ping//(Pharmacy College, Chengdu University of Traditional Chinese Medicine; The Ministry of Education Key Laboratory of Standardization of Chinese Herbal Medicine; State Key Laboratory Breeding Base of Systematic Research, Development and Utilization of Chinese Medicine Resources Co-founded by Sichuan Province and MOST, Chengdu 611137, China)
Objective:Synthesize three Rhein metal complex and represent the structure, then compare the antitumor activity.Method:The structures of the metal complex were studied using H-NRM spectroscopy, infrared spectroscopy, ultraviolet spectroscopy, titration and Atomic Absorption Spectroscopy. And MTT test was used to study the antitumor activity on HepG2 cell.Result:The metal complex generation was confrmed through the structural characterization which suggested that the complex was constituted by Rhein molecular and one metal ion. The results of MTT test showed that rhein and the metal complex both had antitumor activity. Rhein-Fe(Ⅲ) had the strongest antitumor activity with the IC50of 17.44 μg.mL-1. And the IC50value of Rhein , Rhein-Cu(Ⅱ), and Rhein -Cr(Ⅲ)was 116.74 μg.mL-1, 54.427 μg.mL-1and 63.584 μg.mL-1respectively.Conclusion:Rhein metal complexe has a stronger antitumor activity than the ligand.
Rhein; metal complex; HepG2 cell; Antitumor activity
R 285.5
A
1674-926X(2014)05-011-04
四川省教育厅资助项目(13ZB0302)
成都中医药大学药学院 中药材标准化教育部重点实验室 中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137
向晖,在读研究生Email:xianghui12688@126.com
董小萍,教授,博士生导师,从事中药及其复方物质基础与质量标准研究Email:dongxiaoping11@126.com
2014-03-03
