NT-3 基因过表达慢病毒载体的构建和包装及鉴定
2014-03-11雷水生赵元淑胡景鑫朱晓琴
谢 柳,雷水生,赵元淑,邓 镇,余 涵,陈 丽,胡景鑫,朱晓琴
难治性癫痫种类繁多,其中以反复发作的颞叶癫痫最为常见。研究表明颞叶癫痫发作与苔藓纤维出芽(mossy fiber sprouting,MFS)形成异常兴奋环路有关。而传统的药物疗法因为癫痫耐药基因的存在而效果不理想,手术治疗又会引起较大的并发症,因此探讨一种治疗颞叶癫痫的新方法已经迫在眉睫。NT-3 是脑内一种重要的神经营养因子,Xu B[1]等研究显示颞叶癫痫发作后NT-3 mRNA 表达下降,侧脑室持续灌注NT-3 可抑制颞叶癫痫发作,下调Trk 受体、抑制MFS,提示NT-3 有防治颞叶癫痫的作用,但持续侧脑室灌注补充NT-3 将限制其在临床中的实际应用。课题组前期研究证明:基因化的间充质干细胞能够正确表达目的基因[2],并能在脑内存活、持续稳定表达[3]。因此,本课题组构建NT-3 慢病毒载体,并将其转染间充质干细胞,为脑内移植NT-3 基因修饰的间充质干细胞治疗癫痫做准备。
1 材料和方法
1.1 主要试剂及实验动物 cDNA 文库购自Biomics 公司;GV287-EGFP 质粒、pHelper 1.0 质粒、pHelper 2.0 质粒、大肠杆菌DH5α、AgeⅠ酶和293T细胞均购自上海吉凯基因化学技术有限公司。RNA提取试剂盒、PCR 试剂盒购于Takara 公司,Trizol购于Invitrogen,NT-3 一抗来自Abcam;二抗购于北京中杉金桥,胎牛血清FBS、低糖IMDM 购于Gibco。动物:成年SD 大鼠及4 周龄SD 大鼠,体重250~300g,由广州医科大学实验动物中心提供[许可证号:SYXK(粤)2012-0104]。
1.2 方 法
1.2.1 LV-GFP-NTf3 慢病毒载体构建 在Gene Bank 中找到 NT-3(Gene Bank:NM_001270870)碱基序列,通过聚合酶链反应获得NT-3的表达序列。其中上游引物5’-GAACCTTTGAAGGAGAAC-3’,下游引物5’-GTTCACCTGTAAGATCTCATCA-3’。上下游引物经AgeⅠ酶切线性化的pGC-FU-EGFP 相连接,转化用氯化钙制备的新鲜大肠杆菌感受态细胞,经PCR 筛选出阳性克隆pGCFU-NT-3-EGFP,对其行基因测序和对比分析。
1.2.2 慢病毒载体包装与鉴定 将重组的GV287-NT-3-EGFP 质粒、pHelper 1.0 质粒、pHelper 2.0 质粒分别进行高纯度无内毒素抽提,共转染293T 细胞,转染后8 h 更换为完全培养基,48 h 后收集富含已包装重组慢病毒颗粒GV287-NT-3-EGFP 的细胞上清液,在293T 细胞中测定并标定病毒滴度提取RNA,根据Takara 一步法试剂盒说明行RT-PCR 后酶切鉴定。
1.2.3 慢病毒载体滴度测定 将获取的含GV287-NT-3-EGFP 的细胞上清浓缩后行逐孔稀释法标定滴度。准备10 个无菌EP 管,在每个管内加入90 μl 无血清培养基。将病毒上清10 μl 加入第1 个EP 管中,混匀后,取10 μl 加入到第2 个管中,继续相同的操作直到最后一个管。第1 个EP 管中加入10 μl 病毒液,记为1E+1 μl;第2 个EP 管中进行了第一次10 倍稀释,记为1E+0 μl;第3 个EP管中进行了第2 次10 倍稀释,记为1E-1 μl;依次类推。将293T 细胞以4×104个细胞接种于96 孔板,接种10 孔,每孔体积100 μl。培养24 h 后吸出90 μl 培养基丢弃,加入90 μl 稀释好的病毒溶液,放入培养箱培养;96 h 后荧光显微镜计数每孔绿色荧光蛋白阳性细胞数。滴度计算公式:绿色荧光蛋白阳性细胞数/病毒原液量。
1.2.4 大鼠骨髓间充质干细胞细胞培养 取4 w 健康雄性SD 大鼠1 只,脱颈处死后置于75%酒精中浸泡5 min,于无菌条件下取出双侧股骨、胫骨,迅速放于0.01 mol PBS 中,剪除骨膜及软组织,切断干骺端,暴露骨髓腔,取5 ml 注射器吸取培养液反复冲洗骨髓腔,直至骨髓腔变白为止。将冲洗液反复吹打均匀,接种于60 mm 培养皿,置于37 ℃、CO2培养箱中培养。24 h 首换液、48 h 全换液,以后隔天全换液。5~7 d 细胞长满平皿底,细胞达到80%~90%融合时进行传代、培养。
1.2.5 LV-GFP-NTf3 转染骨髓MSCs 取状态良好的第2 代间充质干细胞以5×103于96 孔培养板中,以100 μl 培养体系培养细胞。待细胞融合率约为30%~50%进行实验。细胞分为3 组:空白对照组、不转染组、LV-GFP 转染组,用空质粒转染MSCs;LV-GFP-NTf3 转染组,加入MOI 为100 的LV-GFP-NTf3,并且加入浓度为5 μg/ml 的嘌呤霉素,置于37 ℃,CO2培养箱培养48 h 后观察细胞状态,弃去上清液,更换培养基。待感染72 h 后于荧光显微镜下观察细胞状态,荧光表达情况,并初步估计转染率。嘌呤霉素筛选,以获得稳定表达目的基因的细胞株,扩大培养2 w 后接种于60 mm 细胞培养皿中,待细胞长至80%~90%融合时进行各项指标检测。
1.2.6 RT-PCR 检测mRNA 表达 吸出细胞培养液,0.01 mol PBS 冲洗一遍,加入1 ml Trizol,提取总RNA,按逆转录试剂盒步骤逆转录成cDNA,以cDNA 为模板,上游引物5’-GAAGCCTTTGAAGGAGAAC-3’,下游引物5’-GTTCACCTGTAAGATCTCATCA-3’,将PCR 管置于ABI 公司的7500 荧光定量PCR 仪中进行PCR 扩增反应。扩增条件:95 ℃预变性5 min,95 ℃30 s,55 ℃30 s,72 ℃2 min,30个循环;溶解曲线设置为:变性95 ℃15 s,退火延伸60 ℃1 min,95 ℃15 s。用△△CT 值比较法处理数据。
1.2.7 Western blot 检测蛋白表达 细胞转染48 h 后吸出培养液,用预冷0.01 mol PBS 冲洗3遍,加入细胞裂解液,提取细胞总蛋白,BCA 法测蛋白浓度,取适量蛋白行十二烷基硫酸钠-聚丙烯酰胺胶体电泳(SDS-PAGE)凝胶电泳,将蛋白用湿转法转印到聚偏二氟乙烯膜(PVDF)上,5% 脱脂奶粉封闭1 h,一抗4 ℃封闭过夜,TBST 洗膜,加入二抗室温常温孵育1 h,TBST 洗膜,ECL 发光显影。
2 结果
2.1 NT-3 基因慢病毒载体构建 将大鼠NT-3基因经Age I 酶切线性化载体GV287-FU-EGFP 连接后,成功构建GV287-FU-NT-3-EGFP。经基因测序与对比分析,NT-3 基因序列与NCBI 公布的序列大小完全一致。
2.2 慢病毒载体包装与鉴定 由GV287-NT-3-EGFP、pHelper 1.0、pHelper 2.0 3 种质粒共转染293T 细胞,获得重组LV-NT-3-GFP,行RT-PCR 后酶切鉴定,对酶切产物行琼脂糖凝胶电泳,结果在750 bp~1.0 kb 区间出现特异性条带,与基因库中源序列818 相符。
2.3 慢病毒载体滴度测定 通过逐孔稀释法测定,在病毒原液量为1E-5 的细胞孔中出现2 个绿色荧光蛋白阳性细胞,得到的病毒滴度为2×109/ml 慢病毒浓缩液。
2.4 大鼠骨髓间充质干细胞细胞分离培养培养24 h 首次换液时有少量MSCs 贴壁生长,细胞多呈小圆形、多角形或梭形,并伴有其他细胞如成纤维细胞、单核细胞等生长。随着不断换液传代,细胞逐渐纯化,细胞呈长梭形旋涡状生长(见图1)。
2.5 LV-GFP-NTf3 转染大鼠MSCs 转染48 h后,荧光显微镜观察,LV-GFP-NTf3 转染组显示NT-3 蛋白在细胞浆内均匀表达,而未转染组、LV-GFP空质粒转染组未见NT-3 表达(见图2)。比较被转染各组细胞,发现在MOI=100 时,在不明显影响细胞生长情况下,绿色荧光蛋白阳性细胞数最多。这证明LV-GFP-NTf3 能够成功地被转染到骨髓间充质干细胞中,并正确过表达目的蛋白。
2.6 RT-PCR 检测转染后MSCs 中NT-3 mRNA的表达 实时荧光定量PCR 检测结果显示(见图3):LV-GFP-NTf3 转染组的NT-3 mRNA(213911.708±17063.369)较未转染组(0.805±0.168)和LV-GFP空质粒转染组(0.378±0.118)有明显的升高(P<0.05),而未转染组和LV-GFP 空质粒转染组相比,差异不显著,无统计学意义(P>0.05)。
2.7 Western blot 检测MSC 中NT-3 的表达Western blot 检测LV-GFP-NTf3 转染组、LV-GFP 空质粒转染组、未转染组NT-3 蛋白表达情况。结果显示(见图4):LV-GFP-NTf3 转染组过表达NT-3 蛋白,而LV-GFP 空质粒转染组、未转染组未检测到NT-3 蛋白表达。

图1 原代培养的MSCs(×400)
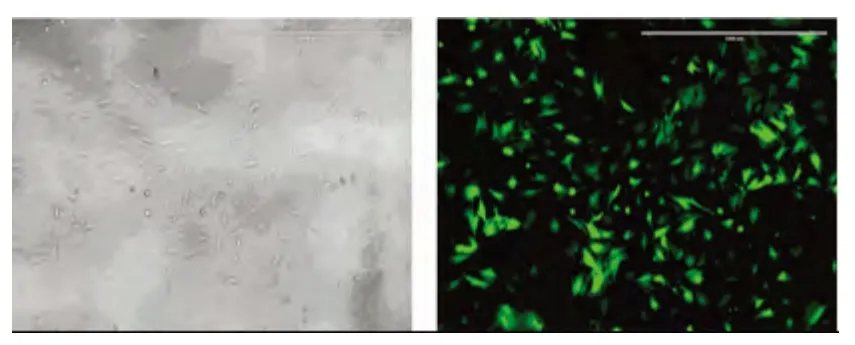
图2 MOI 为100 的慢病毒液转染MSCs 后GFP 的表达(×400)

图3 RT-PCR 检测转染后MSCs 中NT-3 mRNA 的表达
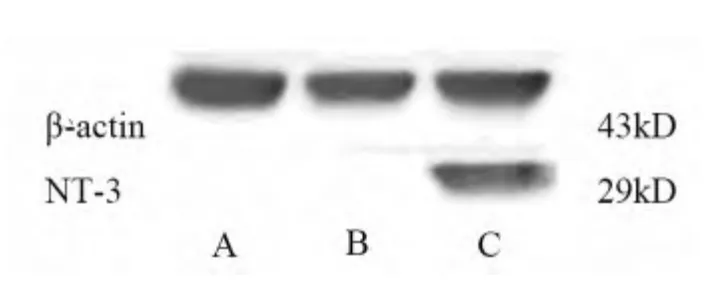
图4 Western blot 检测MSCs 中NT-3 蛋白的表达
3 讨论
癫痫是一组由大脑神经元异常放电引起的反复痫性发作的短暂的中枢神经系统功能失常为特征的慢性脑部疾病[4],是最常见的神经系统疾病之一,其特点是持续存在能产生癫痫发作的脑部持久性改变,并同时出现神经生物学、认知、心理学异常及社会学等方面的后果[5]。研究表明,慢性癫痫经常发作可引起苔藓纤维出芽,从而建立非对称性异常兴奋性神经通路,导致癫痫发作的敏感性增加,神经元兴奋性提高,最终形成颞叶癫痫[6]。反复的癫痫发作、长期服药给患者的日常生活带来极大地不便和精神压力,同时也给家庭和社会带来巨大的经济负担。因此,探究颞叶癫痫的防治措施已迫在眉睫。
最近的实验研究证实,MSCs 对损伤的神经系统功能恢复的作用主要是由于在损伤处MSCs 分泌了神经营养因子,这些神经营养因子能促进神经元的存活,诱导内源细胞的增殖和促进神经纤维的再生[7]。因此,根据MSCs 能很好的结合到中枢神经系统损伤部位的特点,可以将MSCs 作为一个理想的载体细胞,将神经营养因子靶向于脑和脊髓。
随着神经科学和分子生物学的不断发展,对神经营养因子(neurotrophin,NT)的研究和应用也倍受关注[8],NT-3 是神经营养素(NTFs)家族中重要的成员,它在神经系统发育、中枢神经元的保护、周围神经再生及营养肌肉阻止轴突和运动终板退变等方面均发挥着重要的生物学作用,具有较为广泛的生物活性[9],NT-3 是通过决定神经元前体细胞何时停止分裂来调节神经元的数目。目前对NT-3 的研究主要针对脊髓损伤和周围神经疾病的治疗[10]。随着NT-3 的研究不断深入,越来越多的研究发现NT-3 在癫痫中也有特殊的作用,并呈现出巨大的应用前景[11]。国内外研究表明癫痫发作时增高的NGF能够上调受体Trk 含量,大量的NGF 与受体结合后,能增强其对PKC、PI3K/AKT、Ras/MAPK 等信号通路的激活,从而导致苔藓发芽,形成异常兴奋环路,引起癫痫反复发作,形成颞叶癫痫[12]。然而,NT-3 属于生物大分子,不能直接通过血脑屏障,使其应用受到了限制。近期基因工程化细胞治疗疾病是研究的热点,为应用NT-3 治疗中枢神经系统疾病带来了新的曙光。基因修饰的细胞移植由于其安全、无副作用、能够替代丢失的神经元等优点,已经成为癫痫的重要治疗方法之一[13]。本实验通过外源补充NT-3 可能通过下调TrkA 受体,从而抑制NGF 与TrkA 结合,故而抑制PKC、PI3K/AKT、Ras/MAPK 等信号通路的激活,由此抑制了苔藓纤维的发芽,进而抑制兴奋环路的形成,最终抑制颞叶癫痫的发生[14]。
本实验我们根据慢病毒能使目的基因较长时间的表达且宿主细胞免疫反应小、细胞毒性小、感染细胞种类多、不受细胞分裂和增殖期限制等优点,成功构建了NT-3 载体,并将其转染MSCs,通过Westernblot、RT-PCR、免疫荧光等鉴定,NT-3 基因在转染的细胞中能够正确表达。这些初步研究为NT-3 靶向癫痫治疗开辟新途径奠定了基础,携带NT-3 基因的MSCs 抗癫痫有待进一步研究。
[1]Xu B,Michalski B,Racine RJ,et al.Continuous infusion of neurotrophin-3 triggers sprouting,decreases the levels of TrkA and TrkC,and inhibits epileptogenesis and activity-dependent axonal growth in adult rats[J].Neuroscience,2002,115(4):1295-1308.
[2]赵元淑,罗淼珊,邓 镇,等.GAD65 真核表达载体的构建及其在大鼠骨髓间充质干细胞中的表达[J].中风与神经疾病杂志,2013,30(10):877-879.
[3]赵元淑,罗淼珊,邓 镇,等.GAD65 基因修饰的间充质干细胞在癫痫大鼠脑内的表达及作用[J].华中科技大学学报(医学版),2013,42(6):642-646.
[4]Dang J,Tian F,Li F,et al.Roles of Rho guanine nucleotide triphosphatases in hippocampal mossy fiber sprouting in the pentylenetetrazole kindling model[J].Clin Lab,2014,60(2):175-184.
[5]Gulati S,Yoganathan S,Chakrabarty B.Epilepsy,cognition and behavior[J].Indian J Pediatr,2014,10:1530-1534.
[6]Chatzikonstantinou A.Epilepsy and the hippocampus[J].Front Neurol Neurosci,2014,34:121-142.
[7]Huicong K,Zheng X,Furong W,et al.The imbalanced expression of adenosine receptors in an epilepsy model corrected using targeted mesenchymal stem cell transplantation[J].Mol Neurobiol,2013,48(3):921-930.
[8]Zanin JP,Battiato NL,Rovasio RA.Neurotrophic factor NT-3 displays a non-canonical cell guidance signaling function for cephalic neural crest cells[J].Eur J Cell Biol,2013,92(8):264-279.
[9]Ghoroghi FM,Hejazian LB,Esmaielzade B,et al.Evaluation of the effect of NT-3 and biodegradable poly-L-lactic acid nanofiber scaffolds on differentiation of rat hair follicle stem cells into neural cells In vitro[J].J Mol Neurosci,2013,51(2):318-327.
[10]Weishaupt N,Om A,Hurd C,et al.Vector-induced NT-3 expression in rats promotes collateral growth of injured corticospinal tract axons far rostral to a spinal cord injury[J].Neuroscience,2014,272(10):65-75.
[11]Wang Y,Gu J,Wang J,et al.BDNF and NT-3 expression by using glucocorticoid-induced bicistronic expression vector pGC-BDNFIRES-NT3 protects apoptotic cells in a cellular injury model[J].Brain Res,2012,1448:137-143.
[12]Risbud RM,Lee C,Porter BE.Neurotrophin-3 mRNA a putative target of miR21 following status epilepticus[J].Brain Res,2011,1424:53-59.
[13]Castillo CG,Mendoza S,Freed WJ,et al.Intranigral transplants of immortalized GABAergic cells decrease the expression of kainic acid-induced seizures in the rat[J].Behav Brain Res,2006,171(1):109-115.
[14]Chen YF,Zeng X,Zhang K,et al.Neurotrophin-3 stimulates migration of mesenchymal stem cells overexpressing TrkC[J].Curr Med Chem,2013,20(24):3022-3033.
