APOE ε4 等位基因与尿AD7c-NTP 联合检测在AD 早期诊断中的初步研究
2014-03-11张凤春张金荣刘红梅
郑 磊,魏 琰,张凤春,张金荣,刘红梅
阿尔兹海默病(alzheimer’s disease,AD)是一种严重的神经退行性疾病,临床上以记忆损失和认知功能下降为主,是老年痴呆的常见形式,极大的威胁老年人的生命及健康[1]。目前,AD 的诊断主要依据患者临床表现并结合电子计算机X 射线断层扫描技术,核磁共振及神经心理学量表等综合评价。然而,由于AD 的潜伏期较长,从症状出现到确诊一般要3 y 左右时间,且在AD 确诊时患者多已存在明显的神经元损害,而此时进行药物干预治疗的效果有限[2]。因此,探寻准确特异的生物标记物早期鉴别诊断AD易发人群,实现AD 早发现早治疗的目标已势在必行。本研究对APOE ε4 等位基因与尿AD7c-NTP 联合检测在AD 早期诊断中预测效果及临床意义进行探讨,以期为AD 易发人群鉴别及早期诊断提供参考。
1 资料与方法
1.1 研究对象 所有研究对象均来自2012 年6 月~2013 年9 月我院神经内科收治患者202 例。入组标准:(1)符合中国精神障碍分类与诊断标准第三版(CCMD-3)有关精神分裂症及轻度阿尔茨海默病的诊断标准,由2 名副高职称以上的神经科医师明确诊断;(2)按照简易智能状态量表(mini mental state examination,MMSE)评分标准,临床诊断为认知功能正常者MMSE 评分均大于等于27 分,临床诊断疑似AD 患者MMSE 评分均小于等于17 分;(3)入组前无明显的抑郁症状,其汉密尔顿抑郁量表(hamilton depression scale,HAMD)评分均不少于14 分。排除标准:(1)长期大量服用抗精神病药物和曾有严重头部外伤史;(2)患者累及中枢神经系统功能的内科疾病;(3)患有严重精神疾病患者;(4)认知功能检查过程不能配合的患者。按照以上标准,共收集认知功能正常者90 例(对照组,90 例,平均年龄70.4±8.2 岁,MMSE=29.7±1.4),临床诊断疑似AD 患者76 例(PAD 组,76 例,平均年龄72.2±9.2 岁,MMSE=16.2±2.6),各组在年龄,性别,教育年限方面差异无显著性(P≥0.05)。
1.2 研究方法
1.2.1 样本采集 所有研究对象空腹抽取静脉血10 ml,采用肝素锂抗凝保存,常温保存时间不多于24 h,晨尿30~50 ml,4 ℃保存时间不多于7 d。
1.2.2 仪器与试剂 酶标仪购自Thermo Fisher Scientific 公司,型号为MultiSkan FC;台式低温离心机购自Eppendorf 公司,型号为5810R;PCR 仪购自Bio-Rad 公司,型号为MyCycler;琼脂糖凝胶电泳仪购自北京六一公司,型号DYCP-31DN;核酸蛋白测定仪购自Eppendorf 公司,型号为BioPhotometer D30;
1.2.3 限制性内切酶基因亚型分型 利用Hixson 和Vernier 等[3]的PCR 及限制性内切 酶APOE 基因亚型分型方法,通过红细胞裂解液分离静脉血样本(10 ml)中的白细胞,白细胞经预冷的磷酸盐缓冲液洗涤3 次后,提取基因组DNA 进行基因扩增,扩增引物为F4(5’-ACAGAATTCGCCCCGGCCTGGTACAC-3’)和F6(5’-TAAGCTTGGCACGGCTGTCCAAGGA-3’),扩增产物经HhaI 酶切(酶切位点为GCGC)后进行琼脂糖凝胶电泳,根据电泳后分离条带的位置及数量区分不同的APOE 等位基因亚型。
1.2.4 酶联免疫吸附检测 尿AD7c-NTP 酶联免疫吸附检测试剂盒购自深圳市安群生物工程有限公司,严格按试剂说明书操作。
1.2.5 统计分析 采用SPSS17.0 统计软件对数据进行统计分析处理。符合正态分布的计量资料采用±s 表示,两组间差异比较采用t 检验。P≤0.05 为差异有统计学意义。
2 结果
2.1 APOE 等位基因在对照组、PAD 组中表达频率的比较 为确定APOE 等位基因是否在对照组和PAD 组中存在不同的表达频率,本研究利用Hixson 和Vernier 等[3]的PCR 及限制性内切酶APOE基因亚型分型方法,对所有166 例患者进行APOE等位基因的检测,结果显示PAD 组APOE ε4 等位基因较对照组的表达频率显著提高(P≤0.05)(见表1),而APOE ε2 或ε3 等位基因对照组和PAD 组间中表达频率无差异(P≥0.05)(见表1),提示,APOE ε4 等位基因可能与AD 的发生相关。
2.2 酶联免疫吸附检测对照组、PAD 组尿样中AD7c-NTP 的含量 酶联免疫吸附结果显示,尿样中AD7c-NTP 的含量在PAD 组中较对照组有显著升高(P≤0.01)(见表3),提示尿样中AD7c-NTP 的含量变化与AD 相关。
2.3 APOE ε4 与AD7c-NTP 联合诊断与单独诊断比较 作为有效的AD 早期诊断的生物标记物,其必须拥有较高的灵敏度、特异性、阳性预测值和阴性预测值。本研究对PAD 组中34 例APOE ε4等位基因阳性患者及对照组中71 例APOE ε4 等位基因阴性患者进行尿AD7c-NTP 检测(见表3)。结果显示,相比与单独检测,尿AD7c-NTP 在携带APOE ε4 等位基因的患者中的检测效果高于单独检测,提示APOE ε4 与AD7c-NTP 联合检测在AD 早期诊断中具有较好的预测价值。

表1 APOE 等位基因在对照组、PAD 组中表达频率的比较
表2 酶联免疫吸附检测比较对照组、PAD 组尿样中AD7c-NTP 的含量(±s,ng/ml)
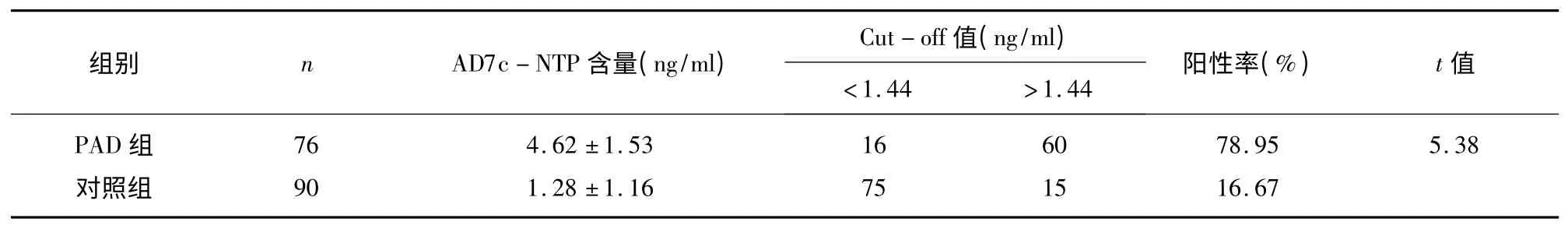
表2 酶联免疫吸附检测比较对照组、PAD 组尿样中AD7c-NTP 的含量(±s,ng/ml)

表3 对照组和PAD 组中APOE ε4 与AD7c-NTP 联合检测比较

表4 APOE ε4 与AD7c-NTP 联合诊断与单独诊断效果比较
3 讨论
据统计,全球65 岁以上老人有13%发生AD,而85 岁以上老人AD 患病率高达45%,随着人口老龄化的加速,预计到2050 年,全世界将有8000 万人遭受AD 困扰[4]。目前,由于AD 病因及发病机制尚未阐明,治疗方法主要通过降低AD 的特征性病理特征如β-淀粉样蛋白(amyloid-β,Aβ)寡聚合物、淀粉样斑块(amyloid plaques)、微管相关蛋白tau 聚合物和神经原纤维缠结(neurofibrillary tangles,NFTs)等,以期阻止疾病进展[5,6]。这种“减少毒素”的治疗策略在AD 发生的早期可以取得较好效果,但在AD 病程的中后期仅能缓解AD 的症状,无法遏制或逆转AD 的病程[7]。因此,探寻准确特异的生物标记物早期诊断鉴别AD 易发人群,监测病程进展和药物疗效,以实现AD 早发现早治疗的目标已势在必行。
近期,全基因组关联研究证实,载脂蛋白E(Apolipoprotein E,APOE)基因多态性与AD 发病风险关系密切,其APOE ε4 等位基因是AD 最强的遗传危险因素,与早发性和迟发性AD 发病风险增加呈正相关[8,9]。人APOE 存在3 种主要亚型即APOE2、APOE3、APOE4,分别由19 号染色体长臂上3 个等位基因ε2、ε3、ε4 编码产生,其全球基因频率分别为8.4%、77.9%、13.7%,然而,APOE ε4 在AD患者中的频率却高达40%。已经证实,APOE ε4 以剂量相关方式增加AD 的发病率并使患者发病年龄提前,Farrer 等[10]研究发现,91%的APOE ε4 纯合基因携带者在68 岁左右发病,约47%的APOE ε4 杂合基因携带者在76 岁时发病,而在APOE ε4 非携带者中,仅20%的人在85 岁时才发生AD。此外,在轻度认知功能障碍(Mild cognitive impairment,MCI)患者中,携带APOE ε4 的患者表现出更快的认知功能下降和记忆损失,而MCI 被认为是AD 的早期阶段,与AD 发病风险密切相关。APOE 是人体重要的载脂蛋白,其可通过介导脂质转运调节脂类平衡。在外周组织中,APOE 主要由肝脏和巨噬细胞产生,介导机体胆固醇代谢。已经证实,APOE4 与高血脂症和高胆固醇血症相关,而二者可引发动脉粥样硬化,冠状动脉心脏病和卒中等心脑血管病。在中枢神经系统中,APOE4 主要由星形胶质细胞产生,通过低密度脂蛋白受体(low density lipoprotein receptor,LDLR)和LDL 相关蛋白参与胆固醇平衡[11]。
大量研究表明,APOE 与Aβ 代谢密切相关,其基因亚型可强烈影响Aβ 沉积所形成的老年斑,并促进脑淀粉样血管病(cerebral amyloid angiopathy,CAA)发生,而Aβ 和CAA 正是AD 两个最主要的病理特征。免疫组化证据表明,APOE 与AD 患者大脑中的老年斑共同沉淀,且APOE ε4 携带者要显著多于非携带者(40.7%对8.2%),而这种差异在50~59 岁之间最为明显[12]。Barthel 等[13]利用匹兹堡化合物B(pittsburgh compound B,PiB)PET 成像技术证实,APOE ε4 基因携带者在PiBPET 阳性AD 患者中的比率显著高于PiBPET 阴性患者(65%对22%),提示APOE ε4 基因携带者拥有较多的纤维状Aβ 聚集,原因可能与APOE 参与调节大脑Aβ 代谢、聚集和沉积有关。已经证实,大脑Aβ 水平和淀粉样斑块的形成为APOE 亚型依赖(ε4>ε3>ε2)[14]。基础研究发现,APOE 调节Aβ 的清除主要是将大脑中Aβ 通过血脑屏障运输到外周血液循环,而APOE4对Aβ 的运输能力和清除效率显著低于APOE3,可能与APOE4-脂蛋白与Aβ 的亲和力低于APOE3-脂蛋白相关[15]。此外,APOE 亚型对大脑胆固醇水平的调节不同,而胆固醇可调节γ-分泌酶活性和Aβ的产生,相比于APOE4,APOE3 可更有效的促进酶介导的Aβ 降解[16]。最近,许多研究发现,APOE 等位基因亚型可影响大脑及脑脊液中APOE 的水平(ε4<ε3<ε2),认为APOE ε4 基因携带者所引起的总APOE 水平的降低可能有助于AD 疾病的进展[17]。此外,APOE 还与AD 其他的风险因子密切相关,已经证实,APOE ε4 可通过与动脉粥样硬化,周围血管疾病及2 型糖尿病等协同作用增加AD 的发病风险。最近,Yang 等[18]亦证实,APOE 与成人海马齿状回区域的神经干细胞或祖细胞的维护密切相关,而APOE ε4 可通过损伤海马区γ-氨基丁酸(GABA)能中间神经元抑制海马神经发生,从而导致记忆和学习障碍,揭示APOE4 的一个重要病理作用,即通过抑制或减少神经发生促进AD 疾病的进展[2]。已经证实,APOE 的表达受核受体过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor gamma,PPARγ)和肝脏X 受体(liver X receptors)与维甲酸X 受体(retinoid X receptors,RXRs)协调作用影响。Cramer 等[19]证实,在患有AD 的啮齿类动物中,口服RXRs 激动剂蓓萨罗丁(bexarotene)可提高APOE 的表达,并显著增强APOE 基因依赖的Aβ 的清除,其72 h 内可将小鼠脑内沉积的Aβ 清除半数,最终的总清除率可达75%,提示将APOE 作为AD 检测和治疗靶点的具有广阔前景。免疫治疗作为AD 的治疗策略亦取得一定成果,如近期靶向于Aβ N 末端的抗体bapineuzumab,其III 期临床试验结果显示,bapineuzumab 可有效阻止携带APOE ε4 基因的轻中度AD 患者大脑Aβ 的沉积,较低其微管相关蛋白tau 的磷酸化水平。此外,Head 等[20]研究表明,维持血管健康,积极的休闲活动和锻炼有助于减少APOE ε4 基因携带者AD 的发生和认知功能下降。近年来,APOE ε4 作为AD发病的风险因子正逐渐成为探索AD 发病机制的热点,然而基于AD 发病机制的关系仍有许多不清,尚需要大量APOE ε4 相关的研究探索工作。由于APOE 对AD 的作用还可能受LDLR 基因及胆固醇水平等因素调节,单纯的以APOE ε4 等位基因预测AD 仍存在一些局限。如Itabashi 等[21]研究发现,仅通过APOE ε4 诊断AD 的敏感度和特异度不高(50%左右),且存在一定程度的假阳性和假阴性。因此,应该指出,单独应用APOE ε4 作为AD 诊断的生物标记物时,应首先排除影响其检测的因素,亦或结合其他生物标记物联合诊断,以提高其在AD 早期诊断的灵敏度和特异度。
近期大量研究发现,在早期AD 患者的脑脊液和尿液中阿尔茨海默相关神经丝蛋白(alzheimer’s disease related neural thread protein,AD7c-NTP)的表达水平都选择性的增加。AD7c-NTP 属神经丝蛋白家族的一个成员,是由375 个氨基酸组成的基因序列编码产生大小为41KD 的跨膜磷酸化蛋白,大量存在于AD 患者脑中的NFTs 中,参与脑神经元的修补、再生和凋亡等[22]。AD7c-NTP 主要在组织学尚完整的变性神经元中表达增加,待神经元细胞衰亡后,大量的AD7c-NTP 被释放到脑脊液中,后经尿液排出。de la Monte 等[23]发现,在AD 病程的早期AD7c-NTP 基因过度表达,从而引起AD7c-NTP 免疫活性的增强,进而导致磷酸化tau 蛋白免疫介导的细胞骨架病变,但AD7c-NTP 不参与淀粉样蛋白的聚积。另外,过度表达的AD7c-NTP 还可加速凋亡介导的神经细胞死亡,促进p53 和CD95 等促凋亡基因的表达,还可引起线粒体功能受损等[24]。越来越多的证据表明,AD7c-NTP 的异常变化是AD 病程早期的生物学事件,其在脑脊液和尿液中的含量与AD疾病的严重程度呈正相关[25]。若脑脊液或尿液中含量异常增高,早期可疑或可能AD 占62%,死后确定诊断的AD 占84%。然而,有对脑脊液中AD7c-NTP 进行检测有损伤大脑的风险,且需专业人员及特殊设备,使其在应用时存在一定的局限性。近期,大量的研究表明,AD 患者尿液中AD7c-NTP 的水平较正常老人显著增加,与年龄无关。尿AD7c-NTP诊断早期AD 的特异度为90%,灵敏度为80%~85%,与脑脊液标本的检测相比具有取材简单、无创、易复查等特点,使其在AD 早期诊断上更具应用价值[26]。
本研究结果显示,PAD 组患者APOE ε4 等位基因表达频率较对照组显著升高(见表1),说明AD 发病与APOEε4 等位基因的水平相关,然而单独应用APOE ε4 作为AD 早期诊断的生物标记物,其灵敏度和特异性仅50%左右(见表1),提示APOE ε4 仅适于作为AD 易发人群早期基因筛查,应同时结合临床病理检查和/或特异的AD 生物标记物等进一步诊断及监测。与Tan 等研究结果一致,我们的结果显示,尿AD7c-NTP 水平在PAD 组患者中显著高于对照组,其灵敏度为81.25,特异性高达86.67%。为评估APOE ε4 与AD7c-NTP 联合检测在AD 易发人群早期筛查和诊断中临床意义,我们对APOE ε4和AD7c-NTP 联合检测进行比较,结果显示,联合检测的灵敏度、特异性、PPV 和阴NPV 均高于单独检测。此外APOE ε4 和AD7c-NTP 检测操作简单,无创,可重复性高,易于患者定期监测,提示APOE ε4与AD7c-NTP 联合检测在AD 早期诊断中具有较好的应用价值。
总之,我们的研究结果证实,在疑似AD 患者中,APOE ε4 等位基因的表达频率显著增高,而尿AD7c-NTP 的水平亦显著升高,二者的变化与AD 疾病早期进展关系密切。通过APOE ε4 与AD7c-NTP联合检测可互补二者在单独应用时的不足,提升AD诊断的预测价值,宜作为AD 易发人群筛查及早期诊断的生物标记物。
[1]Alzheimer’s Association.2012 Alzheimer’s disease facts and figures[J].Alzheimers Dement,2012,8:131-168.
[2]Liu CC,Kanekiyo T,Xu H,et al.Apolipoprotein E and Alzheimer disease:risk,mechanisms and therapy[J].Nat Rev Neurol,2013,9(2):106-118.
[3]Hixson JE,Vernier DT.Restriction isotyping of human apolipoprotein E by gene amplification and cleavage with HhaI[J].J Lipid Res,1990,31(3):545-548.
[4]Humpel C.Identifying and validating biomarkers for Alzheimer’s disease[J].Trends Biotechnol,2011,29(1):26-32.
[5]Mullard A.Sting of Alzheimer’s failures offset by upcoming prevention trials[J].Nature Rev Drug Discov,2012,11(9):657-660.
[6]Herrmann N,Chau SA,Kircanski I,et al.Current and emerging drug treatment options for Alzheimer’s disease:a systematic review[J].Drugs,2011,71:2031-2065.
[7]Lu B,Nagappan G,Guan X,et al.BDNF-based synaptic repair as a disease-modifying strategy for neurodegenerative diseases[J].Nat Rev Neurosci,2013,14(6):401-416.
[8]Harold D,Abraham R,Hollingworth P,et al.Genome-wide association study identifies variants at CLU and PICALM associated with Alzheimer’s disease[J].Nat Genet,2009,41(10):1088-1093.
[9]Huang Y,Mucke L.Alzheimer mechanisms and therapeutic strategies[J].Cell,2012,148(6):1204-1222.
[10]Farrer LA,Cupples LA,Haines JL,et al.Effects of age,sex,and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease.A meta-analysis.APOE and Alzheimer Disease Meta Analysis Consortium[J].JAMA,1997,278(16):1349-1356.
[11]Bu G.Apolipoprotein E and its receptors in Alzheimer’s disease:pathways,pathogenesis and therapy[J].Nat Rev Neurosci,2009,10(5):333-344.
[12]Kok E,Haikonen S,Luoto T,et al.Apolipoprotein E-dependent accumulation of Alzheimer disease-related lesions begins in middle age[J].Ann Neurol,2009,65(6):650-657.
[13]Barthel H,Gertz HJ,Dresel S,et al.Cerebral amyloid-β PET with florbetaben(18F)in patients with Alzheimer’s disease and healthy controls:a multicentre phase 2 diagnostic study[J].Lancet Neurol,2011,10(5):424-435.
[14]Castellano JM,Kim J,Stewart FR,et al.Human apoE isoforms differentially regulate brain amyloid-β peptide clearance[J].Sci Transl Med,2011,3(89):8957.
[15]Deane R,Sagare A,Hamm K,et al.apoE isoform-specific disruption of amyloid beta peptide clearance from mouse brain[J].J Clin Invest,2008,118(12):4002-4013.
[16]Osenkowski P,Ye W,Wang R,et al.Direct and potent regulation of gamma-secretase by its lipid microenvironment[J].J Biol Chem,2008,283(33):22529-22540.
[17]Wahrle SE,Shah AR,Fagan AM,et al.Apolipoprotein E levels in cerebrospinal fluid and the effects of ABCA1 polymorphisms[J].Mol Neurodegener,2007,2:7.
[18]Yang CP,Gilley JA,Zhang G,et al.ApoE is required for maintenance of the dentate gyrus neural progenitor pool[J].Development,2011,138(20):4351-4362.
[19]Cramer PE,Cirrito JR,Wesson DW,et al.ApoE-directed therapeutics rapidly clear β-amyloid and reverse deficits in AD mouse models[J].Science,2012,335(6075):1503-1506.
[20]Head D,Bugg JM,Goate AM,et al.Exercise Engagement as a Moderator of the Effects of APOE Genotype on Amyloid Deposition[J].Arch Neurol,2012,69(5):636-643.
[21]ItabashiS,Arai H,Matsui T,et al.Absence of association of alpha1-antichymotrypsin polymorphisms with Alzheimer’s disease:a report on autopsy-confirmed cases[J].Exp Neurol,1998,151(2):237-240.
[22]Levy S,McConville M,Lazaro GA,et al.Competitive ELISA studies of neural thread protein in urine in Alzheimer’s disease[J].J Clin Lab Anal,2007,21(1):24-33.
[23]de la Monte SM,Wands JR.The AD7c-NTP neuronal thread protein biomarker for detecting Alzheimer’s disease[J].Front Biosci,2002,7:989-996.
[24]de la Monte SM,Wands JR.Alzheimer-associated neuronal thread protein-induced apoptosis and impaired mitochondrial function in humancentral nervous system-derived neuronal cells[J].J Neuropathol Exp Neurol,2001,60(2):195-207.
[25]Youn YC,Park KW,Han SH,et al.Urine neural thread protein measurements in Alzheimer disease[J].J Am Med Dir Assoc,2011,12(5):372-376.
[26]Levy S,McConville M,Lazaro GA,et al.Competitive ELISA studies of neural thread protein in urine in Alzheimer’s disease[J].J Clin Lab Anal,2007,21(1):24-33.
