门控心肌灌注显像定量分析评价心肌梗死后左心室重构及其对心功能的影响
2014-03-10王建锋WANGJianfeng
王建锋 WANG Jianfeng
王跃涛 WANG Yuetao
牛 荣 NIU Rong
邵晓梁 SHAO Xiaoliang
张 云 ZHANG Yun
陈海龙 CHEN Hailong
储 懿 CHU Yi
陆培奇 LU Peiqi
门控心肌灌注显像定量分析评价心肌梗死后左心室重构及其对心功能的影响
王建锋 WANG Jianfeng
王跃涛 WANG Yuetao
牛 荣 NIU Rong
邵晓梁 SHAO Xiaoliang
张 云 ZHANG Yun
陈海龙 CHEN Hailong
储 懿 CHU Yi
陆培奇 LU Peiqi
目的探讨门控心肌灌注显像(GMPI)定量分析技术评价心肌梗死(MI)患者左心室重构的临床价值及其对左心功能的影响。资料与方法回顾性分析76例MI患者,包括左前降支(LAD)病变组21例、左旋支(LCX)或右冠支(RCA)病变组23例、多支病变组32例,选择74例健康人为对照组。所有受检者均进行GMPI。应用QGS 2009软件对重建后的图像进行自动分析,获得左心室重构指标:舒张末期球形指数(SIED)和收缩末期球形指数(SIES);并获得心功能参数:舒张末期容积(EDV)、收缩末期容积(ESV)、左心室射血分数(LVEF)、高峰充盈率(PFR)。比较MI组与对照组左心室重构指标和心功能参数,分析心肌梗死后左心室重构与冠状动脉病变的关系。结果MI组SIED、SIES、EDV、ESV较对照组均明显升高(P<0.01),LVEF、PFR较对照组明显降低(P<0.01)。LAD病变组及多支病变组之间SIED、SIES无显著差异(P>0.05),但均较LCX/RCA病变组明显升高(P<0.05);LAD病变组与多支病变组发生左心室重构的概率差异无统计学意义(χ2=0.105,P>0.05),但两组发生左心室重构的概率明显高于LCX/RCA病变组(χ2=6.502、10.166, P<0.05)。线性回归分析显示随SIED值增高,LVEF、PFR呈下降趋势(F=43.231、15.642, P<0.01)。 左 心 室 重 构 定 量 指 标SIED和SIES在 同一操作者及两名操作者之间的处理分析结果均呈高度相关(r=0.881~0.926, P<0.01)。结论GMPI定量分析技术可准确评价心肌梗死后左心室重构,LAD病变及多支冠状动脉病变所致心肌梗死患者更易发生左心室重构且程度重,左心室重构会严重影响心肌的收缩和舒张功能,从而导致整个左心功能受损。
心肌梗死;门控血池显像;心肌再灌注;灌注成像;心室功能,左
心肌梗死(myocardial infarction, MI)后发生的左心室(包括梗死区和非梗死区)形态、大小以及室壁厚度的改变称为左心室重构(left ventricular remodeling, LVRM)。准确客观地评价MI后是否发生重构对指导临床治疗及评价预后十分必要且意义重大[1,2]。既往有学者[3]应用手动勾画非门控心肌灌注断层显像左心室短轴与长轴最大尺寸的比值以判断左心室MI后球形化指标,但该方法手动操作导致结果可变性大、重复性差,因此其临床应用价值受限。门控心肌灌注显像(gated myocardial perfusion imaging, GMPI)不仅可以准确地判断MI的程度及范围,同时可以自动获得评估左心室球形化的定量指标,是评价MI后左心室重构的有效方法之一,但目前该技术的临床应用罕有报道。本研究应用GMPI定量分析技术对MI患者左心室重构进行定量分析,并探讨其对左心功能的影响。
1 资料与方法
1.1 研究对象 回顾性分析2010-10~2013-09在江苏省常州市第一人民医院临床确诊的76例MI患者,其中,男63例,女13例;平均年龄(61.64±10.58)岁。MI诊断参考中华医学会心血管病学分会等制订的标准[4]。排除经冠状动脉搭桥术或支架植入术、合并严重瓣膜疾病、肥厚型或扩张型心肌病、心包疾病者。根据冠状动脉造影结果进行冠状动脉病变血管分组,以冠状动脉造影显示冠状动脉主要分支内径狭窄≥50%作为冠状动脉狭窄具有临床意义的标准,将研究对象分为单纯左前降支(left anterior descending artery, LAD)病变组21例,男16例,女5例,平均年龄(53.5±13.4)岁;左旋支(left circumfex artery, LCX)或右冠支(right coronary artery, RCA)病变组23例,男17例,女6例,平均年龄(54.2±11.5)岁;多支(双支或多支冠状动脉)病变组32例,男20例,女12例,平均年龄(56.2±14.3)岁。同期另选取经病史、体检、心电图、心脏多普勒超声、GMPI及冠状动脉造影均正常的74名健康人为对照组,其中,男41例,女33例;平均年龄(60.0±13.0)岁。所有受检者均进行了99Tcm-MIBI静息门控心肌灌注断层显像,并于1个月内行冠状动脉造影。
1.2 仪器与方法 采用Siemens Symbia T16型双探头SPECT/CT仪。显像剂为上海欣科医药公司提供的99Tcm-MIBI,放化纯>95%,注射剂量为740~1110 MBq。检查前停用β受体阻滞剂、硝酸酯类等影响心率或扩张冠状动脉的药物。静息门控SPECT心肌灌注显像采集条件:平行孔低能高分辨准直器,矩阵128×128,放大倍数1.2,双探头成90°,各旋转90°,共180°采集,6°/帧,每帧采集35 s,门控采集将每个心动周期分为8帧。采用Butterworth函数滤波反投影法重建后得到左心室短轴、水平长轴、垂直长轴图像。
1.3 左心室重构的定量分析 选取静息99Tcm-MIBI心肌灌注断层图像,应用QGS 2009软件获得左心室重构指标球形指数。球形指数[5]是左心室短轴与长轴最大尺寸之间的比例。如图1所示,计算机软件可通过测量舒张末期前壁至下壁或后壁心肌内侧心内膜表面的最长垂直距离(AED)以及左心室心尖部心内膜表面至基底部连线中点的最长垂直距离(BED),即可得到舒张末期球形指数(sphericity index of end-diastolic, SIED),SIED=AED/BED,同理可得收缩末期球形指数(sphericity index of end-systolic, SIES),SIES=AES/ BES。根据文献报道[6]应用超声技术选取舒张末期评价左心室重构的方法,选择对照组中SIED值的 ±2s作为异常临界阈值,即大于该阈值定义为发生左心室重构,反之则为非左心室重构。

图1 GMPI QGS软件计算左心室球形指数。A.舒张末期前壁至下壁或后壁心肌内侧心内膜表面的最长垂直距离;B.左心室心尖部心内膜表面至基底部连线中点的最长垂直距离;SIED=A/B
1.4 心功能指标的获得 选取静息99Tcm-MIBI心肌灌注断层图像,应用QGS 2009软件对重建后的门控心肌图像进行自动分析,分析结果中可得到心功能参数左心室舒张末期容积(end-diastolic volume, EDV)、收缩末期容积(end-systolic volume, ESV)、左心室射血分数(left ventricular ejection fraction, LVEF)和高峰充盈率(peak flling rate, PFR),PFR以EDV/S表示。
1.5 重复性检验 随机选择40例正常受检者,由同一操作人员采用盲法在1周内进行2次图像重建和QGS定量分析左心室重构,另一操作者亦采用盲法再次进行图像重建并获得QGS分析结果,以评价GMPI定量分析技术在同一操作者和不同操作者之间评价左心室重构的重复性。
1.6 统计学方法 采用SPSS 16.0软件,两组间比较根据方差齐性与否行t检验或t′检验,多组间比较根据方差齐性与否行q检验或秩和检验,多组间定量资料的两两比较采用LSD法,率的比较采用χ2检验或Fisher确切概率法,采用线性回归分析评价左心室重构指标SIED对心功能参数的影响,采用Pearson线性相关分析进行重复性检验,P<0.05表示差异有统计学意义。
2 结果
2.1 MI组与对照组左心室重构指标及心功能参数比较 MI组的左心室重构指标SIED、SIES均较对照组明显升高,心功能参数中EDV、ESV较对照组均明显升高,LVEF、PFR较对照组明显减低,两组各指标差异均有统计学意义(t=6.443~11.976, P<0.01)。见表1。

表1 MI组与对照组左心室定量指标比较
2.2 MI后左心室重构与冠状动脉病变血管的关系 LAD病变组、多支病变组及LCX/RCA病变组的左心室重构定量指标SIED、SIES较对照组均升高,差异有统计学意义(t=2.599~6.679, P<0.01);LAD病变组、多支病变组的SIED、SIES较LCX/RCA病变组均明显升高(t=2.443~3.374, P<0.01);LAD病变组与多支病变组的SIED、SIES无明显差异(t=0.163、0.192, P>0.05),见表2。根据正常组所得的SIED值的 ±2s作为异常临界阈值,即SIED≥0.64定义为发生左心室重构,SIED<0.64定义为无左心室重构。其中,LCX/RCA病变组发生左心室重构10例(52.17%,10/23),LAD病变组发生左心室重构17例(71.43%,17/21),多支病变组发生左心室重构27例(78.12%,27/32),3组间发生左心室重构的概率差异有统计学意义(χ2=12.265, P<0.05),LAD病变病变组、多支病变组发生左心室重构的概率均明显高于LCX/RCA病变组(χ2=6.502、10.166, P<0.05),而LAD病变组与多支病变组发生左心室重构的概率差异无统计学意义(χ2=0.105, P>0.05)。

表2 不同冠状动脉病变血管组间左心室重构定量指标比较
2.3 MI后左心室重构对心功能的影响 线性回归分析显示,左心室重构指标SIED对心功能参数LVEF、PFR均有影响,表现为随SIED值增高,LVEF、PFR呈下降趋势(图2),即左心室重构越明显,左心室心功能受损越严重(F=43.231、15.642, P<0.01)。
2.4 GMPI定量分析技术评价左心室重构的重复性左心室重构定量指标SIED和SIES在同一操作者先后两次处理分析结果相关系数为:rSIED=0.881、rSIES=0.924,P<0.01;两名操作者之间的处理分析结果相关系数为:rSIED=0.888、rSIES=0.926,P<0.01。见图3、4。
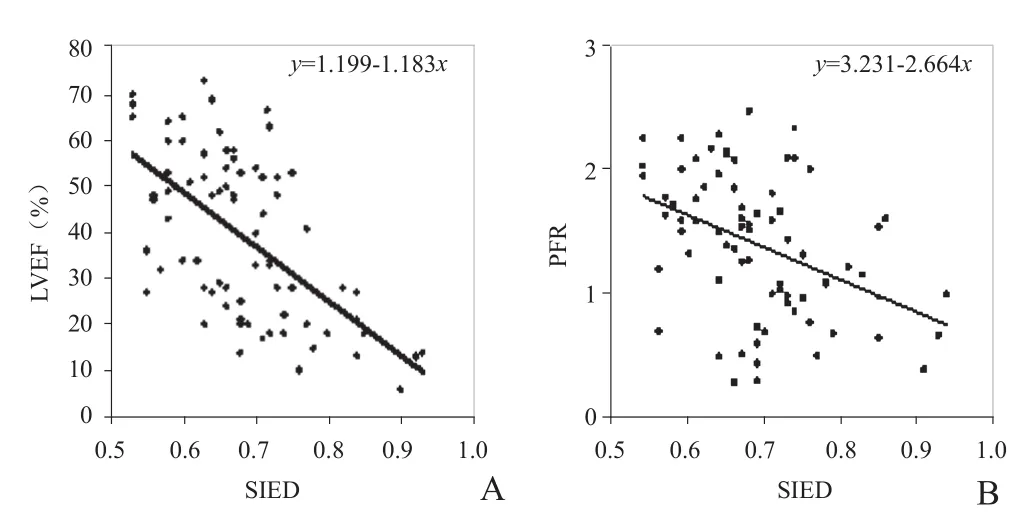
图2 左心室重构指标SIED与左心功能参数LVEF(A)、PFR(B)的线性回归分析

图3 第一操作者两次处理SIED(A)、SIES(B)的相关性

图4 两名操作者处理SIED(A)、SIES(B)的相关性
3 讨论
MI后左心室重构是临床上常见的慢性进行性发展的病理生理过程,MI后由于局部心肌缺血及心肌工作负荷的重新分配,导致非梗死区心肌的负荷相对增加,梗死区和非梗死区形态和大小均发生改变,从而引起左心室重构[7]。超声研究发现MI后心室心尖部与中央部的纵径比和横径比明显增高[6]。GMPI QGS软件可自动勾画左心室短轴与长轴最大尺寸的比值以判断左心室MI后球形化指标[8],相对于先前国内学者手动勾画法[3]具有更高的可重复性。本研究是采用GMPI QGS自动定量分析技术,结果发现心肌梗死组左心室重构定量指标SIED、SIES均较对照组有显著性差异,并且MI组EDV、ESV均明显高于对照组,而LVEF以及PFR均明显低于对照组,表明MI患者存在着不同程度的左心室重构,且左心室收缩及舒张功能受损,该结论与文献报道[6,9]相一致。
冠心病早期即可出现心脏结构的改变,并随着冠状动脉病变的加重和累及血管的增多而日趋严重,当发生MI时,受梗死部位和面积、侧支循环的建立等解剖因素以及肾素-血管紧张素-醛固酮系统等神经体液活动的影响,心脏结构可进一步发生改变,即发生左心室重构,其中梗死的部位和面积是左心室重构的主要影响因素[10,11]。本研究中LAD病变组以及多支病变组的左心室重构指标SIED、SIES均高于LCX/RCA病变组,与以往的研究结果[10,12]相似,同时本研究还发现LAD病变组以及多支病变组发生左心室重构的概率明显高于LCX/RCA病变组,进一步证实LAD或者多支冠状动脉发生狭窄或阻塞时更容易发生左心室重构。分析其原因可能为:通常左心室血液供应约50%来自LAD,主要供应左心室前壁、心尖及室间隔前2/3,约占全部MI的50%,并且前壁心尖区是整个左心室腔最薄且曲度最大的区域,对变形力作用的反应最显著以及供应前壁的左前降支动脉硬化往往较重,血供较差,因而梗死面积较大,梗死后易发生左心室扩大;下壁梗死面积较小,且下壁紧邻膈肌,运动幅度较小,相对不易发生梗死膨展和左心室扩大,故LAD病变易发生左心室重构[13]。而多支冠状动脉病变由于累及的血管多,梗死范围往往较单支血管病变更广泛,因此同样容易发生左心室重构。
MI后发生左心室重构患者其心力衰竭发生率及死亡率明显高于未发生重构的患者,左心室重构发展到一定程度会严重影响心肌的收缩和舒张功能,从而导致整个左心功能受损[14]。本研究发现随SIED值增高,LVEF、PFR呈下降趋势,表明左心室重构越明显左心室心功能受损越严重。陈明等[15]应用实时三维超声心动图评价冠心病患者左心室重构指数与收缩功能的研究发现:在LAD组、LCA/RCA组、多支组的左心室重构指数与LVEF均呈显著相关性(r=0.83、0.86、0.77, P<0.01),而在正常对照组无显著相关性(r=0.100, P>0.05),与本研究结果相类似。因此,左心室重构与左心功能受损的作用是相互的,表现为心肌缺血进一步发展,心肌收缩力降低,心脏排出量减少,射血分数减低,左心室舒张末压升高及容量增加,前后负荷加重,进而促进了左心室的重构。
本研究对GMPI QGS定量评价左心室重构进行重复性检验,发现同一操作者先后两次获得的左心室重构指标SIED、SIES均呈高度相关(r=0.881、0.924, P<0.01),且由另一操作者再次重建图像并获取的SIED、SIES与第一操作者之间的分析结果亦呈高度相关(r=0.888、0.926, P<0.01),表明GMPI QGS定量分析技术评价MI后左心室重构操作简便,可重复性强。
总之,GMPI定量分析技术可以准确评价MI后左心室重构,LAD病变及多支冠状动脉血管病变所致MI患者更易发生左心室重构且程度重,左心室重构会严重影响心肌的收缩和舒张功能,从而导致整个左心功能受损。目前本研究领域仍存在以下不足:①GMPI评价左心室重构尚无统一的诊断界值标准,本研究样本量较小,尚需要大样本的临床试验予以总结;②目前尚无GMPI与其他影像技术如超声心动图、CT、MRI等关于评价MI后左心室重构的相关性分析,有待进一步研究予以证实。
[1] Hung CL, Verma A, Uno H, et al. Longitudinal and circumferential strain rate, left ventricular remodeling, and prognosis after myocardial infarction. J Am Coll Cardiol, 2010, 56(22): 1812-1822.
[2] Berti V, Sciagrà R, Acampa W, et al. Relationship between infarct size and severity measured by gated SPECT and long-term left ventricular remodelling after acute myocardial infarction. Eur J Nucl Med Mol Imaging, 2011, 38(6): 1124-1131.
[3] 张居洋, 王跃涛, 鹿存芝, 等.99mTc-MIBI心肌灌注断层显像评价心肌梗死后左心室重构. 东南大学学报(医学版), 2006, 25(6): 434-436.
[4] 中华医学会心血管病学分会, 中华心血管病杂志编辑委员会. 急性ST段抬高型心肌梗死诊断和治疗指南. 中华心血管病杂志, 2010, 38(8): 675-690.
[5] Abidov A, Slomka PJ, Nishina H, et al. Left ventricular shape index assessed by gated stress myocardial perfusion SPECT: initial description of a new variable. J Nucl Cardiol, 2006, 13(5): 652-659.
[6] 陈立军, 李守平, 张技革, 等. 两维超声心动图评价冠心病心肌梗塞患者左室形态及其与心脏功能关系. 中华超声影像学杂志, 1997, 6(3): 152-155.
[7] Sutton MG, Sharpe N. Left ventricular remodeling after myocardial infarction: pathophysiology and therapy. Circulation, 2000, 101(25): 2981-2988.
[8] 赵晓斌, 张承刚, 晋建华, 等. 心肌SPECT显像观察卡托普利对犬心肌梗死后左心室重构的作用. 中国医学影像学杂志, 2012, 20(3): 229-231, 233.
[9] Zaliaduonyte-Peksiene D, Vaskelyte JJ, Mizariene V, et al. Does longitudinal strain predict left ventricular remodeling after myocardial infarction? Echocardiography, 2012, 29(4): 419-427.
[10] Masci PG, Ganame J, Francone M, et al. Relationship between location and size of myocardial infarction and their reciprocal infuences on post-infarction left ventricular remodelling. Eur Heart J, 2011, 32(13): 1640-1648.
[11] Mather AN, Crean A, Abidin N, et al. Relationship of dysglycemia to acute myocardial infarct size and cardiovascular outcome as determined by cardiovascular magnetic resonance. J Cardiovasc Magn Reson, 2010, 2(12): 61.
[12] 郭玉英, 王跃涛, 朱峰, 等.99Tcm-MIBI心肌灌注显像半定量评价心肌梗死后左心室重构. 苏州大学学报(医学版), 2006, 26(5): 780-782.
[13] White M, Rouleau JL, Hall C, et al. Changes in vasoconstrictive hormones, natriuretic peptides, and left ventricular remodeling soon after anterior myocardial infarction. Am Heart J, 2001, 142(6): 1056-1064.
[14] Konstam MA, Kramer DG, Patel AR, et al. Left ventricular remodeling in heart failure: current concepts in clinical signifcance and assessment. JACC Cardiovasc Imaging, 2011, 4(1): 98-108.
[15] 陈明, 谢明星, 王新房, 等. 实时三维超声心动图评价冠心病患者左心室重构指数与收缩功能的研究. 中华超声影像学杂志, 2008, 17(9): 737-740.speckle tracking: comparison with MRI. Eur Heart J, 2009, 30(13): 1565-1573.
(本文编辑 冯 婕)
[13] Wen HL, Liang ZS, Yf Z, et al. Feasibility of detecting early left ventricular systolic dysfunction using global area strain:a novel index derived from three-dimensional speckle-tracking echocardiography. Eur J Echocardiogr, 2011, 12(12): 910-916.
[14] Rvitelli M, Filippelli A, Rinaldi B, et al. Effects of docosahexaenoic acid on [Ca(2+)](i) increase induced by doxorubicin in ventricular rat cardiomyocytes. Life Sci, 2002, 71(16): 1905-1916.
[15] Zuppinger C, Timolati F, Suter TM. Pathophysiology and diagnosis of cancer drug induced cardiomyopathy. Cardiovasc Toxicol, 2007, 7(2): 61-66.
[16] Goto KH, Mikami T, Onozuka H, et al. Role of left ventricular regional diastolic abnormalities for global diastolic dysfunction in patients with hypertrophic cardiomyopathy. J Am Soc Echocardiogr, 2006, 19(7): 857-864.
(本文编辑 张春辉)
Gated Myocardial Perfusion Imaging Quantitative Analysis Technique in Evaluation of Left Ventricular Remodeling and Its Effect on Cardiac Function After Myocardial Infarction
PurposeTo investigate the clinical value of gated myocardial perfusion imaging (GMPI) quantitative analysis technique in evaluating left ventricular remodeling and its effects on left ventricular function in patients with myocardial infarction (MI).Materials and MethodsSeventysix cases of MI patients were retrospectively analyzed, including pure left anterior descending artery (LAD) disease in 21 cases , left circumfex artery (LCX) or right coronary branch (RCA) disease in 23 patients and multivessel disease in 32 cases. Seventy-four healthy people were additionally selected as control group. GMPI was performed on all subjects. Reconstruction images were automatically analyzed by using cardiac software QGS 2009 to obtain left ventricular remodeling index, including diastolic sphericity index (SIED) and end-systolic sphericity index (SIES). Cardiac function parameters were also obtained, including left ventricular end-diastolic volume (EDV), end-systolic volume (ESV), left ventricular ejection fraction (LVEF), and peak flling rate (PFR). Differences of the left ventricular remodeling index and cardiac function parameters between the MI group and the control group were compared to analyze the relationship between left ventricular remodeling after myocardial infarction and coronary artery lesions.ResultsSIED, SIES and EDV, ESV in MI group were signifcantly higher than those in the normal group (P<0.01). The cardiac function parameters of LVEF and PFR were significantly lower than those of the normal group (P<0.01). SIED and SIES in the group of LAD lesions and multi-vessel disease were signifcantly higher than those in the LCX/RCA lesion group (P<0.05). The left ventricular remodeling was occurred more often in LAD lesion group and multi-vessel disease group than in the LCX/RCA lesion group (χ2=6.502 and 10.166, P<0.05). There was no significant difference between the LAD lesions group and multi-vessel disease group (χ2=0.105, P>0.05). Linear regression analysis showed that LVEF and PFR in group of left ventricular remodeling was signifcantly lower with the increase of SIED (F=43.231 and 15.642, P<0.01). SIED and SIES analysis resulted in high correlation for both intra-observer and inter-observer (r=0.881-0.926, P<0.01).ConclusionLeft ventricular remodeling after myocardial infarction can be accurately evaluated by GMPI. Patients with myocardial infarction due to LAD or multi-vessel coronary artery diseases may have left ventricular remodeling easier and more severe. Left ventricular remodeling will seriously affect the myocardial contraction and diastolic function, resulting in the entire left ventricular dysfunction.
Myocardial infarction; Gated blood-pool imaging; Myocardial reperfusion; Perfusion imaging; Ventricular function, left
江苏省常州市第一人民医院核医学科江苏常州 213003
王跃涛
Department of Nuclear Medicine, the First People's Hospital of Changzhou, Changzhou 213003, China
Address Correspondence to: WANG Yuetao
E-mail: yuetao-w@163.com
江苏省卫生厅科技项目(H201349);
江苏省常州市科技项目(CJ20112007)。
R542.2+2;R814.43
2014-06-12
修回日期:2014-09-15
中国医学影像学杂志
2014年 第22卷 第10期:749-753
Chinese Journal of Medical Imaging
2014 Volume 22(10): 749-753
10.3969/j.issn.1005-5185.2014.10.007
