壳聚糖固定化茶皂素脱色酶及其酶学性质的研究
2014-03-10李艳丽陈列忠陶瑛妮
李艳丽,陈列忠,陶瑛妮
(1.浙江省农业科学院植物保护与微生物研究所,浙江杭州 310021;2.浙江省植物有害生物防控重点实验室-省部共建国家重点实验室培育基地,浙江杭州 310021;3.浙江中医药大学,浙江杭州 310053)
壳聚糖固定化茶皂素脱色酶及其酶学性质的研究
李艳丽1,2,陈列忠1,2,陶瑛妮3
(1.浙江省农业科学院植物保护与微生物研究所,浙江杭州 310021;2.浙江省植物有害生物防控重点实验室-省部共建国家重点实验室培育基地,浙江杭州 310021;3.浙江中医药大学,浙江杭州 310053)
以壳聚糖微球为载体,戊二醛为交联剂,对茶皂素脱色酶进行固定化,并对固定化酶的各种性质进行了研究。结果表明,0.5 g壳聚糖微球在5 m L 2.0%的戊二醛溶液中交联,固定5 mg茶皂素脱色酶,最终获得的酶活回收率为65.94%。固定化酶的最适温度为50℃,最适pH值为3.5,固定化酶的热稳定性、pH值稳定性以及保存稳定性都明显优于游离酶,该固定化酶还具有良好的操作性。
壳聚糖;固定化;茶皂素脱色酶
茶皂素作为一种从山茶科植物种子中提取的化合物,具有优良的乳化、分散、湿润、起泡、稳泡等作用,用途广泛,但产品色泽深、含量低却是限制其开发利用的主要质量原因。本研究室已从黄孢原毛平革菌发酵液中分离到了一种可以脱色茶皂素的生物酶,但由于自由酶本身具有不可重复使用、容易变性失活等[1]特性,限制了其实际应用。酶固定化技术是实现酶重复连续使用的有效手段。
壳聚糖分子中含有游离氨基,双功能试剂如戊二醛等与壳聚糖及蛋白酶上的氨基均能发生Schiff反应,因此可用其来作为固定化酶的载体。壳聚糖作为固定化酶载体还具有机械性能好,化学性质稳定,耐热性好以及使酶免受金属离子抑制等优点,成为近年来国内外研究最热门的固定化材料之一[2-5]。本试验采用壳聚糖固定茶皂素脱色酶,探讨了固定化酶脱色茶皂素的影响因素。
1 材料与方法
1.1 试验材料
茶皂素脱色酶由本实验室分离纯化,活力单位52 971 U·g-1;25%戊二醛(上海化学试剂站分装产品)为分析纯;98%4-氨基安替比林和壳聚糖(脱乙酰度90%)为化学纯(阿拉丁);试验中所用其余常用试剂均为分析纯,市售产品。
1.2 茶皂素脱色酶的固定
壳聚糖微球的制备参考文献[6]。
茶皂素脱色酶的固定。称取适量壳聚糖微球,加入一定浓度的戊二醛,在室温下搅拌,静置过夜,离心去上清液,将载体用蒸馏水冲洗以除去残余的戊二醛,抽滤。往交联好的壳聚糖微球中加入茶皂素脱色酶液,在室温下缓慢搅拌,静置过夜。离心弃去上清液,沉淀用蒸馏水反复冲洗,抽滤即得固定化酶。
1.3 酶活测定
脱色酶的活力定义为每毫升酶液(或每克酶粉)1 h内将茶皂素底物缓冲液在475 nm条件下D值降低1%为一个酶活单位U。
底物缓冲液的配置。以茶皂素做为底物,用pH值5.0的0.1 mol·L-1醋酸缓冲液溶解,配制成的溶液在475 nm分光光度计下测定D值为3.5。
自由茶皂素脱色酶活性测定。取0.5 m L酶液,加入3.5 mL的底物缓冲液,混合均匀后置于40℃水浴中保温1 h,475 nm分光光度计下测定D,并计算其降低百分比。固定化茶皂素脱色酶活性测定反应体系同自由漆酶,取适量固定化茶皂素脱色酶与底物混合,在30℃搅拌反应1 h,离心取上清液,于波长475 nm处测D值。固定化茶皂素脱色酶的酶活用每克载体具有的酶活单位(U·g-1)表示。
2 结果与分析
2.1 茶皂素脱色酶的固定
2.1.1 戊二醛浓度对酶固定化的影响
戊二醛是一种双官能团试剂,可与载体上的氨基进行schiff反应,再与酶发生schiff反应。称取壳聚糖微球0.5 g,分别加入不同浓度的戊二醛溶液(0.5%~3%)5 m L,按1.2节方法得到固定化酶,分别测各固定化酶的活力(图1)。固定化酶的活力随戊二醛浓度的增加而增大,当戊二醛浓度达到2%时,其活力达到最大,此后戊二醛浓度继续增加,而固定化酶的活力降低,说明酶分子活性基团被戊二醛过多地修饰导致了酶活力的下降。
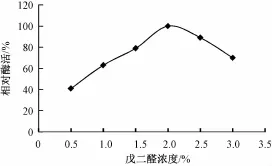
图1 戊二醛浓度对酶固定化的影响
2.1.2 加酶量对酶固定化的影响
取0.5 g壳聚糖微球与2%戊二醛的交联物,分别加入不同量的茶皂素脱色酶酶液,使之固定化,分别测定固定化酶活力(图2)。在壳聚糖结合位点未饱和前,固定化酶活力随着加酶量的增加而升高;但当加酶量超过5 mg后,固定化酶的活力不再增加,说明5 mg酶量已让结合位点达到饱和状态,继续增加酶量不能增加固定化酶的相对活力。
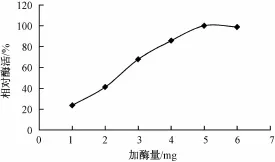
图2 加酶量对酶固定化的影响
在试验条件下,0.5 g壳聚糖微球在5 m L 2.0%的戊二醛溶液中交联过夜后,加入5 mg酶量的溶液,在室温下吸附反应过夜,最终获得的酶活回收率为65.94%。
2.2 固定化酶的性质
2.2.1 温度对固定化酶活力的影响
按照茶皂素脱色酶反应体系,分别于不同温度下测定固定化酶的活力(图3)。游离酶的最适温度为40℃,且在30~40℃温度内保持较高的酶活;固定化酶的最适温度为50℃,且在40℃~60℃内都保持了较高的酶活力。这说明固定酶不但比游离酶最适反应温度有所提升,还扩大了温度反应范围,对温度的敏感性有所下降。
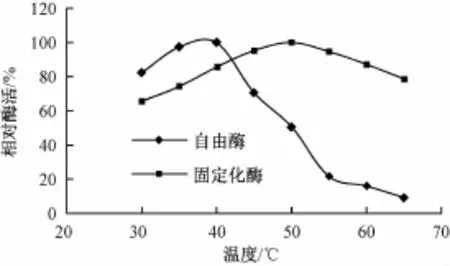
图3 温度对自由酶和固定化酶活力的影响
2.2.2 pH值对固定化酶活力的影响
按照茶皂素脱色酶反应体系,分别于不同pH值下测定固定化酶的活力(图4)。游离酶的最适pH值为4.5,固定化酶的最适pH值为3.5,相对于游离酶,固定化酶的最适pH向酸性发生了偏移。
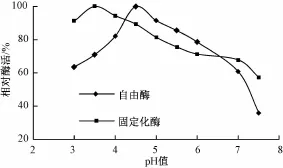
图4 pH值对自由酶和固定化酶活力的影响
2.2.3 固定化酶的热稳定性
取一定量的固定化酶和游离酶,分别加入pH值4.0的缓冲液,在不同温度下处理30 m in,测定其酶活(图5)。酶经固定化后热稳定性较游离酶显著提高。这可能是酶与载体的结合影响了酶的稳定性,酶经载体吸附和戊二醛交联后,增加酶构型的牢固程度,同时酶蛋白在固定化后,限制了酶分子之间的相互作用,阻止了酶的自溶,从而明显增加了酶的热稳定性。
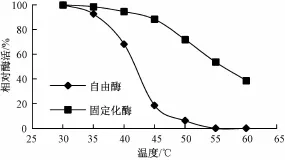
图5 自由酶和固定化酶的热稳定性
2.2.4 固定化酶的操作稳定性
游离酶无法从反应体系中分离,因此不能重复利用。而固定化酶则可从反应体系中分离并重复使用。将0.5 g固定化酶与茶皂素溶液在50℃下连续反应6次,每次反应时间为1 h,反应后分别测定酶活力(图6)。固定化酶的活力基本保持稳定,活力损失小于20%,由此可见,该固定化酶具有良好的操作稳定性。
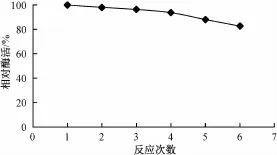
图6 固定化酶的操作稳定性
2.2.5 固定化酶的保存稳定性
将自由酶和固定化酶在4℃下存放2周,每2 d测定其酶活力(图7)。固定化酶的储存稳定性较好,2周后约有90%的相对酶活,而自由酶仅为74%,由此可见,固定化酶的储存稳定性大大提高。
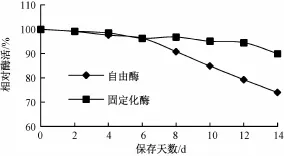
图7 自由酶和固定化酶的保存稳定性
3 小结
以壳聚糖微球为载体,戊二醛为交联剂,固定茶皂素脱色酶的最佳条件为:0.5 g壳聚糖微球在5 m L 2.0%的戊二醛溶液中交联过夜后,加入5 mg酶量的溶液,在室温下吸附反应过夜,最终获得的酶活回收率为65.94%。
固定化酶的最适温度为50℃,最适pH值为3.5,且其热稳定性、pH稳定性以及保存稳定性都明显优于游离酶,同时还具有良好的操作性。
[1] Durán N,Rosa M A,D,Annibale,et al.Applications of laccases and tyrosinases(phenoloxidases)immobilized on different supports:a review[J].Enzyme and M icrobial Technology,2002,31:926-927.
[2] 莫旖,姬琳,柳畅先.固定化脲酶的制备及应用[J].分析科学学报,2013,29(1):85-88.
[3] 王周利,岳田利,袁亚宏,等.脂环酸芽孢杆菌α-葡萄糖苷酶固定化及酶学性质研究[J].中国食品学报,2013, 13(2):67-72.
[4] 周涛,朱雄军,苏建华,等.葡萄糖氧化酶的有机相共价固定化[J].生物工程学报,2012,28(4):476-487.
[5] 李璟,王燕,杨山虎,等.固定化微生物脂肪酶粉转化生物柴油研究[J].浙江农业学报,2012,24(3):494-498.
[6] 罗华丽,鲁在君.壳聚糖微球制备工艺优化与分析[J].周口师范学院学报,2007,24(2):63-66.
(责任编辑:张瑞麟)
S 182
A
0528-9017(2014)03-0387-03
文献著录格式:李艳丽,陈列忠,陶瑛妮.壳聚糖固定化茶皂素脱色酶及其酶学性质的研究[J].浙江农业科学,2014(3):387-389.
2013-11-19
杭州市农业科研攻关项目(20120232B61);杭州市科技发展项目(20110232B11)
李艳丽(1980-),女,山东威海人,助理研究员,从事微生物学研究工作。E-mail:89746744@qq.com。
陈列忠。E-mail:zwsclz@163.com。
