温度对海刺猬(Glyptocidaris crenularis)和中间球海胆(Strongylocentrotus intermedius)遮蔽行为的影响*
2014-03-09罗世滨周海森田晓飞常亚青
赵 冲 罗世滨, 周海森 田晓飞 常亚青①
(1.中国海洋大学 海洋生命学院 青岛 266003;2.大连海洋大学 农业部北方海水增养殖学重点实验室 大连 116023;3.广东海兴农集团有限公司 广州 510000)
海胆是一类具有重要生态功能的海洋底栖生物,是海洋生态系统中非常重要的一环(Pearseet al,2006),具有重要的生态学和行为学研究价值(常亚青等,2004)。研究表明,温度显著影响海胆的呼吸(Siikavuopioet al,2008)、摄食(Lawrenceet al,2009)、生长(Siikavuopioet al,2012)、性腺发育(Kayabaet al,2012)、繁殖(Binetet al,2013)和幼体发育(Azadet al,2012;Delormeet al,2013)。在生物体应对各种环境变化过程中,行为是最先受到影响和改变的(Ruzzante,1994;Clarke,2003;Moretzet al,2007)。因此,无论海洋还是陆地环境,温度都是影响动物行为最重要的非生物因子(Briffaet al,2013)。然而,海胆对于温度的行为响应却鲜有报道。
遮蔽行为是指海胆利用栖息地周围的贝壳、藻类碎块、小石块等物体遮蔽自身的一种行为(Verlinget al,2002,图1a)。目前的研究表明,海胆的遮蔽行为可能具有躲避敌害、避光、获取食物等功能,并且易受光照和水流等外界环境因素的影响(Kehaset al,2005;Dumontet al,2007)。Barnes 等(2001)研究发现夏季出现遮蔽行为的拟球海胆(Paracentrotus lividus)明显多于冬季。这一研究结果暗示温度可能影响海胆的遮蔽行为。但在他们的研究中,季节和光周期也可能对海胆遮蔽行为产生影响。温度,作为一个单独的因素,对海胆遮蔽行为的影响国内外均未见报道。
海刺猬(Glyptocidaris crenularis),属棘皮动物门、游在亚门、海胆纲、正形目、疣海胆科,是疣海胆科目前存活的唯一代表种,主要分布在中国黄海北部及日本海的部分海域,属于我国的原种;中间球海胆(Strongylocentrotus intermedius)属海胆纲、正形目,球海胆科,原产于日本北海道和俄罗斯远东等地区沿海,于1989年引进中国,属于引进种类。两种海胆在地理分布、生物学特征、食物偏好和生态特点上都存在一定的差异(常亚青等,2004),因此,具有重要的比较行为学研究价值。本文比较研究了海刺猬和中间球海胆在不同温度和温度变化条件下的遮蔽行为,以期为海胆行为生态学研究提供新的信息。
1 材料与方法
1.1 实验动物
海刺猬(G.crenularis)于2011年2月购自辽宁大连海宝渔业有限公司,然后在实验室中饲养至行为实验,实验时为 17月龄海胆。中间球海胆(S.intermedius)为实验室于2010年10月培育并饲养至实验进行,实验时为12月龄海胆。
1.2 实验设计
本实验分为两个部分:第一部分研究不同温度条件下海刺猬和中间球海胆遮蔽行为(实验 1);第二部分研究不同温度变化对海刺猬和中间球海胆遮蔽行为的影响(实验 2)。实验中所用的控温设备为品字形可控生态实验系统。遮蔽材料(贝壳)的放置以及行为学观察、记录方法均参考常亚青等(2013)。
实验 1 设计 5°C、15°C和25°C三个温度梯度,每个梯度 3个重复,每个重复中放置12只海胆,每个实验水槽中放入 40个贻贝(Mytilus galloprovincialis)贝壳,均匀置于水槽底部(图1b)。持续5天观察海刺猬的遮蔽行为,持续6天观察中间球海胆的遮蔽行为,每天观察一次。

图1 海胆的遮蔽行为(a)及控温实验水槽及贝壳布置(b)Fig.1 Covering behavior of a sea urchin(a) and distribution of shells on the bottom of a tank(b)
实验 2设计三个温度变化组,分别为+5°C(15°C→20°C)、+15°C(5°C→20°C)和-5°C(25°C→20°C),每个温度变化组设三个重复,每个重复中放置 12只海胆。贝壳放置方法与实验1相同。实验前先将海刺猬和中间球海胆分别置于5°C、15°C和25°C水温下养殖 6天,海水 24h循环,不投喂。实验开始时,将各温度条件下养殖的海胆分别放入到 9个水温为20°C的水槽中。实验期间不投食,海水不循环、不通气。实验以各组投放海胆后最后一个海胆落到容器底部的时间为各组记录的初始时间,记录每组第一个海胆首次出现遮蔽行为的时间,并且每隔10min记录各组有遮蔽行为的海胆数、海胆用于遮蔽行为的贝壳数,连续观察180min。
实验各组海胆的壳径、壳高和体重均没有显著差异(P>0.05,表1)。但两种海胆之间的规格存在较大差异。各组所用的贝壳除了 25°C(25°C→20°C)组的壳长显著小于其它两组外(P<0.05),其它规格均没有显著差异(P>0.05)。

表1 实验所用海胆及贝壳的规格Tabl.1 Size of sea urchins and shells used in the experiment
1.3 统计方法
首先,用Kolmogorov-Smirnov检验和Levene检验对实验数据的正态性和方差齐性分别进行统计检验。结果表明,所有数据均符合正态分布。用重复度量方差分析(Repeated measured ANOVA)统计分析了实验1和实验2中海刺猬和中间球海胆出现遮蔽行为的个体数和海胆在该行为中所利用的贝壳数。在实验2中,中间球海胆初始遮蔽时间符合方差齐性,因此利用单因素方差分析(One-way ANOVA)比较了各组之间的差异;海刺猬初始遮蔽时间不符合方差齐性,故利用Kruskal-Wallis H test来比较各组之间的差异。所有实验数据均利用 SPSS 16.0软件进行统计分析,统计显著性水平均设置为P<0.05。
2 结果
2.1 实验1
实验 1中不同温度组海刺猬和中间球海胆具有遮蔽行为的个体数随时间的变化分布分别见图2和图3。在观察周期内,不同温度条件下海刺猬和中间球海胆具有遮蔽行为的海胆数随时间都没有出现大的波动变化。但两种海胆在不同温度条件下具有遮蔽行为的个体数却存在着明显的差异。海刺猬在5°C下具有遮蔽行为的个体数要显著少于15°C和25°C两组(P<0.05),而后两组没有显著差异(P>0.05)。中间球海胆在25°C下具有遮蔽行为的个体数要显著少于15°C和5°C两组(P<0.05),而后两组没有显著的差异(P>0.05)。
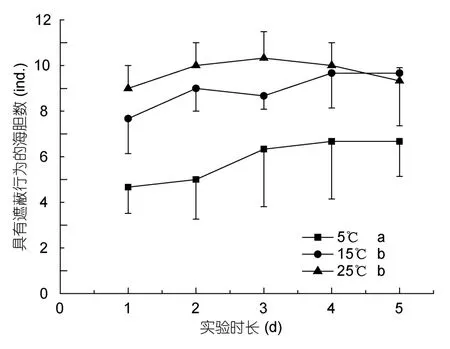
图2 不同温度下具有遮蔽行为的海刺猬个体数Fig.2 The number of G.crenularis in covering behavior at different temperatures

图3 不同温度下具有遮蔽行为的中间球海胆个体数Fig.3 The number of S.intermedius in covering behavior at different temperatures

图4 不同温度条件下海刺猬用于遮蔽行为的贝壳数Fig.4 The number of shells used by G.crenularis for covering at different temperatures

图5 不同温度条件下中间球海胆用于遮蔽行为的贝壳数Fig.5 The number of shells used by S.intermedius for covering at different temperatures
实验 1中不同温度下海刺猬和中间球海胆遮蔽行为利用的贝壳数随时间的变化见图4和图5。在观察周期内,不同温度下海刺猬和中间球海胆用于遮蔽行为的贝壳数随时间都没有出现大的波动。但不同温度下两种海胆用于遮蔽行为的贝壳数存在明显差异。海刺猬在5°C时利用的贝壳数要显著少于25°C组(P<0.05),而与 15°C 组没有显著的差异(P>0.05)。中间球海胆在 25°C下所利用的贝壳数要显著少于15°C和5°C两组(P<0.05),而后两组没有显著的差异(P>0.05)。实验数据表明:两种海胆用于遮蔽行为的贝壳数最少的温度条件正好相反。
2.2 实验2
实验 2中各组海胆初始遮蔽时间的比较列于表2。两种海胆在不同温度变化中初始遮蔽时间都没有显著的差异(P>0.05)。中间球海胆遮蔽行为的反应时间明显快于海刺猬。
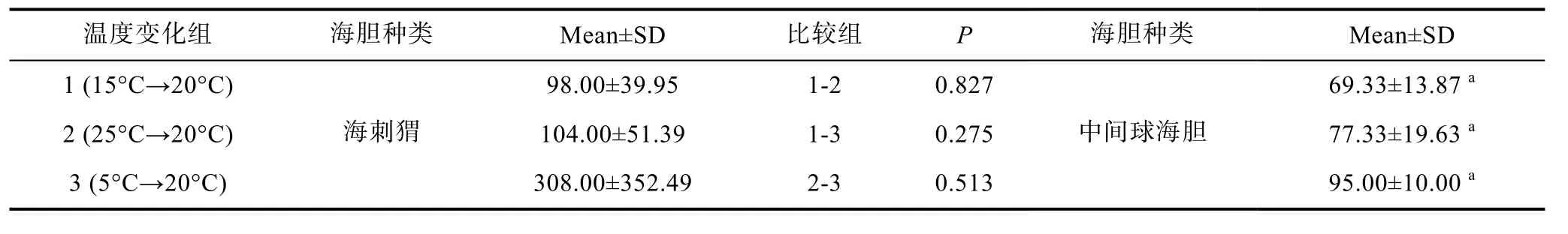
表2 不同温度变化条件下海刺猬和中间球海胆初始遮蔽时间(单位:秒)Tab.2 The reaction time of covering behavior in G.crenularis and S.intermedius when temperature changed(unit:s)
不同温度变化组海刺猬和中间球海胆具有遮蔽行为的个体数随时间的变化见图6和图7。三个温度变化组中出现遮蔽行为的海胆数都随着时间而逐渐增加,在 15°C→20°C 和 25°C→20°C 组,海刺猬具有遮蔽行为的个体数都在第20min达到稳定状态;而在5°C→20°C 下,在第 10min,具有遮蔽行为的海刺猬个数最少,到第60min达到稳定状态。然而,总体而言,三个温度变化组具有遮蔽行为的海刺猬个体数没有显著的差异(P>0.05)。
中间球海胆具有遮蔽行为的个体数在 25°C→20°C下随着时间的变化没有出现太大波动,而另外两组则随着时间的推移而略有减少。在第 10min,25°C→20°C 下的中间球海胆具有遮蔽行为的个体数最少。总体而言,三个温度变化组具有遮蔽行为的中间球海胆个体数没有显著差异(P>0.05)。

图6 不同温度变化条件下具有遮蔽行为的海刺猬个体数Fig.6 The number of G.crenularis with covering behavior when temperature changed

图7 不同温度变化条件下具有遮蔽行为的中间球海胆个体数Fig.7 The number of S.intermedius with covering behavior when temperature changed
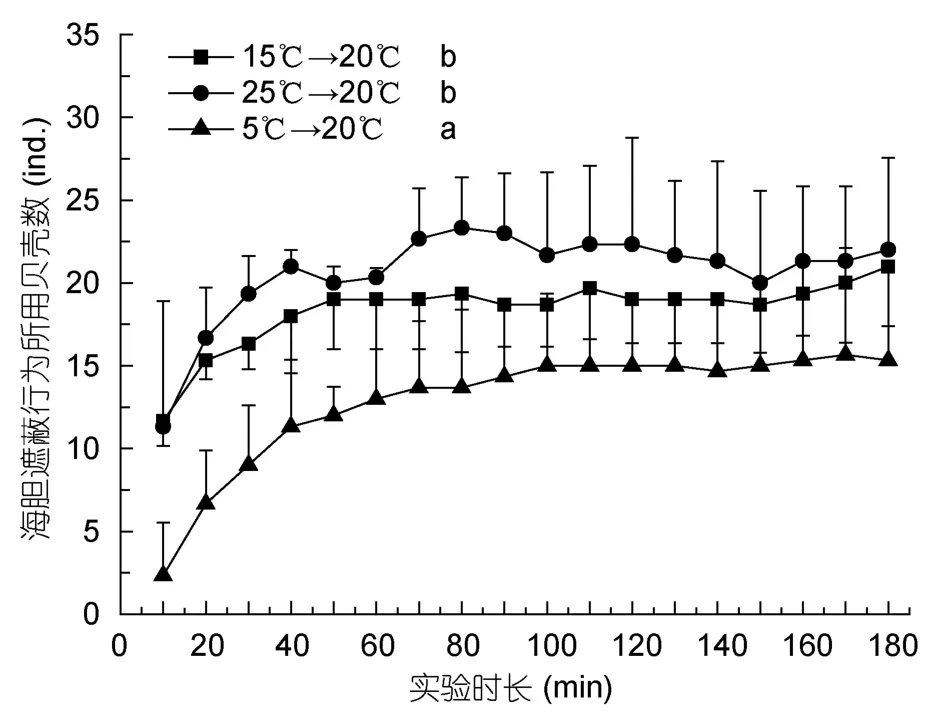
图8 不同温度变化条件下被海刺猬用于遮蔽行为的贝壳数Fig.8 The number of shells used by G.crenularis for covering when temperature changed
不同温度变化下海刺猬和中间球海胆用于遮蔽行为的贝壳数量随时间的变化见图8和图9。5°C→20°C组海刺猬遮蔽行为所利用的贝壳数显著最少(P<0.05),另外两组没有显著的差异(P>0.05)。25°C→20°C 组的中间球海胆所利用的贝壳数显著最少(P<0.05),另外两组差异不显著(P>0.05)。
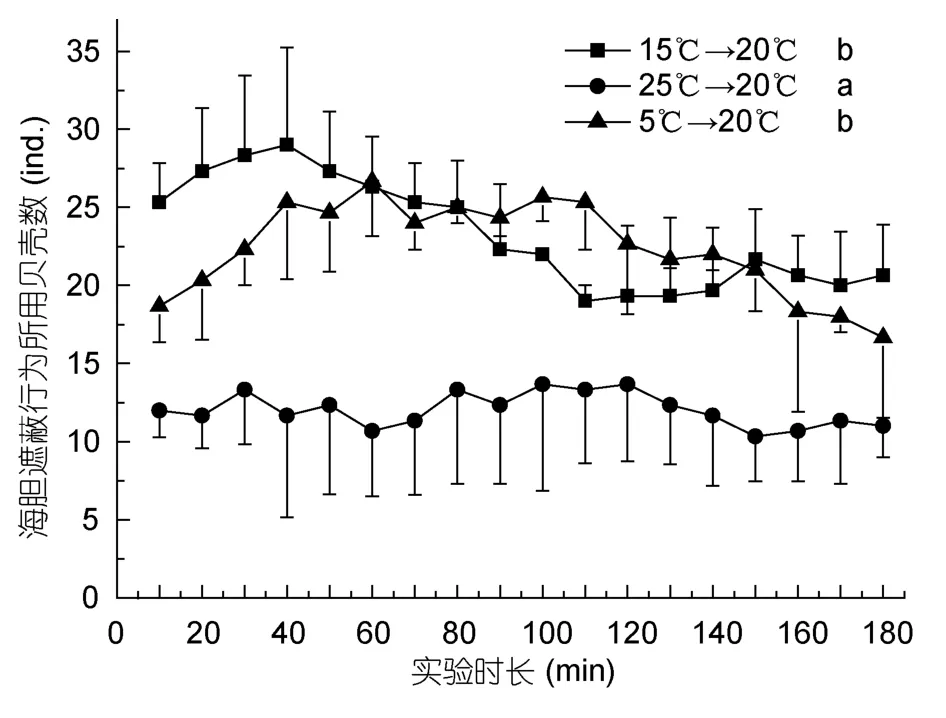
图9 不同温度变化条件下被中间球海胆用于遮蔽行为的贝壳数Fig.9 The number of shells used by S.intermedius for covering when temperature changed
3 讨论
Barnes等(2001)研究发现拟球海胆夏季出现遮蔽行为的个体数要明显多于冬季,并认为这可能与不同季节光照、海胆可利用的遮蔽材料以及捕食者的活动强度有关,而没有考虑不同季节温度显著不同这一潜在影响因素。本文研究结果表明,海刺猬在低温条件下(5°C)遮蔽行为能力显著低于其在 15°C 和25°C水温条件下的相应能力。这一结果与Barnes等(2001)的研究结果相吻合。本研究用实验行为生态学的方法,约束实验动物以相同的光照条件和遮蔽材料,并去除捕食者的效应,证明温度同样是海胆的遮蔽行为的重要影响因素,为海胆遮蔽行为的环境影响研究提供了新的信息和思路。研究表明,低温显著影响拟球海胆的生理代谢(Catarinoet al,2012),18—22°C是拟球海胆生长和性腺发育的最适水温(Shpigelet al,2004),而且,活力好的拟球海胆比活力弱的个体具有更快的遮蔽速度和更强的遮蔽能力(Crook,2003)。本文研究结果也表明,低温显著阻碍海刺猬的性腺生长。动物行为学研究表明,对温度敏感响应的生理代谢及适应性性状与动物行为之间存在着紧密的关联(Briffaet al,2013)。这是对于低温条件下海刺猬和拟球海胆遮蔽行为能力较弱的一个非常合理的解释。与海刺猬不同,中间球海胆在高温条件下(25°C)遮蔽行为能力显著低于 5°C和 15°C水温条件下的相应能力。中间球海胆属于冷水性动物,对高温比较敏感,夏季长时间超过 23°C会导致其大量死亡(Fuji,1967;常亚青等,2004),其耗氧率从5—20°C 随着温度的升高而显著升高(Sedova,2000),且高温(22°C)显著抑制中间球海胆的食物同化率和性腺生长(Lawrenceet al,2009)。中间球海胆的遮蔽行为结果进一步印证了生理代谢及适应性性状与海胆行为的紧密关联。本研究结果表明,海胆在其适宜的生理生态条件下能够表现出更强的行为能力。Verling等(2004)比较研究了拟球海胆和紫海胆(S.purpuratus)的遮蔽行为。研究结果表明,在不同的栖息地和潮位,拟球海胆的遮蔽行为能力都高于紫海胆。而在本研究中,海刺猬和中间球海胆遮蔽对不同温度的行为响应能力完全不同。这说明不同种类的海胆遮蔽行为能力不同,而且对不同环境因子具有不同的行为响应能力。这一行为差异的机理很可能与不同种类海胆不同的生理代谢规律相关(Briffaet al,2013)。
为了更为深入地理解海刺猬和中间球海胆对温度的行为响应,我们进一步研究了不同温度变化量及不同的温度变化方向(高温→低温或者低温→高温)对两种海胆遮蔽行为的影响。我们发现 15°C→20°C和25°C→20°C组海刺猬的遮蔽能力没有显著差异。这说明在一定温度范围内,温度变化方向(升温或降温)对海刺猬的遮蔽行为影响不大。5°C→20°C 组的海刺猬遮蔽行为所利用的贝壳数显著少于其他两组。这可能和起始温度有关,也可能与较大的温度变幅有关。然而,与海刺猬的结果不同,具有较小温度变幅(25°C→20°C)组的中间球海胆的遮蔽行为能力要显著低于其他两组个体。这说明在一定温度范围内温度变幅对海胆遮蔽行为影响不大。我们发现实验2中对海刺猬和中间球海胆遮蔽行为能力影响最大的温度变化组的初始温度分别为5°C和25°C。有趣的是,这正是实验 1中所证明的对它们遮蔽行为影响作用最大的温度点。综合海刺猬和中间球海胆的数据结果,我们认为,海胆对温度变化的遮蔽行为响应更大程度上取决于初始温度,而不是变化幅度和变化方向。温度变化虽然显著地影响海刺猬和中间球海胆遮蔽用的贝壳数,但并不显著影响有遮蔽行为的海胆数和它们遮蔽的速度。这表明海刺猬和中间球海胆在是否遮蔽以及遮蔽强度之间的权衡。
综上所述,海刺猬和中间球海胆的遮蔽行为能力都在其生理生态的适宜温度下最强,在温度胁迫条件下显著减弱;海刺猬和中间球海胆对于不同温度的遮蔽行为响应能力不同;在5—25°C范围内,温度变化对海刺猬和中间球海胆的遮蔽行为的影响主要取决于初始温度,而与温度变幅和变化方向关系不大。
常亚青,丁 君,宋 坚等,2004.海参、海胆生物学研究与养殖.北京:海洋出版社,254—256
常亚青,李云霞,罗世滨等,2013.不同实验生态环境对海刺猬(Glyptocidaris crenularis)的遮蔽行为的影响.生态学报,33(9):2754—2760
Azad A K,Pearce C M,McKinley R S,2012.Influence of stocking density and temperature on early development and survival of the purple sea urchin,Strongylocentrotus purpuratus(Stimpson,1857).Aquaculture Research,43(11):1577—1591
Barnes D,Crook A,2001.Quantifying behavioural determinants of the coastal European sea urchinParacentrotus lividus.Marine Biology,138(6):1205—1212
Binet M T,Doyle C J,2013.Effect of near-future seawater temperature rises on sea urchin sperm longevity.Marine and Freshwater Research.64(1):1—9
Briffa M,Bridger D,Biro P,2013.How does temperature affect behaviour Multilevel analysis of plasticity,personality and predictability in hermit crabs.Animal Behaviour,86(1):47—54
Catarino A I,Bauwens M,Dubois P,2012.Acid-base balance and metabolic response of the sea urchinParacentrotus lividusto different seawater pH and temperatures.Environment Science Pollution Research,19(6):2344—2353
Clarke A,2003.Costs and consequences of evolutionary temperature adaptation.Trends in Ecology and Evolution,18(11):573—581
Crook A C,2003.Individual variation in the covering behaviour of the shallow water sea urchinParacentrotus lividus.Marine Ecology,24(4):275—287
Delorme N J,Sewell M A,2013.Temperature limits to early development of the New Zealand sea urchinEvechinus chloroticus(Valenciennes,1846).Journal of Thermal Biology,38(5):218—224
Dumont C P,Drolet D,Deschênes Iet al,2007.Multiple factors explain the covering behaviour in the green sea urchinStrongylocentrotus droebachiensis.Animal Behaviour,73(6):979—986
Fuji A,1967.Ecological studies on the growth and food consumption of Japanese common littoral sea urchin,Strongylocentrotus intermedius(A.Agassiz).Memoirs of the Faculty of Fisheries Hokkaido University,15(2):83—160
Kayaba T,Tsuji K,Hoshikawa H,2012.Effect of low temperature rearing,using deep-sea water,on gonadal maturation of the short-spined sea urchin,Strongylocentrotus intermedius,in Rausu,Hokkaido.Fisheries Science,78(6):1263—1272
Kehas A J,Theoharides K A,Gilbert J J,2005.Effect of sunlight intensity and albinism on the covering response of the Caribbean sea urchinTripneustes ventricosus.Marine Biology,146(6):1111—1117
Lawrence J M,Cao X B,Chang Y Qet al,2009.Temperature effect on feed consumption,absorption,and assimilation efficiencies and production of the sea urchinStrongylocentrotus intermedius.Journal of Shellfish Research,28(2):389—395
Moretz J A,Martins E P,Robison B D,2007.Behavioral syndromes and the evolution of correlated behavior in zebrafish.Behavioral Ecology,18(3):556—562
Pearse J S,2006.Ecological role of purple sea urchins.Science,314(5801):940—941
Ruzzante D E,1994.Domestication effects on aggressive and schooling behavior in fish.Aquaculture,120(1—2):1—24
Sedova L G,2000.Effect of temperature on the rate of oxygen consumption by the sea urchinStrongylocentrotus intermedius.Biologiya Morya,26(1):53—54
Shpigel M,McBride S C,Marciano Set al,2004.The effect of photoperiod and temperature on the reproduction of European sea urchinParacentrotus lividus.Aquaculture,232(1):343—355
Siikavuopio S I,Mortensen A,Christiansen J S,2008.Effects of body weight and temperature on feed intake,gonad growth and oxygen consumption in green sea urchin,Strongylocentrotus droebachiensis.Aquaculture,281(1):77—82
Siikavuopio S I,James P,Lysne Het al,2012.Effects of size and temperature on growth and feed conversion of juvenile green sea urchin(Strongylocentrotus droebachiensis).Aquaculture,354—355:27—30
Verling E,Crook A,Barnes D,2002.Covering behaviour inParacentrotus lividus:is light important? Marine Biology,140(2):391—396
Verling E,Crook A C,Barnes D K,2004.The dynamics of covering behaviour in dominant echinoid populations from American and European west coasts.Marine Ecology,25(3):191—206
